Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Насичені одноатомні спирти (Алканоли).
Загальна формула спиртів: СnH2n+1ОН де: n = 1,2,3,4 і т.д. або ROH, де R – СН3, С2Н5, С3Н7 і т.д. або CnH2n+2 O де: n = 1,2,3,4 і т.д.
Номенклатура алканолів За міжнародною(систематичною або номенклатурою ІЮПАК) назви спиртів походять від відповідних назвалканів із додаванням закінчення ол. За історичною номенклатурою назви спиртів походять від відповідних назв радикалів алканів з додаванням закінчення овий і слово спирт. СН3 ОН - метанол, метиловий спирт С2Н5 ОН - етанол, етиловий спирт С3Н7 ОН - пропанол, пропіловий спирт 1 2 3 3 2 1 СН3- СН─СН3 СН3- СН2─СН2- ОН | ОН пропан-1-ол пропан-2-ол
Алгоритм для складання назв розгалужених одноатомних спиртів за структурними формулами:
наводяться назви замісників, приєднаних до родоначальної структури, із вказівкою номера атома Карбону, до якого вони приєднані. Номери атомів Карбону(локанти) відокремлюються від назв замісників дефісом.
СН3 1 2 3 4| 5 СН3- СН─СН2 ─С ─СН3 || ОН СН3 4,4-диметилпентан-2-ол
Цифри, які стоять у назвах спиртів перед замісниками і перед розміщенням групи ОН називаються локантами. Тільки! одноатомні спирти поділяються на:
1. первинні[ п.] (група ОН знаходиться біля атома Карбону, що зв’язаний тільки з одним атомом Карбону);
СН3 1 2 3 4| 5 СН2 ─ СН2 ─СН2 ─СН─СН3 │ ОН 4-метилпентан-1-ол 2. вторинні[ в.] (група ОН знаходиться біля атома Карбону, що зв’язаний тільки з двома атомами Карбону); СН3 1 2 3 4| 5 СН3 ─ СН ─ СН2 ─С─СН3 || ОН СН3 4,4-диметилпентан-2-ол 3. третинні [ т.] (група ОН знаходиться біля атома Карбону, що зв’язаний тільки з трьома атомами Карбону). СН3 5 4 3 2| 1 СН3─СН2 ─ СН2 ─ С ─ СН3 | ОН 2-метилпентан-2-ол
Фізичні властивості спиртів Перші представники спиртів – це рідини, добре розчинні у воді, мають специфічний запах (СН3 ОН – отруйний, С2Н5 ОН – наркотик). Вищі спирти – тверді речовини, не розчинні у воді. Спирти є рідинами тому(на відміну від алканів з яких вони походять), що між молекулами існує водневий зв’язок. Спирти з а свєю будовою і фіз.. властивостями більше подібні до води і між молекулами води також існує водневий зв’язок (Н-ОН і R-ОН. Алканоли є і похідними від води, в якій один атом Н заміщений на вуглеводневий радикал).
δ+Н ─ Оδ- ·· ·· δ+Н ─ Оδ- ·· ·· δ+Н ─ Оδ- ·· ·· δ+Н ─ Оδ- вода | | | | Н Н Н Н
δ+Н ─ Оδ- ·· ·· δ+Н ─ Оδ- ·· ·· δ+Н ─ Оδ- ·· ·· δ+Н ─ Оδ- спирти | | | | R R R R
Хімічні властивості спиртів Всі хімічні властивості спиртів відбуваються по групі ОН як характеристичній (функціональній) групі спиртів. І. Реакції по атомі Н групиОН 1. реакція з лужними і лужно-земельними металами 2СН3 ОН + 2Na → 2СН3 ОNa + H2↑ Натрій метилат 2C3Н7 ОН + Ca → (С3Н7 О)2Ca + H2↑ Кальцій пропілат [Подібно як вода: 2Н ОН + 2Na → 2NaОН + H2↑ ] Сполуки формулою R-ONa називаються алкоголяти ( це солі – йонні сполуки). ІІ. Реакції по групі ОН 1. реакція з галогеноводнями (HCl, HBr, HI) При цьому група ОН спиртів заміщується на галоген.
СН3 ОН + HBr → СН3–Br + Н2О бромметан 2. реакція дегідратації ( починаючи від C2Н5 ОН ) А) внутрішньомолекулярна дегідратація Від однієї молекули спирту відщеплюється молекула води (група ОН і атом Н від атома С, що є сусіднім з атомом С, біля якого безпосередньо знаходиться група ОН) і утворюється а лкен. Каталізатор конц. H2SO4 і температура > 1400С
С2Н5 ОН → С2Н4 ↑ + Н2О С3Н7 ОН → С3Н6 ↑ + Н2О Б) міжмолекулярна дегідратація Від двох молекул спирту(однакових або різних) відщеплюється молекула води (атом Н від групи ОН першої молекули спирту і група ОН від другої молекули спирту) і утворюється етери (формулою R-O-R). Каталізатор конц. H2SO4 і температура < 1400С 2С2Н5 ОН → С2Н5-О-С2Н5 + Н2О Діетиловий етер С2Н5 ОН + С3Н7 ОН → С2Н5-О-С3Н7 + Н2О Етилпропіловий етер Реакція дегідрування Від однієї молекули спирту відривається молекула водню Н2 ( один атом Н від групи ОН, а другий Н від атома С біля якого безпосередньо знаходиться група ОН) і утворюється альдегід.
О СН3 ОН → Н-С + Н2 Н Метаналь (альдегід)
О СН3-СН2 ОН → СН3 - С + Н2 Н Етаналь, оцтовий альдегід
IІ. реакція окиснення 1. реакція горіння (повне і неповне): Внаслідок реакції повного горіння вуглеводнів утворюється завжди СО2 і Н2О. 2С3Н7 ОН + 9О2 → 6CО2 + 8H2О С2Н5 ОН + 3О2 → 2CО2 + 3H2О 2. реакція окиснення розчином KMnO4 Спирти окислюються розчином KMnO4, знебарвлюючи його, і при цьому утворюються альдегіди ( відбувається окиснення С-Н зв´язку біля атома С, який безпосередньо зв´язаний з групою ОН ) О СН3 ОН + [О] → Н- С + Н2О Н О СН3-СН2 ОН + [О] → СН3 - С + Н2 Н Етаналь, оцтовий альдегід
Добування спиртів І. СН3 ОН У промисловості одержують: - із «водяного газу» (СО +Н2): СО + 2Н2 → СН3 ОН - при розкладі деревини. ІІ. С2Н5 ОН 1. У промисловості одержують: - реакцією спиртового бродіння глюкози: С6Н12О6 → 2 С2Н5 ОН + 2СО2↑ -реакцією гідратації етилену в присутності конц. фосфатної кислоти: C2H4 + H2О → C2H5 -OH ІІІ. Загальні методи добування -реакцією гідратації алкенів в присутності конц. фосфатної кислоти: C3H6 + H2О → C3H7 -OH
- Реакція лужного гідролізу моногалогеналканів в присутності водного! розчину лугу
Водн.р-н лугу C2H5Cl + NaOH → C2H5 ОН + NaCl
Застосування спиртів І. СН3 ОН (деревний спирт) 1. як розчинник для лаків і фарб; 2. як замінник бензину; ІІ. С2Н5 ОН (винний спирт) 1. як розчинник у парфумерії; 2. в харчовій промисловості як консервант; 3. як алкогольний напій; 4. для одержання синтетичного каучуку (бутадієновий каучук); 5. як замінник бензину(пальне для автомобілів).
Багатоатомні спирти
Найбільш практичне значення мають дво і триатомні спирти. Необхідно пам’ятати, що кожна група ОН повинна знаходитися біля одного атома Карбону. За міжнародною номенклатурою назви їх походять від назв алканів з додаванням закінчення -діол чи тріол. Для деяких з них характерні і історичні назви. СН2 – СН2 СН2 – СН -СН2 | | | | | ОН ОН ОН ОН ОН Етан-1,2-діол пропан-1,2,3-тріол етиленгліколь гліцерин, гліцерол За фізичними властивостями багатоатомні спирти – це олієподібні рідини, добре розчинні у воді, солодкі на смак ( органічні сполуки, які містять 2 і більше груп ОН є солодкими на смак). Етиленгліколь – отруйний, а гліцерин – не шкідливий для людського організму( має гігроскопічні властивості використовується для пом´якшення шкіри в шкіряній промисловості та фармації).
Хімічні властивості багатоатомних спиртів В багатоатомних спиртах на відміну від одноатомних спиртів групи ОН впливають одна на одну і атоми Н стають більш рухливим у порівнянні з одноатомними (багатоатомні спирти – слабкі кислоти). У хімічних реакціях може брати участь як одна група ОН так і всі почергово.
І. Реакції по атомі Н групиОН 1. реакція з лужними і лужно-земельними металами СН2 ОН CН2 ОNa | + 2Na → | + Н2 СН2 ОН СН2 ОNa Натрій гліколят
СН2 ОН CН2 ОNa | | 2СН ОН + 6Na → 2СН ОNa + 3Н2↑ | | СН2 ОН СН2 ОNa Натрій гліцерат 2. реакція з нітратною кислотою Атоми Н груп ОН заміщуються на нітро-групу (вплив груп груп ОН одна на одну) СН2 ОН CН2 О-NО2 | | СН ОН + 3НО-NО2 → СН О-NО2 + 3Н2О | | СН2 ОН СН2 О-NО2 тринітрогліцерин 3. реакція з Сu(OH)2 Якісна реакція на багатоатомні спирти - це взаємодія багатоатомних спиртів з голубим осадом Сu(OH)2 при звичайних умовах при цьому утворюється синій прозорий розчин (вплив груп ОН одна на одну) СН2 ОН CН2 О | | Cu СН ОН + Cu(OH)2 → СН- О + 2Н2О | голубий | СН2 ОН осад СН2 ОH Купрум (ІІ) гліцерат (синій прозорий розчин) ІІ. Реакції по групах ОН 1. реакція з галогеноводнями (HCl, HBr, HI) СН2 ОН CН2 Cl | | СН ОН + 3НCl → СН- Cl + 3Н2О | | СН2 ОН СН2 Cl
IІІ. реакція окиснення 1. реакція горіння: Внаслідок реакції повного горіння спиртів утворюється завжди СО2 і Н2О. 2С3Н8О3 + 7О2 → 6CО2 + 8H2О
Добування спиртів І. Гліцерин 1. У промисловості одержують гідролізом жирів.
2. Реакція лужного гідролізу 1,2,3-трихлоропропану в присутності водного! розчину лугу
CН2 Cl CH2 ОН | | СН- Cl + 3KОH → CH-ОН + 3KCl | | СН2 Сl СН2 ОН
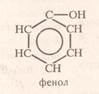
Застосування cпиртів І. Гліцерин 1. як незамерзаюча рідина в радіаторах машин (ТОСОЛ) -антифриз; 2. для одержання вибухівки; 3. у косметичній і шкіряній промисловості(гігроскопічність); 4. 1%-ний розчин три нітрогліцерину використовують в медицині як препарат, що розширює кровоносні судини. Фенол Фенол – це похідне від бензену, в якому один атом Н заміщений безпосередньо на групу ОН. С6Н5 ОН – фенол або гідроксибензен.
Необхідно пам’ятати: у фенолі група ОН безпосередньо зв’язана з бензеновим ядром, а в вроматичних спиртах група ОН зв’язана хоча б через один атом Карбону: С6Н5 ОН – фенол; С6Н5 – СН2 - ОН – бензиловий спирт (ароматичний спирт).
За фізичними властивостями фенол – це кристалічна речовина, трохи розчинна у воді, дуже отруйна.
Хімічні властивості фенолу У м олекулі фенолу відбувається взаємний вплив груп атомів одна на одну (С6Н5 і ОН) (подібно як в толуені).
С6Н5 так впливає на групу ОН, що атом Н її стає ще більш рухливим (С6Н5 має властивість відтягувати спільну пару електронів від атома Оксисену групи ОН, таким чином атом О стає позитивним, а він в свою чергу відтягує спільну пару електронів від атома Н, бо атом О є після Флюору найбільш електронегативним), ніж в багатоатомних спиртах (фенол є слабкою кислотою – карболова кислота). Група ОН таквпливає на бензенове ядро (С6Н5)( група ОН має властивість відштовхувати спільну пару електронів до атома С бензенового ядра, таким чином порушує спряження в ньому і неоднаково поляризується С-Н зв′язок в різних положеннях бензенового ядра), що атоми в положеннях 2,4,6- стають більш рухливішими і можуть заміщуватися на атоми або групи атомів. І. Реакції по атомі Н групиОН 1. реакція з лужними і лужно-земельними металами ( легше, ніж з спиртами) 2С6Н5 ОН + 2Na → 2С6Н5 ОNa + H2↑ Натрій фенолят 2. реакція з лугами (тільки для фенолу) С6Н5 ОН + NaОН → С6Н5 ОNa + H2О 3. реакція з FeCl3 – це якісна реакція на фенол, при цьому утворюється фіолетовий осад 3С6Н5 ОН + FeCl3 → (С6Н5 О)3Fe ↓ + 3 HCl Ферум(ІІІ) фенолят (фіолетовий осад) ІІ. Реакція по групі ОН 1. реакція з галогеноводнями (HCl, HBr, HI) Реакція з галогеноводнями не характерна для фенолу тому, що С6Н5 – феніл-радикал міцно утримує групу ОН і не дає можливості замістити її на галоген. ІІІ. Реакції заміщення( по групі С6Н5) 1. реакція галогенування (з «хлорною» чи «бромною водою») При цьому утворюється білий осад.(якісна реакція на фенол ).
С6Н5-ОН + 3Cl2 → С6Н2(Cl3) -ОН ↓ + 3HCl 2,4,6-трихлорофенол
2. реакція нітрування k. H2SO4 С6Н5-ОН + 3HO-NO2 → C6H2(NO2)3ОН + 3H2O 2,4,6-тринітрофенол (пікринова кислота)
IV. реакція окиснення 1. реакція горіння: Внаслідок реакції повного горіння фенолу утворюється СО2 і Н2О. С6Н5ОН + 7О2 → 6CО2 + 3H2О
Добування фенолу І. С6Н5 ОН У промисловості одержують за схемою: С6Н6 → С6Н5 Cl → С6Н5 ОН 1. С6Н5 ОН + Cl2 → С6Н5 Cl + HCl 2. С6Н5 Cl + NaOH → С6Н5 ОН + NaCl Застосування фенолу
І. С6Н5 ОН (карболка, карболова кислота) 1. як антисептик (для дезинфекції громадських приміщень); 2. для виробництва ліків, пластмас (фенол формальдегідних смол), вибухових речовин(пікринова кислота – жовтий барвник), лужного індикатора (фенолфталеїн).
|
||||||||
|
Последнее изменение этой страницы: 2016-06-26; просмотров: 510; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.67.251 (0.114 с.) |