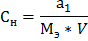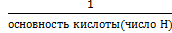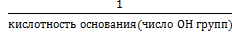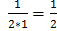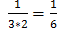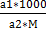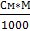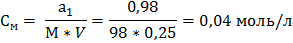Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
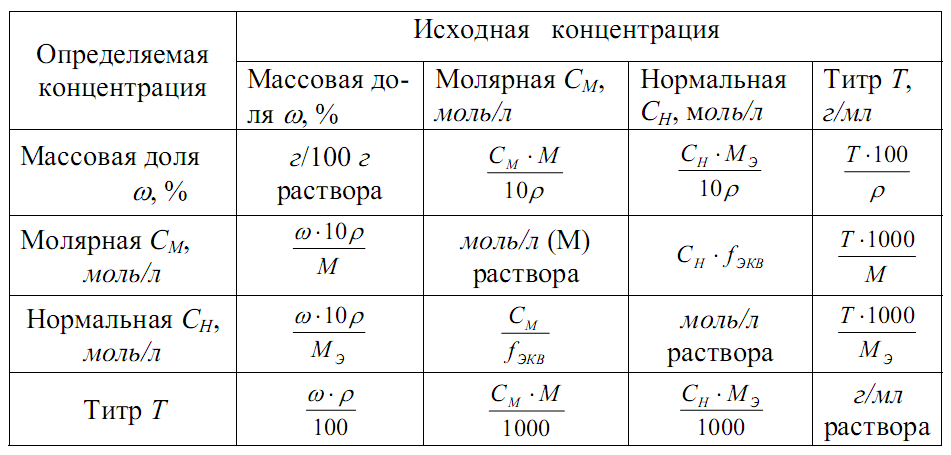
Способы выражения концентрации растворов.
Важнейшей характеристикой всякого раствора является концентрация. Концентрация- это величина, показывающая, сколько растворенного вещества содержится в определенном весовом или объемном количестве раствора. В химии используется несколько различных способов выражения концентрации. Кратко рассмотрим наиболее часто употребляемые. Ø Процентная концентрация (С%, %) показывает, сколько граммов растворенного вещества содержится в 100 граммах раствора.
{\displaystyle \omega (\%)={\frac {m_{1}}{m}}\cdot 100\%}
а2 –масса растворителя, г m – масса раствора, г; m=а1+а2 Пересчет объема раствора на массу проводится по формуле: m=V*ρ V- объем раствора, мл, л; Ρ-плотность, кг/м3, г/см3 1мл=1см3
Ø Молярная концентрация (См, моль/л ) показывает количество моль растворенного вещества содержится в 1 литре раствора. Моль — единица измерения количества вещества в Международной системе единиц (СИ-система интернациональная), одна из семи основных единиц СИ.
М – молярная масса вещества, г/моль; V- объём раствора, только в литрах. Ø Молярная концентрация эквивалента (Сн, моль/л) (нормальная концентрация) показывает, сколько моль-эквивалентов вещества содержится в 1 литре раствора
Мэ – молярная масса эквивалента (эквивалент вещества), г/моль; Мэ=f э*М f э- фактор эквивалентности f э (для кислоты) = HCl, о=0 H2SO4 ,0=2 H3PO4, о=3 f э (для основания) = NaOH, к=1 Cu(OH)2, к=2 Fe(OH)3, к=3 f э (для соли) =
f э (NaCl) = f э (CuSO4) = f э (Al2(SO4)3) =
Ø Моляльная концентрация (Сm, моль/кг растворителя) – показывает количество моль растворенного вещества в 1 кг растворителя или 1000г Сm= Ø Титр (Т, г/мл) – показывает количество граммов растворенного вещества в 1 мл раствора
где V – объём в мл. Т=
Пример 1. Определите процентную концентрацию нитрата калия в растворе, приготовленном из 500 г воды и 20 г соли Решение:
Пример 2. Определите молярную концентрацию раствора серной кислоты, в 250 мл которого содержится 0,98 г Н2SO4. Решение: Находим молярную массу Н2SO4: М=2*1+32+4*16=98 г/моль
Пример 3. Вычислите молярную концентрацию эквивалента (нормальную) 24%-го раствора соляной кислоты плотностью 1,120 г/мл Решение: Найдем массу одного литра раствора:
mр-ра= V*r= 1000*1,12=1120 г По определению процентной концентрации: 24 г HCL содержится в 100 г раствора Х г HCL содержится в 1120 г раствора Отсюда, Вычислим молярную концентрацию эквивалента: Мэ= 36,5 г/моль
Пример 4. Вычислите процентную концентрацию гидроксида калия в растворе с молярной концентрацией 2,36 моль/л и плотностью 1,10 г/мл Решение: Находим массу одного литра раствора: mр-ра= V*r= 1000*1,10=1100 г Вычислим массу КОН, содержащуюся в 1 литре раствора из формулы, М(КОН)=56 г/моль:
Отсюда а1=См*М*V=2,36*56*1=132,16 г Вычислим процентную концентрацию:
|
|||||
|
Последнее изменение этой страницы: 2022-09-03; просмотров: 69; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.218.215 (0.005 с.) |

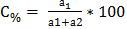
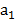 – масса растворенного вещества, г;
– масса растворенного вещества, г;