Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Методы и последовательность проведения лабораторной диагностики патологического материала при вирусных болезнях.
I. Вирусологический метод (АГ-?) (проверяем вируссодержащий материал на наличие вируса) 1) обнаружение вируса Микроскопия мазков (лучше отпечатков) на тельца-включения. А-обычная Б-люминесцентная (МФА, МФ) В-электронная Индикация вирусов- РГА, РГАд. 2) выделение вируса заражением чувствительных А-лабораторных животных Б-куриных эмбрионов В-культур тканей 3) идентификация, типизация, дифференциация вируса Постановкой серологических реакций с известными биофабричными диагностическими иммунными сыворотками. РН, РСК, РИД, РИЭОФ, МФА, ИФА, РЗГА, РНГА, РЗГАд. II. Серологический метод (АТ-?) (проверяем испытуемые сыворотки на наличие антител) Постановка реакций с известными биофабричными вирусными антигенами. РН, РСК, РИД, РИЭОФ, МФА, ИФА, РЗГА, РНГА, РЗГАд. 24. Особенности взятия, транспортировки и подготовки материала, для вирусологических исследований. При взятии вируссодержащего патологического материала большое значение имеет правильность выбора материала и его свежесть. Вирусы очень чувствительны к нагреванию и гниению. Поэтому материал нужно брать от свежих трупов (не позже 12 часов после гибели), а еще лучше от забитых клинически больных животных. При выборе материала учитывают тропизм вирусов и клиническое проявление болезни, вид и возраст животного, стадию течения болезни, наличие видимых изменений в органах и тканях и т. д. При жизни животного в качестве вируссодержащего материала может служить: афты и их содержимое (ящур), пустулы (оспа), истечения из носа и глаз (инфекционные заболевания и др.), слизь и смывы со слизистых, моча (чума свиней и др.), фекальные массы (при вирусных энтеритах), кровь и лимфа (при пантропных инфекциях), кусочки органов, взятые биопсией, и т. д. Посмертно кроме указанных материалов можно брать кусочки паренхиматозных и других органов (печень, селезенка, почки, мозг, лимфоузлы и др.). Трупы мелких животных направляют обычно целиком. Берут материал по возможности стерильно с помощью стерильного инструмента и в стерильную посуду. Если лаборатория рядом, материал отправляют неконсервированным и обычно в термосах со льдом. Если же материал нужно транспортировать далеко, то его обычно консервируют и тщательно упаковывают (особенно, если отправляют по почте или самолетом). Кусочки органов консервируют в 50% стерильном глицерине или насыщенном растворе хлористого натра и дополнительно помещают в термос со льдом. Жидкий материал консервируют замораживанием и сохраняют при -20° С (в термосе с сухим льдом). Пересылка материала сопровождается направлением, в котором сообщаются эпизоотологические и клинические данные, картина патологоанатомических изменений.
Присланный в лабораторию материал принимают и, по возможности, сразу же начинают исследовать, а, если это невозможно, то материал хранят до исследования в холодильнике при -20° С (в морозилке). Подготовка материала к вирусологическим исследованиям заключается в следующем. После осмотра органов и тканей, если материал был консервирован, их отмывают стерильным физраствором от консерванта. Если труп поступил целый, его осматривают и затем проводят вскрытие, измененные органы тщательно осматривают и извлекают в стерильные баночки или чашки Петри. При бешенстве часто поступает голова трупа, которую также сначала осматривают, а затем вскрывают и извлекают мозг. Жидкий материал проверяют на бактериальную загрязненность микроскопией мазков и посевом на среды (МГ1Б, МПА, среду Китт-Тароцци и среду Сабуро) и при необходимости обрабатывают антибиотиками (пенициллин и стрептомицин по 500-2000 ЕД на мл среды в зависимости от степени загрязненности). Из кусочков органов готовят суспензию. Для этого из присланных органов и тканей берут небольшие кусочки (1.0-1.5 г) и помещают в стерильную ступку, где после измельчения ножницами тщательно растирают до кашицеобразной массы со стерильным песком или стеклом.!1атем добавляют стерильный физраствор в соотношении 1:10 или 1:5 и получается суспензия. Ее переносят в центрифужные пробирки и туда же вносят вышеуказанные антибиотики в дозе 500-2000 ЕД на 1 мл суспензии. Суспензию в пробирках 2-3 раза замораживают (при -20°-50°С) и отстаивают при комнатной температуре или в термостате при 37° С. При этом происходит дополнительное разрушение клеток и освобождение вируса. Затем пробирки с суспензией центрифугируют 15-20 минут при 3000 оборотов в минуту. Надосадочную жидкость проверяют на стерильность посевом на среды в аэробные и анаэробные условия и затем используют как вируссодержащий материал для заражения лабораторных животных, куриных эмбрионов и культур тканей и для постановки серологических реакций в качестве антигена. Одновременно из исходного патологического материала готовят мазки или мазки-отпечатки, которые исследуют на наличие телец-включений и вируса в клетках после специальной окраски под обычным микроскопом или применяют люминесцентную микроскопию с использованием иммунофлуоресценции (флуоресцирующие антитела). При необходимости можно из органов готовить гистосрезы и исследовать их гистологически (например, при бешенстве).
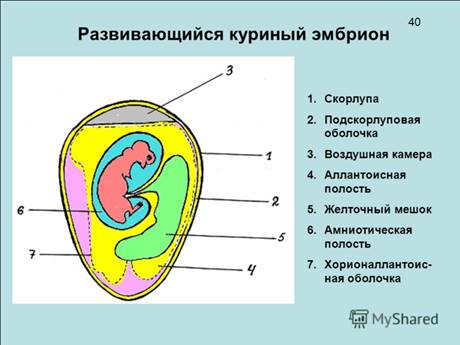
25. Применение куриных эмбрионов в вирусологии. Подбор и подготовка эмбрионов к заражению. Цель заражения: 1) выделение вируса из патматериала 2) поддержание вируса в условиях лаборатории 3) наработка вакцин 4) биологическая модель для получения реакции нейтрализации 5) биологическая модель для титрования вируса 6) наработка интерферона Требования, предъявляемые к инкубационному яйцу и куриным эмбрионам: 1 – яйцо должно быть из хозяйств благополучных по инфекционным болезням (СПФ – эмбрионы свободные от патогенной микрофлоры – если готовят вакцины, то яйца не из хозяйств) 2 – яйцо желательно получить от птиц белых пород (белая скорлупа – проще овоскопировать) 3 – яйцо должно быть снесено не более 6-10 суток 4 – яйцо должно быть оплодотворенным Это один из наиболее доступных и удобных методов выделения вирусов. В лабораторной практике стал применяться в 30-е годы XX века. Куриный эмбрион – это оплодотворенное куриное яйцо, в котором зародыш, находится на разных стадиях эмбрионального развития (на стадии бластулы или ранней гаструлы). Для заражения используется с 5-го по 12-й день инкубации (полный цикл развития эмбриона 21 день). Данный метод широко применяется для идентификации вирусов, получения антигенов для приготовления вакцин и диагностикумов, определения титра вируса и т.д. Имеет ряд преимуществ перед методом культивирования вирусов на лабораторных животных: скорлупа и подскорлупная оболочка надежно защищают эмбрион от бактериального заражения со стороны внешней среды; эмбрионы высокочувствительны к широкому спектру вирусов (это обусловлено наличием четырех различных питательных субстратов – желточного мешка, амниона, аллантоиса, хорионалланоисной оболочки); легкодоступны и экономичны, не требуют ухода и кормления. Желательно использовать в работе SPF - эмбрионы (SPF – specific pathogen free - куриные эмбрионы свободные от патогенной флоры). Получают такие эмбрионы от кур с SPF – статусом. Такое качество может быть обеспечено при надлежащих “особо чистых” условиях содержания птиц (специальные птичники, стерильные корма, стерильный воздух, стерильная вода и т.д.). Эмбрионы заражают в стерильных условиях. Предварительно отбирают жизнеспособные эмбрионы с хорошо выраженной подвижностью, для этого их просматривают в затемненной комнате на овоскопе. На скорлупе простым карандашом отмечают пугу (воздушную полость), ход крупных кровеносных сосудов и место предлежания эмбриона.
Перед заражением скорлупу обрабатывают спиртом и фламбируют. Заражают при помощи стерильных шприцов для туберкулинизации и специальных игл. Место заражения заливают парафином. Учитывая патогенность исследуемых вирусов, работы ведут с соблюдением техники безопасности. 26. Методы заражения эмбрионов (рисунок куриного эмбриона), сбор вируссодержащего материала. Заражение с 7 до 12 суточного возраста (куриный эмбрион развивается 21 сутки) Вируссодержащий материал вводят в объеме 0,1-0,2 мл. 1) Заражение в аллантоисную полость При заражении этим методом хорошо размножаются вирусы гриппа, ньюкаслской болезни, ринопневмонии лошадей, везикулярного стоматита и др. Существует несколько вариантов метода. Первый вариант. Эмбрион фиксируют вертикально тупым концом вверх. В скорлупе на стороне зародыша, а иногда с противоположной зародышу стороны на 5–6 мм выше границы воздушной камеры делают отверстие диаметром около 1 мм. Иглу вводят параллельно продольной оси на глубину 10–12 мм. После инъекции вируссодержащего материала иглу извлекают, а отверстие в скорлупе закрывают каплей расплавленного стерильного парафина. Второй вариант. Эмбрион фиксируют вертикально тупым концом вверх. Заражение проводят через центр воздушной камеры. Вируссодержащий материал вводят ниже отмеченной границы пуги на 0,5 см, проколов хорионаллантоисную оболочку. После инъекции исследуемого материала иглу извлекают, а отверстие в скорлупе закрывают каплей расплавленного стерильного парафина. 2) Заражение на хорионаллантоисную оболочку Этот метод заражения куриных эмбрионов используют для культивирования эпителиотропных, нейротропных, дерматропных и пантропных вирусов (оспы, инфекционного ларинготрахеита птиц, чумы плотоядных, болезни Ауески, катаральной лихорадки овец и др.). Заражение может быть выполнено через естественную или искусственную воздушную камеру. - удаляют скорлупу в районе пуги, приподнимают подскорлуповую оболочку, вводят вируссодержащий материал. Должна быть стерильность – сверху на яйцо надевают стеклянный колпачок, края запаивают (в районе пуги). - выпиливают треугольное отверстие на границе пуги и ХАО, поднимают подскорлуповую оболочку, вводят ВСМ, отверстие заклеивают стерильным пластырем - заражение через искусственную пугу – под контролем овоскопа. Для заражения эмбрион фиксируют горизонтально зародышем вверх. В скорлупе делают два отверстия: одно небольшое по центру воздушной камеры (через которое в дальнейшем отсасывают воздух), а другое диаметром 0,2–0,5 см сбоку, со стороны зародыша. С этой целью в скорлупе выпиливают треугольник с длиной сторон около 1 см с помощью надфиля (напильничек) или зазубренным скальпелем. Пинцетом удаляют участок скорлупы и подскорлупной оболочки. После этого резиновой грушей через первое отверстие отсасывают воздух из естественной воздушной камеры. В результате через боковое отверстие внутрь проникает воздух, образуя искусственную воздушную камеру, дном которой является ХАО. После нанесения на ХАО исследуемого материала отверстие закрывают кусочком лейкопластыря обработанного 70º спиртом. Дальнейшую инкубацию эмбрионов, зараженных этим методом, проводят в горизонтальномположении боковым отверстием вверх.
3) Заражение в желточный мешок Заражают эмбрионы 5–7-дневного возраста. Данный метод используют для размножения вирусов болезни Марека, катаральной лихорадки овец, ринопневмонии лошадей и др. Используют два варианта заражения. Первый вариант. Эмбрион фиксируют вертикально тупым концом вверх. В скорлупе по центру воздушной камеры делают отверстие и вводят иглу на глубину 3,5–4 см под углом 45° к вертикальной оси в направлении, противоположном месту нахождения зародыша. Второй вариант. Для заражения эмбрион фиксируют горизонтально зародышем вниз. В скорлупе по месту прилежания желтка делают отверстие, которое после введения исследуемого материала заливают каплей расплавленного парафина. 4) Заражение в амниотическую полость Заражают эмбрионы 6 - 11-дневного возраста. Метод используется при культивировании вирусов гриппа, ньюкаслской болезни, ринопневмонии лошадей и др. За 2-3 дня до заражения эмбрионы рекомендуется инкубировать пугой вверх. В этом случае эмбрион и амнион смещаются вверх, что удобно для заражения. Используют два варианта заражения. Открытый способ. В скорлупе над воздушной камерой вырезают окно диаметром 1,5–2,5 см. Анатомическим пинцетом удаляют подскорлупную оболочку, захватывают амнион, подтягивают его к окну и вводят вируссодержащий материал. Отверстие в скорлупе закрывают лейкопластырем или стеклянным колпачком (края парафинируют). Эмбрион инкубируют в вертикальном положении. Закрытый способ. Заражение проводят в затемненном боксе под контролем глаза. Эмбрион фиксируют горизонтально зародышем вверх. В скорлупе по центру воздушной камеры делают отверстие, через которое вводят иглу с затупленным концом по направлению к зародышу. Легким толчком прокалывают амнион и иглу слегка оттягивают назад. Доказательством того, что игла проникла в амнион, служит движение тела зародыша в направлении передвижения. Затем вводят материал. 5) Заражение в тело эмбриона и головной мозг и в крупные кровеносные сосуды хорионаллантоисной оболочки. Используют эмбрионы 7–12-дневного возраста. Известно два варианта метода.
Закрытый способ. Заражают так же, как в амнион, с той лишь разницей, что вируссодержащий материал вводят острой иглой. Открытый способ. Заражают так же, как в амнион открытым способом. В скорлупе над воздушной камерой вырезают окно диаметром 1,5–2,5 см. Пинцетом подтягивают тело зародыша. Материал вводят в различные участки тела или непосредственно в головной мозг. При таких методах заражения бывает значительный процент неспецифической гибели эмбрионов от травм (до 30 % и более). Заражение в крупные кровеносные сосуды хорионаллантоисной оболочки.Этот метод заражения применяется очень редко. При овоскопировании 11–13-дневных эмбрионов отмечают крупный кровеносный сосуд. По его ходу удаляют участок скорлупы. Материал вводят тонкой иглой в кровеносный сосуд по направлению тока крови. Удаленный участок скорлупы закрывают кусочком стерильного лейкопластыря.
В зависимости от метода заражения куриные эмбрионы инкубируют в вертикальном положении (заражение в аллантоис, амнион и желточный мешок) или в горизонтальном (заражение на хорионаллантоисную оболочку). После заражения куриные эмбрионы ежедневно просматривают на овоскопе. Погибшие эмбрионы помещают в холодильник с температурой 4°С до момента вскрытия. Гибель эмбриона в течение первых суток может быть обусловлена размножением грибов, бактериальной микрофлоры, внесенных в эмбрион вместе с инокулятом, по причине травмы или токсичности патматериала. Эта гибель считается неспецифической. Эмбрионы инкубируют в зависимости от вируса от 2 до 7-8 сут. до момента максимального его накопления. Затем все эмбрионы охлаждают при 4°С в течение 3–4 ч и вскрывают с соблюдением правил асептики в стерильных условиях бокса. Скорлупу обрабатывают спиртом и фламбируют, срезают пугу. А затем отсасывают аллантоисную или амниотическую жидкость, собирают желток, извлекают оболочки и сам эмбрион. Тщательно осматривают на наличие изменений. Амниотическая жидкость в норме совершенно прозрачная, при заражении она может быть мутная, кровянистая. Характерные изменения, вызванные вирусом, бывают наиболее выраженными на хорионаллантоисной оболочке.
|
|||||||||
|
Последнее изменение этой страницы: 2022-09-03; просмотров: 60; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.134.29 (0.022 с.) |