
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Общая характеристика свойств металлов
Металлы, расположенные в 1–3 группах главных подгрупп, легко отдают свои валентные электроны и принимают электронную конфигурацию ближайшего благородного газа:
Свойства s-металлов: – постоянные валентности или степени окисления (+1 и +2); – основной характер оксидов, за исключением бериллия. p-металлы: элементы IIIA (кроме бора B), IVA (германий Ge, олово Sn, свинец Pb) и VA (сурьма Sb и висмут Bi) групп. Свойства: – образование химических связей осуществляется s- и p-электронами в процессе их возбуждения и гибридизации орбиталей; – оксиды p-металлов проявляют амфотерный характер; – основные оксиды образуют только p-элементы IIIA группы пятого и шестого периодов – индий In и таллий Tl.
d -металлы: 30 элементов, расположенных в серединах периодов (IV, V, VI, VII) и достраивающих d-подуровень предпоследнего слоя при уже заполненном внешнем n s-подуровне. Свойства d -металлы: – в образовании химических связей у атомов d-металлов могут принимать участие как s-, так и d-электроны. Все d-элементы, кроме Zn и Cd, обладают переменной степенью окисления; – характер оксидов d-металлов зависит от степени окисления: оксиды низшей степени окисления имеют основной характер, средней - амфотерный, высшей – кислотный. f -металлы: лантаноиды и актиноиды. У этих элементов достраиваются энергетические подуровни 4f и 5f при заполненном внешнем уровне 6s2 и 7s2. Сложное строение электронных оболочек f-металлов сказывается на их свойствах: – f-металлы проявляют устойчивую степень окисления +3, при возбуждении возможны и более высокие степени окисления; – f-металлы обладают высоким сродством к кислороду и образуют устойчивые оксиды типа R2O3. Черные металлы характеризуются темно-серым цветом, большой плотностью (кроме щелочноземельных Ме), высокой температурой плавления, относительно высокой твердостью, часто имеют – полиморфизм. Черные подразделяются: • Железные металлы - Fe, Co, Ni (ферромагнетики) и Mn. • Тугоплавкие металлы - температура плавления выше Fe (1539оС) - добавки легированных сталей и основы для соответствующих сплавов. • Урановые металлы - актиниды - для сплавов атомной энергетики.
• Редкоземельные металлы (РЗМ) – лантан, церий, неодим, празеодим и др. - лантаноиды + иттрий и скандий. Близки по химическим, различаются по физическим свойствам. Присадки к сплавам других элементов. • Щелочноземельные металлы. В свободном состоянии применяются в особых случаях (теплоносители в атомных реакторах). Цветные металлы характеризуются: характерной окраской (красная, желтая, белая), большой пластичностью, низкой температурой плавления, отсутствием полиморфизма. Цветные подразделяются: • Легкие металлы - Be, Mg, Al - малая плотность. • Благородные металлы - Ag, Au, платиновая группа (Pt, Pd, Ir (иридий), Rh (родий), Os (осмий), Ru (рутений)), "полублагородная" медь. Высокая устойчивость против коррозии. • Легкоплавкие металлы - Zn, Cd, Hg, Sn, Pb, Bi, Tl (таллий), Sb (сурьма), элементы с ослабленными металлическими свойствами: Ga (галлий), Ge (германий). Нахождение металлов в природе • В самородном состоянии: Cu, Ag, Hg, Pt, Au • В виде соединений: оксидные (Fe3O4 – магнетит), карбонатные (CaCO3 – известняк), фосфатные, силикатные, алюмосиликатные (K2O×Al2O3×6SiO2 –полевой шпат или ортоклаз), сульфидные (HgS – киноварь) и галидные (NaCl – галит, каменная или поваренная соль). Металлическая связь
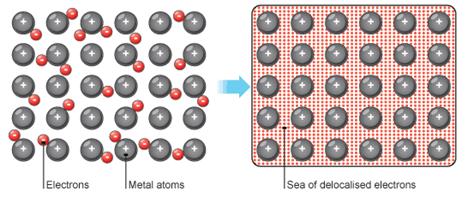
Частицы в металле удерживаются вместе с помощью сильных металлических связей. Чтобы отделить частицы требуется много энергии. Именно поэтому металлы имеют высокие значения температур плавления и кипения. Твердые металлы – это кристаллические частицы расположенные близко друг к другу в определенной последовательности.
Рисунок 1. Металлическая кристаллическая решетка Металлы имеют свободные электроны внешних оболочек, отрицательного заряда, которые располагаются вокруг плотноупакованных положительных ионов. Есть сильные электростатические силы, удерживающие частицы вместе.
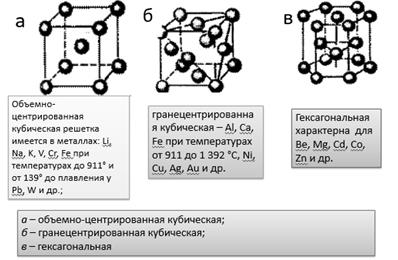
Рисунок 2. Виды металлических кристаллических решеток
Способы получения металлов
Пирометаллургия Восстановители: уголь, оксида углерода (II) или водород. — С или СО ZnО + С = Zn + СО — H2 WO3 + 3H2 =W + 3H2O — Сульфидные руды
2ZnS + 3О2 = 2ZnО + 2SО2 2) Металлотермия — алюминотермия 4Аl + 3МnО2 = 2А12О3 + 3Мn — магнийтермия TiCl4 + 2Mg = 2MgCl2 + Ti (Mn, Cr, Ti, Мо, W) 3) Гидрометаллургия Руда ® раствор CuO + Н2SО4 = CuSО4 + Н2О CuSО4 + Fe = FeSO4 + Cu 4) Электрометаллургия Электролиз расплава: NaCl расплав (эл. ток) ® Na + Cl2
Na++ ē ® Na 2Cl– – 2ē ® Cl2 Электролиз раствора 2CuSO4 + 2H2O (эл. ток) ® Cu + O2 + H2SO4
j о 0.34 > –0.41 2.05 > 1.23 Cu+2 + 2ē → Cu 2H2O – 4ē → 4H+ + O2↑ 2H+ + SO42– → H2SO4
|
|||||||||||||||||||||||
|
Последнее изменение этой страницы: 2022-01-22; просмотров: 44; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.103.202 (0.009 с.) |
 К(–): Na+ А(+): Cl–
К(–): Na+ А(+): Cl– К(–): Cu +2, H2O А(+): SO42–, H 2 O
К(–): Cu +2, H2O А(+): SO42–, H 2 O


