
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
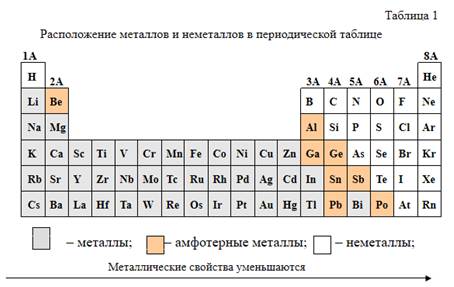
Положение металлов в периодической таблице и их свойства
В зависимости от электронного строения атомов все элементы можно подразделить на металлы и неметаллы. Большинство элементов расположенных в периодической системе Д. И. Менделеева характеризуются металлическими свойствами (табл. 1). Ряд элементов проявляет амфотерные свойства. Металлические свойства элементов определяются способностью атомов при взаимодействии частично или полностью смещать электронные облака к другим атомам или «отдавать» электроны, т е. проявлять при взаимодействии с атомами других элементов восстановительные свойства. К самым активным металлам относятся элементы с низкой энергией ионизации и низкой электроотрицательностью, с максимально большим радиусом атома и малым числом электронов на внешнем слое.
Металлы расположены в 1 и 2 группах, а также образуют побочные подгруппы 3–8 групп. Металлы в основном располагаются в левой части периодической системы. По мере заполнения наружной электронной оболочки число электронов на внешнем слое у атомов элементов растет, а радиус атомов уменьшается, поэтому они в большей степени стремятся присоединять электроны, а не отдавать их. В связи с этим в периоде металлические свойства у элементов уменьшаются, а неметаллические свойства – увеличиваются. Металлы, имея больший радиус, характеризуются более низкими значениями энергии ионизации, сродства к электрону и электроотрицательности по сравнению с атомами неметаллов. Поэтому у металлов преобладают восстановительные свойства, т. е. способность атомов отдавать электроны. Особенно ярко восстановительные свойства выражены у атомов металлов I и II групп главных подгрупп или у s-элементов. Самый сильный восстановитель – франций, а в водной среде – литий, за счет более высокого значения энергии гидратации. Число элементов, проявляющих металлические свойства, внутри периодов по мере увеличения номера периода возрастает. Так, во втором периоде два элемента проявляют металлические свойства, в третьем – три, в четвертом – тринадцать и т. д. В периодической таблице металлические элементы отделены от неметаллических элементов диагональной линией, проходящей от бора к астату. Вдоль этой границы располагаются элементы, проявляющие свойства металлов и неметаллов. К ним относятся бор, кремний, германий, мышьяк, сурьма, теллур и астат, которые называются полуметаллами или металлоиды. Таким образом, внутри каждого периода имеется «пограничная зона», в которой располагается элемент, проявляющий двойственные свойства. Следовательно, переход от типичного металла к типичному неметаллу в периоде происходит постепенно, т. е. плавно.
Для металлов, как простых веществ, характерны такие свойства, как высокая электрическая проводимость, теплопроводность, металлический блеск, ковкость, пластичность. Общность свойств металлов объясняется общностью в строении их кристаллических решеток. Однако по некоторым физическим свойствам (плотности, твердости, температурам плавления) металлы в значительной степени отличаются друг от друга. Наименьшую плотность имеют щелочные металлы, а наибольшую – осмий. Самый легкий из металлов – литий (плотность 0,53 г/см3), а самый тяжелый – осмий (плотность 22,6 г/см3). Металлы, плотность которых меньше 5 г/см3, условно принято называть легкими металлами, с плотностью больше 5 г/см3 – тяжелыми. Металлы отличаются друг от друга и по твердости. Самые мягкие металлы – щелочные металлы, они легко режутся ножом. Самый твердый металл – хром, он режет стекло. Металлы, температуры плавления которых выше 1000 оС, называют тугоплавкими, а ниже 100 оС – легкоплавкими. Самый легкоплавкий металл – ртуть (–38,9 оС), а самый тугоплавкий металл – вольфрам (+3390 оС). Начиная с третьего периода, у атомов появляются новые подуровни, поэтому увеличивается число свободных орбиталей и, следовательно, возрастает число связей между атомами и появляется возможность образования сложных молекул, таких как комплексные соединения. В комплексных соединениях связь чаще всего образуется по донорно-акцепторному механизму. В роли акцептора, как правило, выступает положительно заряженный ион металла. Практически все элементы могут исполнять роль комплексообразователя, но наибольшее число комплексных соединений известно для d-элементов 4-, 5- и 6-го периодов системы. Следовательно, элементы побочных подгрупп более склонны к компексообразованию, чем элементы главных подгрупп.
Кислородные соединения металлов проявляют основные свойства. Металлы при взаимодействии с кислородом (прямом или косвенном) образуют основные оксиды, гидроксиды которых проявляют основные свойства: Металл (Ме) → основной оксид (МехОу) → гидроксид или [Ме(ОН)х]
Оксид и гидроксид магния проявляют основные свойства, поэтому могут взаимодействовать с кислотными оксидами и с кислотами, например:
Основные свойства оксидов и гидроксидов в периоде уменьшаются: Na2O – MgO – Al2O3 NaOH – Mg(OH)2 – Al(OH)3
В группе основные свойства увеличиваются: BeO – MgO – CaO – BaO
|
||||||||||||||||||
|
Последнее изменение этой страницы: 2022-01-22; просмотров: 68; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.159.224 (0.01 с.) |
 Основные свойства в периоде уменьшаются
Основные свойства в периоде уменьшаются


