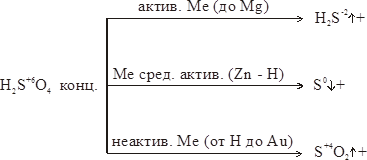Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Общая характеристика металловСтр 1 из 4Следующая ⇒
ОБЩАЯ ХАРАКТЕРИСТИКА МЕТАЛЛОВ Задание. 1. Внимательно прочитать лекцию 2. Ответить письменно на вопросы в тетради (подробно, используя материалы лекции 3. Отправить работу до 15 мая на электронную почту преподавателя 1.Где находятся металлы в таблице Менделеева, опишите как меняется строение. 2.Объяснить восстановительную способность металлов. 3.Охарактеризуйте физические свойства металлов. 4.Ответьте письменно: a) жидкий металл, b) самые пластичные металлы, c) самые электропроводные металлы, d) металлы с низкой электропроводностью, e) местоположение в ПСХЭ самых твердых металлов, f) местоположение в ПСХЭ самых мягких металлов, g) самый легкий металл, h) самый тяжелый металл, i) самый тугоплавкий металл, j) цветные металлы, драгоценные металлы. 5. Записать два правила ряда напряжений металлов (взаимодействие металлов с кислотами и взаимодействие металлов с солями). 6.Составьте химические реакции щелочных металлов: - с простыми веществами (S, N2, H2, P, C, Cl2 и др.), - с кислородом (образование оксидов и пероксидов), - с водой. 7.Что такое магниетермия и кальциетермия? Приведите примеры. 8. Составьте химические реакции щелочноземельных металлов с простыми веществами (О2, N2, H2, P, C, Cl2 и др.), взаимодействие с водой. 9.Доказать амфотерный характер оксида и гидроксида алюминия, оксида и гидроксида цинка): Составить реакции с кислотой и щелочью 10.Заполнить таблицу, дополнив названия химическими формулами веществ:
11. В чем проявляются металлические свойства. 12. Опишите кристаллическую решетку металла. Какие кристаллические решетки существуют у металлов. Приведите примеры кристаллических решеток, сделайте несколько рисунков кристаллических решеток 13. Как называются кислородные соединения металлов? Какие свойства они проявляют, покажите на примерах химических реакций (по материалам лекции). 14. Что такое «металлоиды»? 15. Заполните таблицу по материалам лекции:
Na2O – MgO – Al2O3 NaOH – Mg(OH)2 – Al(OH)3
В группе основные свойства увеличиваются: BeO – MgO – CaO – BaO Нахождение металлов в природе • В самородном состоянии: Cu, Ag, Hg, Pt, Au • В виде соединений: оксидные (Fe3O4 – магнетит), карбонатные (CaCO3 – известняк), фосфатные, силикатные, алюмосиликатные (K2O×Al2O3×6SiO2 –полевой шпат или ортоклаз), сульфидные (HgS – киноварь) и галидные (NaCl – галит, каменная или поваренная соль). Металлическая связь
Частицы в металле удерживаются вместе с помощью сильных металлических связей. Чтобы отделить частицы требуется много энергии. Именно поэтому металлы имеют высокие значения температур плавления и кипения. Твердые металлы – это кристаллические частицы расположенные близко друг к другу в определенной последовательности.
Рисунок 1. Металлическая кристаллическая решетка Металлы имеют свободные электроны внешних оболочек, отрицательного заряда, которые располагаются вокруг плотноупакованных положительных ионов. Есть сильные электростатические силы, удерживающие частицы вместе.
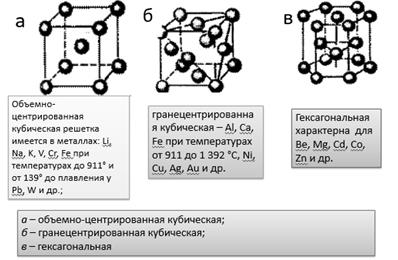
Рисунок 2. Виды металлических кристаллических решеток
Способы получения металлов
Пирометаллургия Восстановители: уголь, оксида углерода (II) или водород. — С или СО ZnО + С = Zn + СО — H2 WO3 + 3H2 =W + 3H2O — Сульфидные руды 2ZnS + 3О2 = 2ZnО + 2SО2 2) Металлотермия — алюминотермия 4Аl + 3МnО2 = 2А12О3 + 3Мn — магнийтермия TiCl4 + 2Mg = 2MgCl2 + Ti (Mn, Cr, Ti, Мо, W) 3) Гидрометаллургия Руда ® раствор CuO + Н2SО4 = CuSО4 + Н2О CuSО4 + Fe = FeSO4 + Cu 4) Электрометаллургия Электролиз расплава: NaCl расплав (эл. ток) ® Na + Cl2
Na++ ē ® Na 2Cl– – 2ē ® Cl2 Электролиз раствора 2CuSO4 + 2H2O (эл. ток) ® Cu + O2 + H2SO4
j о 0.34 > –0.41 2.05 > 1.23 Cu+2 + 2ē → Cu 2H2O – 4ē → 4H+ + O2↑ 2H+ + SO42– → H2SO4 С кислородом.
Все, кроме Pt, Pd, Au. 4Li + O2 = 2Li2O оксид лития 2Cu + O2 = 2CuO оксид меди С водородом. Взаимодействуют щел. и щел.-зем. металлы: Ca (Sr, Ba) + H2 = CaH2 (SrH2, BaH2) гидриды Гидриды щелочных металлов малоустойчивы, обладают восстановительными свойствами. С серой. 2Ag + S = Ag2S2- сульфид серебра С галогенами. Mg + Cl2 = MgCl21- хлорид магния С другими неметаллами. Из металлов I группы с азотом, углеродом, кремнием непосредственно взаимодействует только литий: 6Li + N2 = 2Li3N (250°C) нитрид лития 2Li + 2C = Li2C2 (600°C) карбид лития 4Li + Si = Li4Si (600-700°C, примесь Li2Si) Металлы II группы: Са + С = СаС2 карбиды 3Mg + N2 = Mg3N2 нитриды C кислотами. Все металлы, расположенные в ряду напряжений до водорода вытесняют его из разбавленных кислот, кроме азотной кислоты: 2HClразб.+ Zn = ZnCl2 + H2 H2SO4разб.+ Fe = FeSO4 + H2 С конц. H2SO4 и разб. и конц. HNO3 взаимодействуют все Ме, кроме Au и Pt. 8Al + 30HNO3 = 8Al(NO3)3+3NH4NO3+9H2O Со щелочами. Взаимодействуют амфотерные металлы (Zn, Al, Pb, Sn, Be, Cr(III)). Zn + 2NaOH + 2Н2О = Na2[Zn(OH)4] + H2 2Al+6NaOH+6Н2О = 2Na2[Al(OH)6]+3H2 С концентрированной серной кислотой реакции идут по схеме:
Рисунок 3. Схема взаимодействия металлов с концентрированной серной кислотой ОБЩАЯ ХАРАКТЕРИСТИКА МЕТАЛЛОВ Задание. 1. Внимательно прочитать лекцию 2. Ответить письменно на вопросы в тетради (подробно, используя материалы лекции 3. Отправить работу до 15 мая на электронную почту преподавателя 1.Где находятся металлы в таблице Менделеева, опишите как меняется строение. 2.Объяснить восстановительную способность металлов. 3.Охарактеризуйте физические свойства металлов. 4.Ответьте письменно: a) жидкий металл, b) самые пластичные металлы, c) самые электропроводные металлы, d) металлы с низкой электропроводностью, e) местоположение в ПСХЭ самых твердых металлов, f) местоположение в ПСХЭ самых мягких металлов, g) самый легкий металл, h) самый тяжелый металл, i) самый тугоплавкий металл, j) цветные металлы, драгоценные металлы. 5. Записать два правила ряда напряжений металлов (взаимодействие металлов с кислотами и взаимодействие металлов с солями). 6.Составьте химические реакции щелочных металлов: - с простыми веществами (S, N2, H2, P, C, Cl2 и др.), - с кислородом (образование оксидов и пероксидов), - с водой. 7.Что такое магниетермия и кальциетермия? Приведите примеры. 8. Составьте химические реакции щелочноземельных металлов с простыми веществами (О2, N2, H2, P, C, Cl2 и др.), взаимодействие с водой. 9.Доказать амфотерный характер оксида и гидроксида алюминия, оксида и гидроксида цинка): Составить реакции с кислотой и щелочью 10.Заполнить таблицу, дополнив названия химическими формулами веществ:
11. В чем проявляются металлические свойства. 12. Опишите кристаллическую решетку металла. Какие кристаллические решетки существуют у металлов. Приведите примеры кристаллических решеток, сделайте несколько рисунков кристаллических решеток
13. Как называются кислородные соединения металлов? Какие свойства они проявляют, покажите на примерах химических реакций (по материалам лекции). 14. Что такое «металлоиды»? 15. Заполните таблицу по материалам лекции:
|
|||||||||||||||||||
|
Последнее изменение этой страницы: 2022-01-22; просмотров: 49; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.198.129 (0.033 с.) |
 Основные свойства в периоде уменьшаются
Основные свойства в периоде уменьшаются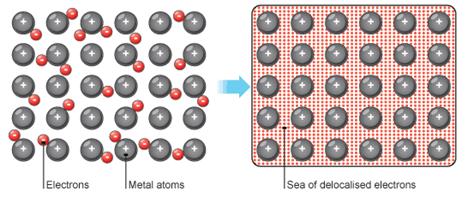
 К(–): Na+ А(+): Cl–
К(–): Na+ А(+): Cl– К(–): Cu +2, H2O А(+): SO42–, H 2 O
К(–): Cu +2, H2O А(+): SO42–, H 2 O