Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вторичные посредники или месенджеры
1. Арахидоновая кислота и ее ациклические производные (ациклические эйкозаноиды): a) Экозаполиеновые кислоты b) Лейкотриены c) Гепоксилины d) Липоксилины 2. Na, K+-помпа (антипортер):cAMP, Ca2+
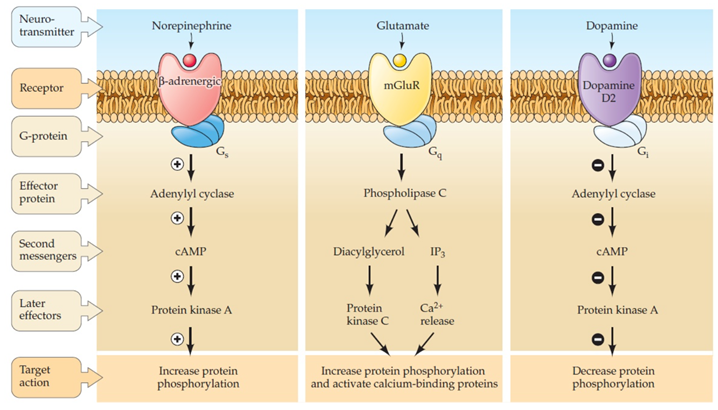
Он не будет рассказывать подробно про биосинтез, но надо помнить, что через метаботропный рецептор происходит активация Gs-белков, активируют аденлат циклазу, другие белки Ga-ингибируют, в общем ниже прикрепляю картинку:
Циклические нуклеотиды (цАМФ, цГМФ). Биосинтез
Нуклеотид цАМФ (3',5'-циклический аденозинмонофосфат, сАМР) синтезируется мембранными аденилатциклазами - семейством ферментов, катализирующих реакцию циклизации АТФ (АТР) с образованием цАМФ и неорганического пирофосфата. Расщепление цАМФ с образованием 5'З'АМФ (5'З'АМР) катализируется фосфодиэстеразами, которые ингибируются при высоких концентрациях метилированных производных ксантина, например, кофеином.
Активность аденилатциклазы контролируется G-белками, которые в свою очередь сопряжены с рецепторами третьего типа, управляемыми внешними сигналами. Большинство G-белков (Gs-белки) активируют аденилатциклазу, некоторые G-белки ее ингибируют (Gi-белки). Некоторые аденилатциклазы активируются комплексом Са2+/кальмодулин.
Аналогичная картинка будет и с цАМФ😊 То есть два фосфатика долой, и она становится циклической)
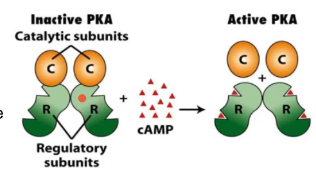
Разрывается эфирная связь и остается монофосфат 5 штрих 3 штрих АМФ, происходит активация протеинкиназ. Одна из первых хорошо исследованных протеникиназ – протеинкиназа А. Она состоит из 4 субъединиц, но на самом деле это два домена, каждый домен включает в себя регуляторную и каталитическую субъединицу. Для активации такой молекулы нужно 4 молекулы цАМФ. цАМФ, освобождает каталитическую субъединицу от супрессорного влияния, каталитические единицы освобождаются и могут фосфорилировать различные субстраты. Фосфорилирование меняет функциональную активность белков, которые естественно демонстрируют свои эффекты. Протеинкиназа А фосфорилируют сериновые и треоининовые остатки аминокислоты в белках. Примерно тоже самое делает цГМФ.
Механизм действия цАМФ является аллостерическим эффектором протеинкиназ А (ПКА) и ионных каналов. В неактивном состоянии ПКА является тетрамером, две каталитические субъединицы (С-субъединицы) которого ингибированы регуляторными субъединицами (R-субъединицы) (аутоингибирование).
При связывании цАМФ R-субъединицы диссоциируют из комплекса и С-единицы активируются. Фермент может фосфорилировать определенные остатки серина и треонина в более чем 100 различных белках (на самом деле больше), в том числе во многих ферментах и факторах транскрипции. В результате фосфорилирования изменяется функциональная активность этих белков. Наряду с цАМФ функции вторичного мессенджера может выполнять и цГМФ (cGMP). Оба соединения различаются по метаболизму и механизму действия.
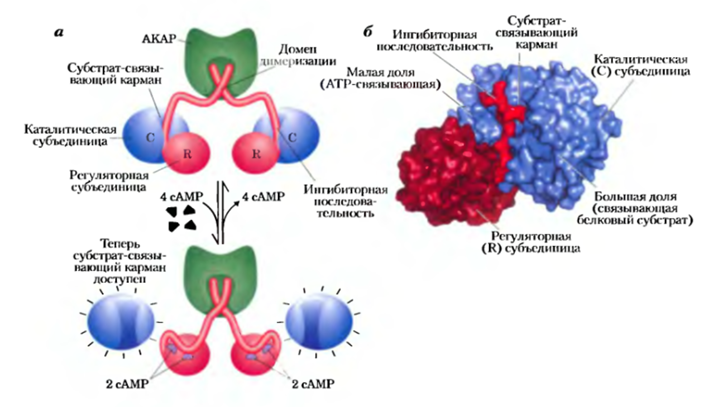
Рис. Активация сАМР-зависимой протеинкинаэы (РКА), а) При низкой концентрации сАМР две идентичные регуляторные субъединицы (R, изображены красным цветом) связаны с двумя идентичными каталитическими субъединицами (С; синие). В этом комплексе R2C2 ингибиторные последовательности R-субъединиц размещаются в субстрат- связывающем кармане С-субъединиц, что предотвращает связывание субстратов; таким образом, данный комплекс не проявляет каталитической активности. N-концевые последовательности R-субъединиц взаимодействуют между собой и образуют димер R2, с которым связывается описанный далее белок АКАР (англ. A kinase anchoring protein; зеленый). Когда в ответ на гормональный сигнал концентрация сАМР начинает расти, каждая R-субъединица связывает две молекулы сАМР и претерпевает значительную перегруппировку, в результате которой ингибиторные последовательности выталкиваются из субстратсвязы- вающих карманов С-субъединиц, а сами эти субъединицы оказываются в активной форме. б) Кристаллическая структура части комплекса R2C2 (PDB ID 1U7E) — одна С-субъединица (синяя) и часть R-субъединицы (два оттенка красного). Для простоты N-концевые последовательности R-субъединиц, образующие димер, не изображены. Малая доля С-субъединицы содержит участок связывания АТР, а большая доля образует и окружает карман, в котором происходит связывание и фосфорилирование (по остаткам Ser или Thr) белкового субстрата. В неактивной форме ингибиторная последовательность R-субъединицы (ярко-красная) блокирует участок связывания субстрата на С-субъединице.
Теперь про кальций😊 Он очень важный элемент в клетке, он, во-первых, деполяризует мембрану, но значение его в основном в том, что он выступает, как вторичный посредник и инициирует очень много каскадов в клетке. Самая важная функция – связь кальций и кальмодулин, который активирует Са\кальмодулин зависимые протеинкиназы, которые выполянют свою функцию. Уровень ионов Сa2+ внутри клетки • Концентрация ионов Са2+ в цитоплазме нестимулированной клетки крайне низка (10- 100 нМ). Низкий уровень поддерживается кальциевыми АТФ-азами (кальциевыми насосами), Са2+-связывающими белками и натрий-кальциевыми обменниками. Кальций выкачивается из клетки или вкачивается в внутриклеточные органеллы, в цитоплазме его не может быть, т.к. он увеличивает содержание активных форм кислорода, поскольку активирует много каскадов. Если его будет много в клетке, то клетка фактически погибнет. Кальций необходим при экзоцитозе, его концентрация возрастает в три порядка если не больше. • Резкое повышение концентрации ионов Са2+ в цитоплазме (до 500-1000 нМ) происходит в результате открытия Са2+-каналов плазматической мембраны или внутриклеточных Са2+-депо (г и шЭПР). Открытие каналов может быть вызвано деполяризацией мембран или действием сигнальных веществ, нейромедиаторов (глутамат и АТФ), вторичных мессенджеров (ИФЗ и цАМФ), а также веществом растительного происхождения - рианодином. • В цитоплазме и клеточных органеллах имеется множество белков способных связывать Са2+, некоторые из них выполняют роль буфера. Ниже картинки от меня
Но природы придумала механизмы сдерживания кальция, чтобы уберечь клетку. Уровень ионов Са2+ внутри клетки При высокой концентрации в цитоплазме ионы Са2+ оказывает на клетку цитотоксическое действие. Поэтому уровень Са2+ в отдельной клетке испытывает кратковременные всплески, увеличиваясь в 5-10 раз, а стимуляция клетки увеличивает лишь частоту этих флуктуаций. Действие кальция опосредовано специальными Са2+-связывающими белками («кальциевыми сенсорами»), к которым принадлежат аннексин, кальмодулин и тропонин. Кальмодулин - сравнительно небольшой белок (17 кДа) - присутствует во всех животных клетках. При связывании четырех ионов Са2+ кальмодулин переходит в активную форму, способную взаимодействовать с многочисленными белками. За счет активации кальмодулина ионы Са2+ оказывают влияние на активность ферментов, ионных насосов и компонентов цитоскелета.
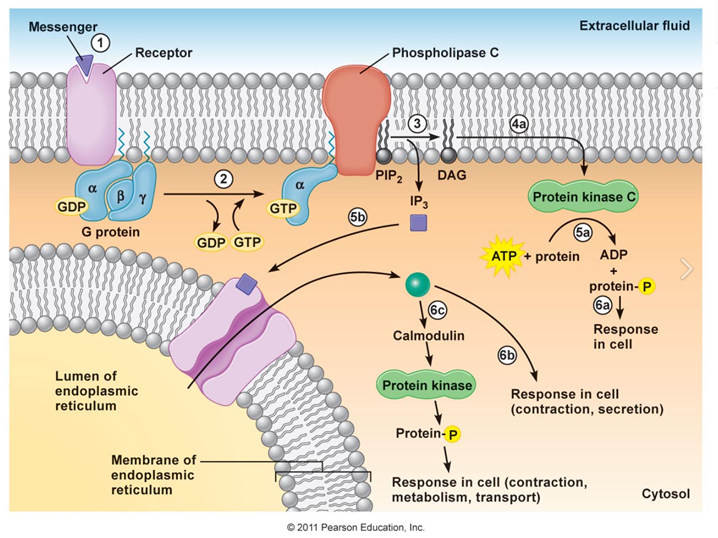
Теперь про вторичные посредники, производные фосфолипидов.
|
||||||
|
Последнее изменение этой страницы: 2022-01-22; просмотров: 37; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.173.112 (0.008 с.) |