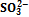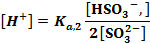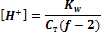Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Составим таблицу значений рН и построим кривую титрования
Титрование слабой кислоты сильным основанием. В начале титрования в растворе находится только слабая кислота (другими источниками ионов водорода можно пренебречь). В растворе кислоты при степени ее диссоциации менее 5% [ Н+] = До ТЭ при титровании получается сопряженное основание, и раствор представляет собой буферную смесь, поэтому рН вычисляют по формуле (9.20). В ТЭ вся кислота оттитрована, и рН раствора определяется наличием сопряженного основания (другими источниками ОН~-ионов можно пренебречь). В растворе слабого основания [ ОН-] = Поскольку при титрования количество получившегося основания равно исходному количеству кислоты, пренебрегая изменением объема, можно считать, что св = с0. После ТЭ основным источником ОН~-ионов будет добавленное сильное основание. Пример 3. Пусть 10,0 мл 0,10 М СН3СООН титруют 0,10 М NaOH. Составим таблицу значений рН, сделав те же допущения, что и в примере 2
Вблизи ТЭ (f = 0,999) вычисление рН по формуле (9.20) не дает правильного результата, поскольку концентрация сопряженной кислоты здесь очень мала и допущения, сделанные при вьюоде формулы для расчета рН буферной смеси, неправомерны. То же относится к расчетам вблизи начала кривой. Резкое изменение в начале кривой объясняется малой буферной емкостью смеси при малой концентрации сопряженного основания. Индекс крутизны меньше, чем в предыдущем случае:
Титрование слабого основания сильной кислотой. До ТЭ рН рассчитывают по формуле буферной смеси,
где Ка — константа кислотности кислоты, сопряженной с титруемым основанием
В ТЭ источником ионов Н+ является сопряженная кислота [ Н+] = За ТЭ значение рН определяется только добавленной сильной кислотой lg[T] = lgcT + lg(f-l). Так же, как и кривая титрования слабой кислоты, эта кривая несимметрична, а ТЭ не совпадает с точкой нейтральности Титрование многоосновных кислот и оснований, а также смесей кислот или оснований. В растворах многоосновных кислот (оснований), так же как и в смеси кислот (оснований), диссоциация более слабых электролитов подавлена более сильными. Поэтому при добавлении сильного основания к смеси кислот оттитровывается прежде всего сильная и только, когда оставшегося количества ее не хватает для подавления дассоциации более слабой, начинается ее титрование. При этом если последовательные константы кислотности различаются более, чем в 104 раз, то на кривых титрования наблюдаются отчетливые скачки титрования. В противном случае скачки сливаются.
Рис. Кривая титрования 0,1 М H2S03 (рис. 0,1 М раствором NaOH с индикаторами 9.13). фенолфталеином (ФФ) и метиловым оран жевым - Степени оттитрован- (МО) Пусть 10 мл 0,10 М (^ H 2 S 03) (Kal =1,3-10"2 9 Ka 2 = 6,8«10-8) титруют 0,10 М NaOH. Построим таблицу значений рН, сделав те же допущения,
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 82; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.10.137 (0.005 с.) |

 и рН = ½ (рКа + р C 0).
и рН = ½ (рКа + р C 0). ; [Н+] = KW /
; [Н+] = KW / 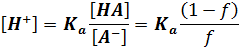
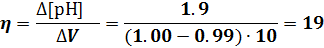



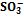
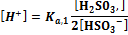
 ]
]

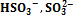
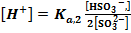 ]
]