
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Протекать количественно, поэтому константа равновесия должна быть высокой;
4. должен существовать способ фиксирования точки эквивалентности. Экспериментально конец титрования устанавливают по изменению цвета индикатора или какого-либо физико-химического свойства раствора. Эта точка, называемая конечной точкой титрования (КТТ), в общем случае не совпадает с теоретически рассчитанной точкой эквивалентности. В титриметрии используют реакции всех типов — с переносом протона, электрона, электронной пары, а также процессы осаждения
По способу выполнения различают прямое, обратное титрование и титрование заместителя. При прямом титровании титрант непосредственно добавляют к титруемому веществу. Такой способ применим только при выполнении всех требований, перечисленных выше. Если скорость реакции мала, или не удается подобрать индикатор, или наблюдаются побочные эффекты, например потери определяемого вещества вследствие летучести, можно использовать прием обратного титрования: добавить к определяемому веществу заведомый избыток титранта Тх, довести реакцию до конца, а затем найти количество непрореагировавшего титранта титрованием его другим реагентом Т2 с концентрацией с2. Очевидно, что на определяемое вещество затрачивается количество титранта Тх, равное разности cTXVTX - cT 2 VT 2. Пример 1. Прямое титрование диоксида марганца сульфатом железа невозможно из-за малой скорости реакции М n 02 + 2 Fe 2+ + 4Н+ = М n 2+ + 2 Fe 3+ + 2Н20 Поэтому навеску Мп02 обрабатывают раствором FeS04, взятым в заведомом избытке, и нагревают до полного завершения реакции. Непрореагировавший Fe2+ оттитровывают стандартным раствором К2Сг207. Стехиометрическая реакция
5 N 02- + 2 MnO 4 -; +6 Н+ =2М n 2+ + 5 NO 3 2- + ЗН20 осложняется разложением азотистой кислоты, образующейся в кислой среде: 2 HN 02 = NO ↑ + N 02↑+ H 2 0 Из-за летучести оксидов азота теряется определяемое вещество. Поэтому к нитриту добавляют избыток раствора КМп04, подкисляют и после окончания реакции оттитровывают оставшийся перманганатион. Если реакция нестехиометрична или протекает медленно, можно использовать титрование заместителя. Для этого проводят стехиометрическую реакцию определяемого вещества с вспомогательным реагентом, а получающийся в эквивалентном количестве продукт оттитровывают подходящим тит-рантом. Например, взаимодействие дихромат- и тиосульфат-ионов протекает несте-хиометрично. Поэтому к раствору, содержащему ион Сг2072-, добавляют раствор иодида калия, реагирующего с ним стехиометрично: С r 2 072- + 6 I - + 14Н+ = 2Сг3+ + 3 I 2 +7Н20 Выделившийся в эквивалентном дихромату количестве иод оттитровывают раствором тиосульфата натрия по реакции I 2 +2 S 2 03 2- =2 I - + S 4 Концентрацию раствора Na2S203 можно рассчитать по формуле
Иногда возможно проведение нескольких последовательных реакций замещения. Например, для определения свинца проводят сериюстехиометрических реакций: РЬ2++ 2 РЬС r 04 + 2Н+ = 2 Pb 2+ +
I 2 +2 S 2 03 2- =2 I - + S 4 Как видно, количество тиосульфат-иона эквивалентно количеству ионов свинца. Обычно при титриметрическом определении проводят несколько параллельных титрований. При этом возможны два варианта: метод пипе-тирования и метод отдельных навесок. Метод пипетирования заключается в титровании равных порций раствора (аликвот Vx), отбираемых пипеткой из мерной колбы определенного объема V 0, в которой растворена навеска анализируемого вещества. Массу определяемого вещества тА вычисляют по.уравнению (9.4, подставляя в него среднее арифметическое из результатов параллельных титрований VT. При этом учитывают молекулярную массу эквивалента определяемого вещества МА и вводят коэффициент 10-3, поскольку все объемы выражают в миллилитрах, а концентрация титранта ст выражена в молях эквивалентов в литре:
Для прямого титрования
Для обратного титрования тА(в аликвоте) = (ст1 V т1 1 - ст2 V Т2 )МА •10-3. Для нахождения процентного содержания следует учесть массу навески т: wA,% = Метод отдельных навесок заключается в том, что п навесок вещества (m1,m2,и т. д.), взятых на аналитических весах, растворяют в небольших объемах растворителя (знать их нет необходимости) и проводят титрование в каждом растворе. В этом случае количество вещества в каждой навеске равно Метод пипетирования более экспрессен и менее трудоемок, но и менее точен, чем метод отдельных навесок. Стандартные растворы Для титриметрического определения необходимо знать концентрацию титранта. Титрант с известной концентрацией называют стандартным раствором. По способу приготовления различают первичные и вторичные стандартные растворы. Первичный стандартный раствор готовят растворением точного количества чистого химического вещества известного стехиометрического состава в определенном объеме растворителя. Вторичный стандартный раствор получают следующим образом: готовят раствор с приблизительной концентрацией, близкой к желаемой, и определяют его концентрацию (стандартизируют) по подходящему первичному стандартному раствору. Первичные стандартные вещества должны отвечать ряду требований. 1.Состав соединения должен строго соответствовать химической формуле. Оно либо выпускается промышленностью в высокочистом состоянии, либо легко подвергается очистке простыми методами, например перекристаллизацией. Содержание примесей не должно превышать 0,05%, что примерно соответствует относительному стандартному отклонению при измерении массы навески. 2. Вещество должно быть устойчивым при комнатной температуре; вещества гигроскопичные или легко окисляющиеся атмосферным кислородом или поглощающие диоксид углерода непригодны. Вещество не должно претерпевать изменения при высушивании. Поэтому первичное стандартное вещество должно быть по возможности безводным и нелетучим. Можно использовать и кристаллогидрат, если его довести до определенной степени гидратации путем длительного выдерживания в атмосфере с постоянной относительной влажностью и затем сохранить эту степень гидратации во время взвешивания. 3.Вещество должно обладать по возможности большой молекулярной массой, чтобы уменьшить влияние неизбежной погрешности взвешивания. Для приготовления многих стандартных растворов можно воспользоваться фиксаналами. Фиксанал представляет собой ампулу, в которой запаяно точно известное количество стандартного вещества или раствора. Для приготовления раствора известной концентрации нужно разбить ампулу над специальной воронкой с пробивным устройством, перенести содержимое ампулы в мерную колбу подходящего объема и разбавить водой до метки. Однако, чтобы застраховаться от случайных погрешностей, следует стандартизировать даже приготовленный таким образом раствор и периодически повторять стандартизацию (за исключением тех случаев, когда известно, что раствор совершенно устойчив). Принцип эквивалентности Одним из основных понятий в химии вообще и в аналитической химии в частности является понятие об эквивалентности реагирующих веществ в химической реакции. Вещества реагируют между собой в эквивалентных количествах. На этом принципе основан расчет результатов титриметрического анализа.
Если определяемое вещество А реагирует с раствором титраята В по уравнению νAA + νBB —> Продукты реакции то эквивалентными массами этих веществ будут ν AM(A) и М (В), где М(А) и М(В) — молярные массы веществ А и В, a ν A и νB стехиометрические коэффициенты или стехиометрические числа компонентов реакции. А + (νB / νA) B —> Продукты реакции где νA > νB означает, что одна частица вещества А будет эквивалентна (νB / νA) частицы вещества В. Отношение (νB / νA) обозначают символом fЭКВ(В) и называют фактором эквивалентности вещества В: f (В) = Фактор эквивалентности является безразмерной величиной, равной или меньше единицы. Величину fЭКВ(В) В называют эквивалентом или эквивалентной формой В. Однако для расчета фактора эквивалентности и эквивалента необходима фиксированная основа, так как одного стехиометрического уравнения реакции для проведения расчета не всегда бывает достаточно. Такой основой в реакциях кислотно-основного взаимодействия является ион водорода, а в окислительно-восстановительных— электрон. Фактор эквивалентности — это число, обозначающее, какая доля реальной частицы вещества X эквивалентна одному иону водорода в данной кислотно-основной реакции или одному электрону в данной реакции окисления—восстановления. Эквивалентом называют реальную или условную частицу вещества X, которая в данной кислотно-основной реакции эквивалентна одному иону водорода или в данной реакции окисления—восстановления — одному электрону. Например, в реакции NaOH + 1/2 H 2 S 04 = 1/2 Na 2 S 04 + H 2 0 f Э KB (NaOH) = l; Эвивалент серной кислоты в этой реакции будет f ЭKB(H2S04) = 1/2. Для реакции Н3Р04 + КОН = КН2Р04 + Н20 (а) f экв(Н3Р04) - 1; fэкв(Н3Р04) Н3Р04 = Н3Р04, а для реакции Н3Р04 + 2 KOH = К2НР04 + 2Н20 (б) fэкв(Н3Р04) = 1/2; fэкв(Н3Р04)Н3Р04 = 1/2 Н3Р04. В реакции (а) эквивалентом фосфорной кислоты является Н3Р04, а в реакции (б) — условная частица 1/2 Н3Р04. В полуреакции: М n 04- + 8 H + + 5е~ = М n 2+ + 5Н20 fэкв(КМn04) - 1,5; fэкв (КМn04)КМn04 = 1/5 КМn04, т. е. эквивалентом является условная частица 1/5 КМn04. Но в полуреакции М n 04- + 4 Н+ + Зе~ - М n 02 + 2Н20 fэкв (КМn04) - 1/3; fэкв (КМn04) КМп04 - 1/3 КМn04. Фактор эквивалентности и эквивалент данного вещества являются не постоянными величинами, а зависят от стехиометрии реакции, в которой они принимают участие.
Важное значение в титриметрическом анализе имеет понятие о молярной массе эквивалента. Молярной массой эквивалента вещества X называют массу одного моля эквивалента этого вещества, равную произведению фактора зквивалентности на молярную массу вещества X: М(f ЭКВ Х • М(Х)) = f ЭКВ (Х)•М(Х). Отношение количества вещества эквивалента в растворе к объему раствора называют молярной концентрацией эквивалента:
Например, с(1/2 H2S04) = 0,1 моль экв/л. Раствор, содержащий 1 моль эквивалентов вещества X в 1 л, называют одномолярным раствором эквивалента этого вещества. Наряду с обозначением размерности концентрации моль экв/л допускается сокращение «н.». Например, 1 н. H2S04, т. е. 1 моль/л 1/2 молекулы H2S04. При указании молярной концентрации эквивалента следует приводить конкретную реакцию, в которой данный раствор применяется, или фактор эквивалентности.
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 73; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.139.107.241 (0.022 с.) |



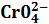 =РЬ
=РЬ 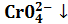
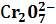 + Н20
+ Н20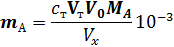
 .
.
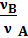 -.
-.



