Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Многозарядные ионы адсорбируются сильнее, чем однозарядные.
4. Преимущественно адсорбируются ионы примерно такого же размера, что и ионы решетки. Количественно адсорбция описывается уравнениями, вид которых зависит от типа адсорбции. Адсорбция собственных (потенциалопределяющих) ионов подчиняется уравнению:
где а — количество адсорбированного иона; т — масса осадка; к — константа; с0 — концентрация ионов в изоэлектрической точке, т. е. при а = 0; ct — концентрация ионов в растворе (все массы и количества должны быть выражены в одних единицах, например граммах или молях). Адсорбция посторонних примесей может протекать по разным механизмам. Помимо обсужденной выше адсорбции потенциалопределяющих ионов, возможна адсорбция путем ионного обмена { обменная адсорбция) и адсорбции молекул и ионных пар {молекулярная адсорбция). При ионном обмене первоначально притянутые противоионы могут замещаться на другие в соответствии с правилами, изложенными выше. Например, в процессе осаждения осадка иодида серебра избытком иодида натрия поверхность осадка загрязнена ионами натрия. При промывании солью аммония они могут заместиться на ионы аммония:
В этом случае
Очевидно, что чем больше концентрация ионов аммония в промывной жидкости, тем меньше величина а (количество Na+ в осадке). А ионы NH4 улетучиваются при высушивании осадка. Адсорбция подчиняется эмпирическому уравнению Лэнгмюра Помимо концентрации и температуры на величину адсорбции влияет площадь поверхности осадка: чем больше поверхность, тем больше адсорбция. Окклюзия — это захват посторонних ионов в процессе образования осадка. Захват может осуществляться, во-первых, вследствие адсорбции ионов на поверхности растущих кристаллов по правилам, описанным выше, в процессе роста кристаллов примеси оказываются внутри осадка {внутренняя адсорбция), во-вторых, в результате захвата маточного раствора, попадающего в трещины и полости в осадке {инклюзия). Окклюзия — основной вид загрязнения осадков. Очевидно, что вид и количество примесей в осадке будут зависеть от скорости его формирования и порядка сливания растворов. Например, сульфат бария можно получить, прибавляя серную кислоту к раствору соли бария, и наоборот. В первом случае образующиеся кристаллы сульфата бария будут адсорбировать в процессе роста ионы Ва 2+ и в качестве противоионов СК, т. е. осадок будет преимущественно окклюдировать хлорид бария (возможна небольшая окклюзия и серной кислоты). Во втором случае кристаллы сульфата бария будут преимущественно адсорбировать ионы S О
Образование твердых растворов (изоморфизм). Раствор одного твердого вещества в другом называется твердым. При образовании твердого раствора один из ионов замещается в кристаллической решетке другим ионом при условии, что заряд их одинаков, размеры близки (разница до 10-45%), а строение кристаллической решетки (сингония) обоих соединений одинаково. Например, изоморфно соосаждаются тет-рароданомеркуриаты Zn2+ (г,=0,83 А), Со2+ (г,=0,78), Си2+ (г,=0,80), Fe2+ (r,=0,80) и Ni2+ (г,=0,74). Поэтому при осаждении ZnHg(SCN)„ (белого цвета) в присутствии даже очень малых количеств этих ионов получаются смешанные кристаллы. Небольшая разница в размерах ионов приводит к деформации решетки и, как следствие, к изменению окраски осадка (осадок голубой в присутствии Со2+, фиолетовый в присутствии Си2+, серо-зеленый в присутствии Ni2+), что используется для обнаружения ионов. Способы уменьшения соосаждения Для уменьшения адсорбции необходимо увеличение среднего размера частиц (приемами, описанными в предыдущем разделе), повышение температуры и промывание осадка промывными жидкостями. При этом можно использовать обменную адсорбцию, заменив адсорбированную нелетучую примесь на летучую. Например, при промывании осадка AgCl, загрязненного ионами Na+, азотной кислотой поверхность оказывается загрязненной летучей НС1. При выборе промывной жидкости следует принимать во внимание характер примесей и свойства осадка. Так, малорастворимый кристаллический BaS04 обычно промывают водой. Сравнительно растворимые осадки промывают разбавленными растворами, содержащими ионы осадителя. Например, осадок СаС204 • Н20 промывают раствором оксалата аммония. Аморфные осадки, склонные к пептизации, следует промывать раствором летучего электролита. Например, гидраты оксидов железа (III) и алюминия промывают раствором NH4N03, к которому добавляют немного NH3 (для поддержания нужного значения рН).
Для борьбы с окклюдированными примесями наиболее эффективным приемом является переосаждение. Осадок растворяют в подходящем растворителе (растворе кислоты и т. п.) и снова осаждают. Так как одной из причин окклюзии является адсорбция посторонних веществ в процессе роста, то ясно, что количество примесей в повторно осажденном осадке будет меньше. Осадок очищается также при старении; особенно эффективна самоочистка мелкодисперсных осадков. От изоморфно-соосажденных примесей освободится переосаждением или промыванием не удается. Для снижения количества соосажденной примеси требуется несколько переосаждений, поэтому здесь нужны превентивные меры — изменение заряда или размера соосаждающегося иона, например комплексообразованием. При осаждении органическими осадителями осадки получаются, как правило, более чистыми, чем при использовании неорганических осадителей. Условия получения осадка Для соединений с полярной связью, обладающих сравнительно большой растворимостью (BaS04, СаС204 • Н20, MgNH4P04 • 6H20), ионы которых сравнительно мало гадратированы, можно надеяться на получение кристаллического осадка. Условия получения кристаллических осадков. 1. Нужно уменьшить относительное пересыщение. 2. Избегать затравок, вызывающих индуцированную нуклеацию. 3. Замедлять осаждение. 4. Оставлять осадок под маточным раствором для старения. Для снижения относительного пересыщения осаждение необходимо вести при высокой температуре, уменьшать концентрацию ионов и увеличивать растворимость в процессе осаждения. Чтобы не превысить сверхрастворимость, нужно добавлять осадитель маленькими порциями при интенсивном перемешивании во избежание местного пересыщения. Растворимость является функцией температуры, ионной силы, а для соединений, в состав которых входит ион-основание, — функцией рН раствора. Таким образом, условия осаждения кристаллических осадков можно сформулировать следующим образом: медленное добавление при интенсивном перемешивании к горячему разбавленному (при необходимости подкисленному) раствору осаждаемого вещества разбавленного раствора осадителя. Например, осадок MgNH4P04 x х6Н20 осаждают на холоду из-за его сравнительно высокой растворимости (Ks ~ 10-12). Для осаждения BaS04 раствор подкисляют соляной кислотой. При этом сульфатионы частично связываются в гидросульфат-ионы, что увеличивает растворимость почти вдвое. Особенно медленное поступление ионов обеспечивается приемом, называемым осаждением из гомогенного раствора, или методом возникающих реагентов. Гомогенное осаждение осуществляют несколькими путями: регулированием рН, генерированием аниона или катиона осадителя, синтезом реагентов, испарением растворителя.
В качестве типичного примера первого способа приведем осаждение оксалата кальция мочевиной при гравиметрическом определении кальция. Мочевина настолько слабое основание, что добавление ее мало влияет на рН, но при нагревании до 85—100 °С она гидролизуется: (NH 2)2 C =0 + 2 H 2 0 = 2 NH 4 + + C 032- Получающийся карбонат-ион может реагировать с ионом гидроксония, гидрооксалат-ионом и другими кислотами. Наиболее часто используемые неорганические осадители приведены в таблице Неорганические осадители
Для осаждения применяют неорганические и органические реагенты. Последние, как правило, более селективны. Осадки соединений с органическими лигандами легко фильтруются и очищаются при промывании. Гравиметрические факторы обычно малы, поскольку органические молекулы имеют большую молекулярную массу. Эти осадки негигроскопичны. Определение органических соединений. Гравиметрия имеет ограниченное применение в аналитической химии органических веществ. Однако описан ряд избирательных реакций на некоторые функциональные группы Иногда используют различные предварительные операции. Например, салициловую кислоту определяют по реакции с иодом.
. Органические осадители
Методы отгонки
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 122; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.107.90 (0.013 с.) |
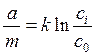

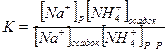

 и в качестве противоионов Н30+. В этом случае осадок окклюдирует преимущественно сер
и в качестве противоионов Н30+. В этом случае осадок окклюдирует преимущественно сер 

 ную кислоту (хотя возможна небольшая окклюзия и хлорида бария). Отсюда общее правило окклюзии: в осадке будут преобладать окклюдированные посторонние анионы, когда в растворе во время осаждения в избытке содержится осаждаемый катион, и в осадке будут преобладать окклюдированные посторонние катионы, когда в растворе при осаждении в избытке находится осаждаемый анион.
ную кислоту (хотя возможна небольшая окклюзия и хлорида бария). Отсюда общее правило окклюзии: в осадке будут преобладать окклюдированные посторонние анионы, когда в растворе во время осаждения в избытке содержится осаждаемый катион, и в осадке будут преобладать окклюдированные посторонние катионы, когда в растворе при осаждении в избытке находится осаждаемый анион.