
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
С помощью спиртометра, ориометраСтр 1 из 20Следующая ⇒
2. Метод дихроматометрии с йодометрическим окончанием, вариант обратного титрования. Метод основан на окислении спирта дихроматом калия в кислой среде до уксусной кислоты. O // 3C2H5OH+2K2Cr2O7 +14HNO3→3CH3–C–OH + 4Cr(NO3)3+ 4KNO3 + 11H2O 1 моль 4 экв. K2Cr2O7 + 6 KI + 14 HNO3 → 3 I2 + 2 Cr(NO3)3 + 8 KNO3 + 7 H2O
I 2 + 2 N а2 S 2 О3 → 2 N а I + N а2 S 4 О6 Индикатор - крахмал I2 + 2 е → 2 I- 2 S2О3 2- - 2 е → 2 S4О62- f экв .= 1/4 M 1/ z = М/4 Применение 1. 70%-ый спирт – обработка инъекционного поля, хирургических инструментов. 2. 40%-ый спирт – для компрессов 3. 95%-ый спирт – при ожогах 4. Для получения настоек, экстрактов, для приготовления ЛФ.
Хранение N. B.! Хранение спирта в аптеке регламентирует приказ № 706 н Отпуск спирта из аптеки регламентирует приказ № 1175 (50, 100 г) Анализ спирта в аптеке регламентирует приказ №214 (полный химический контроль проводят при разведении спирта в условиях аптеки, концентрированного спирта, водно - спиртовых гомеопатических растворах, каплях)
Лекарственные средства, производные альдегидов Раствор формальдегида Формалин Solutio Formaldehydi Formalinum O // муравьиный альдегид H – C – H метаналь Свойства Прозрачная, бесцветная жидкость со своеобразным острым запахом, смешивается с водой и спиртом во всех отношениях.
За свет альдегидной группы препарат легко окисляется. При низких температурах полимеризуется до белого осадка.
Подлинность 1. Реакции окисления (за счет альдегидной группы) а) р-ция «серебряного зеркала» (с реактивом Толленса при нагревании) → осадок серебра О О // t0 // Н – C – Н + 2[ Ag (NH 3)2] OH → Н – C – ONH 4 + 2 Ag ↓ + H 2 O + 3 NH 3 ↑
б) с реактивом Фелинга при нагревании → образуется кирпично-красный осадок оксида меди II
СОО Na СОО Na в) с реактивом Несслера при нагревании → темно-серый осадок ртути
О О // // Н – С – Н + К2[ HgI 4 ] + 3КОН → Н – С – ОК + Hg ↓ 4К I + 2 Н2О
2. р-ция конденсации с фенолок-той → ауриновый краситель красного цвета
HOOC – – H || H – – COOH к. H2SO4 + H – C – H + → HO OH
→ → HO OH
HOOC – – CH= – COOH → HO O 3. р-ция конденсации с ароматическими аминами →желтый цвет
+ Н – C = O → + H2O | H R R
Количественное определение Метод йодометрии, способ обратного титрования ( ГФ). Метод основан на восстановительных свойствах препарата за счет альдегидной группы. Методика: к Тн препарата добавляем воду + избыток 0,1 н раствора I2 + 0,1 н раствор NaOH, перемешивают и оставляют в темном месте на 10 минут. Добавляют раствор H2 SО4 и выделившийся I2 титруют раствором Nа2S2О3 + индикатор крахмал до обесцвечивания раствора. О О // // Н – С – Н + I 2 + 3 Na ОН → Н – С – О Na + 2 NaI + Н2О 1 моль 2 экв. I2 + 2 N а 2 S2 О 3 → 2 N а I + N а 2 S4 О 6 I2 + 2 е → 2 I- 2 S2О3 2- - 2 е → 2 S4О62- f экв. = 1/2 M 1/ z = М/2 Применение
Только наружно, как антисептическое средство в концентрации 0,5 % и 1% для дезинфекции инструментов, рук. Обладает дезодорирующим действием при потливости ног. Входит в состав мазей формалиновой и мезоформалиновой.
Хранение В ХУТ темного стекла, в защищенном от света месте, при t не ниже 9`С. На стеклянках должна быть обязательно надпись, которая предупреждает о ядовитости препарата. В качестве стабилизатора добавляют до 1% метанола.
Метенамин* Гексаметилентетрамин Уротропин Methenaminum * Hexamethylentetraminum Urotropinum
CH2 CH2 CH2 N N — CH 2 CH 2 -- N (CH 2)6 N 4 CH 2 Свойства Получают синтетически из раствора формальдегида и аммиака. Бесцветные кристаллы или белый кристаллический порошок, без запаха, жгучего, сладкого, а затем горьковатого вкуса. При нагревании улетучивается не плавясь. Растворим в воде и спирте. Водные растворы имеют слабощелочную реакцию, за счет третичного атома азота. Подлинность 1. р- ция кислотного гидролиза → аммиак определяют по запаху или по посинению влажной лакмусовой бумажки t0 (CH2)6N4 + 2 H2SO4 + 6 H2O → 6 HCOH↑ + 2 (NH4)2SO4 (NH4)2SO4 + 2 NaOH → 2 NH3↑ + 2 H2O + Na2SO4 2. Реакция на остаток формальдегида (альдегидная группа) – образование ауринового красителя → красный или розовый
t0 (CH2)6N4 + 2 H2SO4 + 6 H2O → 6 HCOH↑ + 2 (NH4)2SO4
HOOC – – H || H – – COOH к. H2SO4 + H – C – H + → HO OH
HOOC – – CH2 – – COOH к.H2SO4 → →
HO OH
HOOC – – CH = – COOH → НО О
А) с общими алкалоидными реактивами - р - ром Люголя → бурый осадок - с пикриновой к-той → желтый осадок
Б) р-ции комлексообразования - с AgNO3 → белый осадок 2 (CH 2)6 N 4 • 3 AgNO 3 ↓ - с CaCl2 → белый осадок (CH 2)6 N 4 • CaCl 2 ↓ Количественное определение По ГФ Метод ацидиметрии, вариант обратного титрования, способ гидролитического разложения. Метод основан на способности метенамина вступать в р-цию кислотного гидролиза с серной к-той, избыток которой оттитровывают гидроксидом натрия. Методика: Тн препарата растворяют в воде + избыток 0,1 н р-ра H2SO4, нагревают до полного удаления формальдегида, охлаждают + индикатор метиловый красный и избыток H2SO4, оттитровывают 0,1 н р-ром NaOH до желтого окрашивания. t0 (CH2)6N4 + 2 H2SO4 + 6 H2O → 6 HCOH↑ + 2 (NH4)2SO4 1 моль 4 экв. H2SO4 + 2 NaOH → 2 H2O + Na2SO4 f экв . = 1/4 M 1/ z = М/4 Экспресс-анализ
|
|||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 62; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.219.166 (0.034 с.) |
 СООК СООК
СООК СООК O O
O O
 // Н –С –О t0 // Н –С –ОН
// Н –С –О t0 // Н –С –ОН
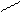
 H – C – H +2 С u + NaОН Cu2О↓ + H – C – ONa + 2
H – C – H +2 С u + NaОН Cu2О↓ + H – C – ONa + 2
 O
O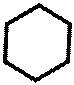

 HOOC – – CH2 – – COOH к.H2SO4
HOOC – – CH2 – – COOH к.H2SO4 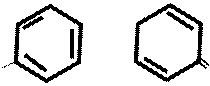
 NH2 N=CH2
NH2 N=CH2
 N
N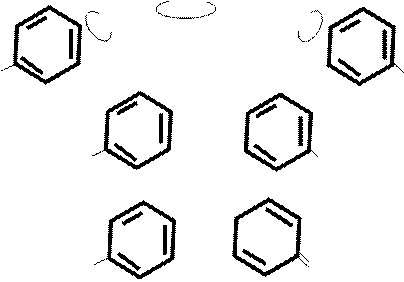 O
O


