
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Научный эксперимент в химической технологииСтр 1 из 12Следующая ⇒
ЛЕКЦИЯ № 1 НАУЧНЫЙ ЭКСПЕРИМЕНТ В ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Наука — область человеческой деятельности, направленная на выработку и систематизацию объективных знаний. Основой этой деятельности является сбор информации, ее постоянное обновление, систематизация и критический анализ. На основании этого разрабатываются новые знания или обобщения, позволяющие анализировать наблюдаемые явления и выделять причинно-следственные связи с целью последующего прогнозирования и управления протекающими процессами. Задачи науки:
Специфика научного исследования ЛЕКЦИЯ № 2 МЕТОДЫ ИССЛЕДОВАНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ Возможность осуществления, направления и полноту любого физико-химического процесса можно оценить на основании второго начала термодинамики. рассматривает второе начало термодинамики. Упрощенный термодинамический анализ состоит в расчете значения энергии Гиббса: Δ G = ΔH -T·ΔS. При значении Δ G: Δ G < 0 процесс протекает самопроизвольно; Δ G > 0 процесс невозможен; Δ G = 0 система находится в состоянии равновесия. Равновесное состояние – термодинамическое состояние системы, при котором не происходит изменения параметров во времени. Особенности равновесного состояния: неизменность состава системы, подвижность (самопроизвольное восстановление равновесия после прекращения внешнего воздействия), динамичность (равенство скорости прямого и обратного процесса), возможность достижения равновесия в результате самопроизвольного и несамопроизвольного процессов, минимальное значение энергии Гиббса (изобарно-изотермического процесса) или энергии Гемгольца (изохорно-изотермического процесса), а также отсутствие их изменений. Химическое равновесие для химических реакций определяется константами равновесия. Константа равновесия – величина, которое количественно характеризует равновесное состояние применительно к химической реакции, т.е. соотношение между исходными веществами и продуктами реакции.
Для гетерогенных систем действует основной закон фазового равновесия – правило Гиббса-Дюгема (правило фаз Гиббса): С = К – Ф + 2. Компонент – наименьшее число веществ, с помощью которых можно описать каждую фазу в отдельности: сумма исходных веществ и реагентов – число реакций. Фаза – система или часть системы, однородную по химическому составу и физическому состоянию и ограниченную поверхностью раздела. Для конденсированных систем: С = К – Ф + 1. Если на состояние системы влияют другие факторы, кроме Р и Т, например электрические и магнитные поля: С = К – Ф + n, где n > 2. ЛЕКЦИЯ № 3
ЛЕКЦИЯ № 4
ЛЕКЦИЯ № 5
ЛЕКЦИЯ № 6 ИССЛЕДОВАНИЕ РАВНОВЕСИЯ В СИСТЕМЕ «ГАЗ-ЖИДКОСТЬ» Комбинированный метод Наиболее распространенным методом исследования равновесия в системе «газ-жидкость» является комбинированный метод: проточный по газу и статический по жидкости. Этот метод может быть реализован в виде двух вариантов: метод «равновесных давлений» и метод «равновесных составов». В методе «равновесных давлений» летучий компонент переходит из жидкости в газовую фазу до установления равновесия «газ-жидкость». В методе «равновесных составов» имеет место обратный переход: компонент переходит из газовой фазы в жидкую до концентрации, равновесной парциальному давлению компонентов газовой фазы. ЛЕКЦИЯ № 7 ЛЕКЦИЯ № 8 ИССЛЕДОВАНИЕ РАВНОВЕСИЯ В СИСТЕМЕ «ГАЗ-ТВЕРДОЕ» СТАТИЧЕСКИМ МЕТОДОМ Вакуум – состояние газа при давлениях ниже атмосферного. Вакуум подразделяется на диапазоны в соответствии с технологией, необходимой для его достижения или измерения, следующим образом:
Создание низкого вакуума
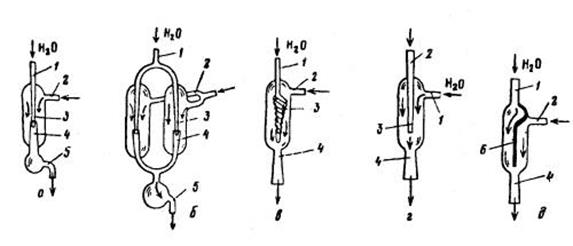
Для получения разряжения, не превышающего 600 - 1300 Па (5-10 торр), применяют водоструйные насосы, действующие по принципу инжектора. Они могут быть металлическими, стеклянными и пластмассовыми. Водоструйные насосы работают под напором водопроводной воды, поступающей в насос через трубку 1. Вода, проходя с большой скоростью через сопло 3 (рис. 1 д-г) и диффузор 4, создает в небольшом зазоре между соплом и диффузором разряжение. Воздух вокруг зазора увлекается в направлении водяной струи и выводится вместе с водой через трубку 5 (рис. 1 а,б) наружу. Зазор между соплом и диффузором не должен быть более 0,3 мм, иначе насос не будет работать. Для увеличения производительности применяют сдвоенные водоструйные насосы (рис. 1 б). Чтобы получить более глубокое разряжение, близкое к 600 Па (5 торр), соплу насоса придают винтообразную форму (рис. 1 в), благодаря которой узкая струя воды приходит в спиральное движение и, выходя из отверстия сопла 3, тотчас же расширяется в диффузоре 4, заполняя весь просвет диффузора.
Таблица 1 Типы вакуумных насосов
Рис.1 Водоструйные насосы: ординарный (а), сдвоенный(б), с винтообразным соплом (в), с боковой струей воды(г), с перегородкой (д)
В некоторых водоструйных насосах (рис. 1 г) струю воды направляют сбоку в рубашку через трубку 1, а воздух засасывается через трубку 2. Такие насосы легко захлебываются, а создаваемое ими разряжение сильно зависит от расстояния нижнего среза трубки 2 от входного отверстия диффузора. Известны водоструйные насосы, корпус которых разделен перегородкой б (рис. 1д), выполняющей функции сопла. Срез перегородки всегда находится по центру над диффузором 4. Трубку, через которую вода вытекает из насоса, делают достаточно широкой, чтобы не создавалось излишнего сопротивления потоку воды. В противном случае насос начинает захлебываться и неравномерно работать. Создаваемый насосом вакуум зависит от конструкции прибора, давления и температуры воды в водопроводе. Как следует из табл. 1, предельный вакуум, создаваемый водоструйным насосом, не может превышать давление пара воды при данной температуре. Ротационные поршневые насосы применяют в основном для создания предварительного вакуума (форвакуума) перед диффузионными знойными насосами. Пластинчато-роторный масляный насос (рис. 2 а)состоит из корпуса 1, в котором выточена цилиндрическая полость 4, включающая эксцентрично вращающийся цилиндрический ротор 3 пришлифованный к внутренней стенке полости. По всей длине ротора его диаметру проделаны две глубокие прорези, в которых находятся металлические пластинки 5, прижимаемые спиральной пружиной к внутренней стенке полости. Пластинки могут вдвигаться и выдвигаться и при вращении ротора скользят по поверхности цилиндра 4. Они играют роль поршней, всасывающих и выбрасывающих газ.
Рис. 2. Однороторный (а) и двухроторный (б) насосы и насос Рутса (г), форбаллон (б)
Корпус 2 насоса погружен в масляную баню 6. Выпускной патрубок снабжен клапаном 1. Трубка 7, соединяющая насос и вакуумируемьй сосуд, должна иметь предохранительный клапан, предотвращающий выброс масла при внезапной остановке насоса. За клапаном ставят ловушку. Для поглощения мельчайших капелек масла, а за ловушкой помещают поглотительные склянки и колонки для извлечения из удаляемого газа или воздуха прежде всего паров воды и агрессивных примесей, затем легколетучих органических веществ, которые попадая в масло, резко ухудшают работу насоса. Важнейшим условием хорошей работы насоса является применение масла, указанного в паспорте к насосу. Пластинчато-роторные масляные насосы часто используют не по назначению: их применяют как вакуум-насосы для перегонки органических веществ, как воздуходувки и т. п. После такой эксплуатации от насоса нельзя ожидать получения вакуума, необходимого для диффузионного насоса. В качестве форвакуумного необходимо иметь отдельный насос, который не следует применять ни для каких других целей. Применение сортов масел, не соответствующих паспортным данным, также приводит к быстрому выходу насоса из строя. Для поддержания нужного вакуума в откачиваемой системе в нее вводят после форвакуумного насоса балластный сосуд, называемый форбаллоном. Объем форвакуумных круглодонных и толстостенных колб обычно составляет 2 - 5 л. Колбу снабжают коротким ртутным манометром, заполняемым ртутью отдельно от колбы, а затем припаянным к ней при помощи ручной паяльной горелки. Баллон обязательно окружают тонкой металлической или капроновой сеткой, предохраняющей экспериментатора от осколков при разрыве баллона.
Создание высокого вакуума Диффузионные насосы применяют для получения вакуума порядка 10-7 – 10-6 торр (10-5 – 10-4 Па). Рабочим телом в таких насосах является кипящая ртуть или кипящая при высокой температуре жидкость. В диффузионных насосах сочетаются два процесса: захват откачиваемого газа струей пара за счет вязкостного трения между ее поверхностными слоями и прилегающими слоями газа и диффузия молекул газа в струю пара жидкости, втекающей из сопла. Разделить эти два процесса трудно. Когда преобладает первый, диффузионный насос называют пароструйным, или насосом Ленгмюра, если же доминирует процесс диффузии, насос называют диффузионным.
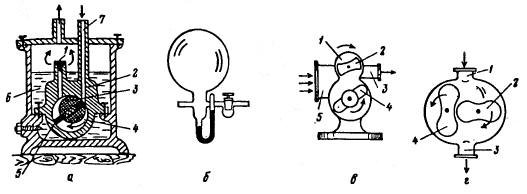
На рис. 3 приведена принципиальная схема пароструйного насоса. Из-под зонтичного сопла 3 через диффузионный зазор 4 вытекает струя пара жидкости, образующегося в колбе 8, нагреваемой электрической плиткой 10. Расширяясь в сопле, струя пара приобретает сверхзвуковую скорость. Молекулы газа, поступающие из патрубка 1, увлекаются струей пара и, подталкиваемые его молекулами, приобретают дополнительную скорость в направлении движения потока пара. Пар конденсируется на охлаждаемых стенках сосуда 2, а конденсат стекает в колбу через трубки 9. Молекулы газа выбрасываются через патрубок 7 на вход форвакуумного насоса, с помощью которого удаляются окончательно из вакуумируемой системы. Предельный вакуум, создаваемый диффузионным насосом, определяется главным образом температурой стенки охлаждающей рубашки 5, но отчасти зависит и от давления насыщенного пара рабочей жидкости, от обратной диффузии молекул откачиваемого газа, от выделения газообразных продуктов из конструкционных материалов насоса и газообразных примесей из рабочей жидкости. В качестве рабочей жидкости для диффузионных насосов, кроме ртути, применяют жидкости, обладающие очень небольшим давлением пара в обычных условиях, высокой термической устойчивостью и незначительной окисляемостью кислородом воздуха. Диффузионные насосы могут работать только при форвакууме не ниже 0,1 торр (13 Па), создаваемого механическими ротационными насосами. При более высоком давлении масло диффузионного насоса может разлагаться с образованием легколетучих продуктов, снижающих степень разряжения. Давление форвакуума для ртутных насосов (10-20 торр) выше, чем давление для масляных (0,05 - 0,5 торр). Обогрев диффузионных насосов включают лишь тогда, когда достигнут необходимый форвакуум. Прекращение тока охлаждающей воды в холодильнике ртутных диффузионных насосов может привести к проникновению воздуха в насос, образованию в нем HgO и даже к взрыву. Сорбционные вакуумные насосы применяют для создания предварительного разряжения в ионно-геттерном насосе и для удаления газов, выделяемых конструкционными материалами высоковакуумных установок. В таких насосах газ остается в насосе в связанном виде на поглощающих поверхностях или в приповерхностных слоях. Насос состоит из камеры 5 (рис. 4 а) с адсорбентом ((цеолиты, силикагель, активированный уголь и др.), внутри которой расположен сетчатый стакан 4. Через кран 2 камеру соединяют к ионно-геттерному насосу, а через кран J - к диффузионному или ротационному насосу.
Рис. 4. Вакуумные насосы: адсорбционный (а) и ионно-геттерный (б, в)
Перед использованием сорбционного насоса содержащийся в нем сорбент активируют, нагревая камеру примерно до 200 °С при открытых кранах 2 и 3 для удаления пара воды - основного компонента, поглощаемого сорбентом. Затем эти краны закрывают и камеру 5 погружают в сосуд Дьюара 6 с жидким азотом. После этого открывают краны 2 к 3 и поочередно включают насосы, начиная с ротационного. После извлечения камеры из жидкого азота, сначала открывают кран 1 для сброса избыточного давления.
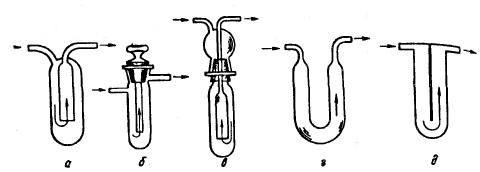
Адсорбционная способность активированного угля для различных газов неодинакова и возрастает с понижением температуры. Например 1 см3 его при -185 °С поглощает: Не -15 см3, Н2 - 135 см3, N2 - 155 см3, Аг- 175 см3, С02 - 190 см3, а 02 -230 см3. Ионно-геттерные вакуумные насосы. Эффект ионно-геттерного откачивания газа обусловлен высокой химической активностью ионизированных молекул, способных проникать в поверхностный слой распыляемых частичек геттера и химически взаимодействовать с ним. Геттер (от англ. getter - газопоглотитель) - вещество, способов связывать газы, кроме благородных, в химические соединения. В качестве геттеров применяют титан, барий и его сплавы с аллюминием и титаном, лантан, церий и другие металлы. В частности, титан связывает кислород с образованием диоксид; TiO2, а азот - с образованием нестехиометрического нитрида TiNv,, барий превращается в оксид ВаО и нитрид Ва3N2, а с парами воды дает смесь гидрида ВаН2 и оксида ВаО. Ионизацию газа проводят сильным электрическим разрядом, который одновременно и распыляет геттер. Частички геттера, связавшие ионизированные молекулы газа, направляются к поверхности корпуса насоса при помощи электрического поля. Ловушки для конденсации газов Перед форвакуумным и диффузионным насосами на пути откачиваемого газа всегда помещают ловушки для конденсации газов, растворяющихся в жидкостях насосов или взаимодействующих с ртутью (С02, H2S, H2O, S02, NO2, галогеноводороды и др.). Ловушки погружают в жидкий азот, при температуре испарения которого полностью конденсируются многие газы, за исключением Не, Н2, Ne, CO, F2, Ar, 02, CH4 и NO. Формы ловушек разнообразны (рис. 5). Их изготавливают из тонкостенного стекла (0,8 - 1,0 мм), поскольку толстостенное стекло при резком изменении температуры может треснуть. Тонкие стенки ловушек, кроме того, улучшают теплопроводность.
Рис. 5. Ловушки для конденсации газов: простая (а), с краном (б), с пришлифованной головкой (в), U-образная (г), с перегородкой (д)
Принцип работы вакуумного блока
Насос 7 соединен с вакуумируемым сосудом 11 через кран 10 и охлаждаемую ловушку 9. Таким образом, диффузионный насос 7 можно легко отключить от сосуда 10. Насос 2 посредством обходной линии и крана 13 может быть, непосредственно связан с сосудом 11. Вакуумметр 4 при закрытых кранах 5, б и. 13 позволяет определить остаточное давление, создаваемое насосом 1. Кран 5 служит для впуска воздуха после выключения установки. Вакуумметр 12 измеряет давление в сосуде 11, а вакуумметр 8 - давление, создаваемое диффузионным насосом 7. Ловушки 3и 1 необходимы для поглощения мельчайших капель масла насоса 2. Прежде чем включать нагреватель насоса 7, пускают водяное охлаждение. Поток воды должен быть таким, чтобы температура воды на выходе не превышала 20 °С. Затем приводят в действие форвакуумный насос 2. После достижения требуемого вакуума включают нагреватель насоса 7. При выключении диффузионного насоса первым отключают его нагрев и закрывают краны 6 и 10. Дают насосу остыть до 50 "С. Затем выключают насос 2 и впускают в него воздух, открыв кран 5. Только после этого впускают в насос 7 воздух, открыв кран 6. Последним отключают водяное охлаждение диффузионного насоса.
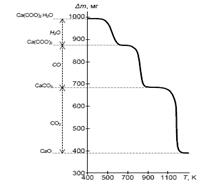
ЛЕКЦИЯ № 9 ТЕРМИЧЕСКИЙ АНАЛИЗ Термический анализ является одним из важнейших методов физико-химического исследования веществ. При воздействии высоких температур протекают химические реакции (дегидратация, разложение и т.д.) и физические превращения (плавление, полиморфные переходы и т.д.). Термический анализ широко используется при исследовании твердофазных процессов, реакций термического разложения и фазовых превращений веществ. В основе метода лежит зависимость физических или химических свойств материалов от температуры. В зависимости от измеряемого параметра различают основные методы исследований: - дилатометрия – измерение линейных и объемных размеров материалов; дифференциально-термический анализ (ДТА) – определение разности температур между образцом и эталоном; - дифференциально-сканирующая калориметрия (ДСК) основан на непрерывной регистрации разности теплового потока от образца и эталона как функция температуры; - термогравиметрический анализ (ТГА) – определение величины и характера изменения массы образца в условиях программируемого подъема температуры. - синхронный термический анализ предполагает одновременное использование термогравиметрии и дифференциальной сканирующей калориметрии (ТГА/ДСК) или термогравиметрии и дифференциального термического анализа (ТГА/ДТА). Наиболее широко применяются термогравиметрический и дифференциальный термический анализы. Термогравиметрический метод анализа основан на регистрации изменения массы образца при повышении температуры. Изменение массы твердых тел обусловлено протекающими физико-химическими процессами. Для процессов разложения и диссоциации характерно уменьшение массы образца, для реакции окисления − напротив, увеличение массы. Установка для термогравиметрических исследований состоит из термовесов, предназначенных для непрерывной регистрации изменений массы, печи, в которую помещен образец, термопары и программного регулятора температуры. Термогравиметрический анализ (ТГА) заключается в измерении зависимости массы твердого образца от температуры среды, в которую он помещен. Кривая потери массы от температуры (кривая ТГ, рис. 2) имеет вид плато, горизонтальный участок которой говорит об устойчивости химического соединения в данном интервале и отсутствии химических превращений (при этом физические превращения не исключается), вертикальный участок на кривой свидетельствует о химическом разложении материала. На основании кривой ТГ можно определить потерю массы при нагревании (Δ m), что позволяет оценить содержание примесей в анализируемом материале. Для этого необходимо знать состав химического соединения, относящегося к данному температурному плато, и состав продукта разложения.
Рис. 3. Термогравиметрическая кривая разложения кристаллогидрата оксалата кальция
К сожалению, кривая ТГ не позволяет точно определить температуру разложения (истинную температуру химической реакции). Температуру химической реакции можно с высокой точностью определить, если воспользоваться дифференциальной формой записи, показывающей скорость изменения массы образца Возможны следующие варианты методов исследований: изотермический, когда масса образца изменяется на протяжении некоторого времени при выбранной температуре, квазистатический, когда образец нагревается при каждой из ряда возрастающих температур до достижения постоянного значения массы, и динамический, когда температура среды, окружаемой нагреваемый образец, изменяется по заданному закону. Из большого числа различных типов химических реакций наиболее хорошо изучены реакции разложения, на протекание которых в статических условиях в значительной степени влияют давление и состав газовой фазы, а в проточных системах - гидродинамические условия. Для определения состава газовой фазы используют химические и инструментальные методы анализа. Для этого должен быть предусмотрен непосредственный контакт ячейки с измерительным прибором (манометром или газовой бюреткой). Для определения количественного состава газовой фазы часто прибегают к вымораживанию, поглощению или превращению продуктов в легко анализируемую форму. Метод дифференциального термического анализа (ДТА) основан на сравнении термических свойств образца исследуемого вещества и термически инертного эталона, в качестве которого применяются вещества, не претерпевающие никаких изменений при нагревании до требуемой температуры. В качестве эталонов применяются прокаленные оксиды алюминия или магния. Нулевой линией называется параллельная оси абсцисс линия, проведенная через начало хода кривой ДТА. Часто после завершения процесса разложения кривая ДТА не возвращается к нулевой линии, а идет параллельно ей или под некоторым углом. Эта линия хода термической кривой носит название базисной линии. Расхождение базисной и нулевой линий обусловлено различными теплофизическими свойствами исследуемого и эталонного веществ. Схематическое изображение простой (Т) и дифференциальной (ДТА) кривых нагревания приведено на рис. 4.
Рис. 4. Схематическое изображение простой (Т) и дифференциальной (ДТА) кривых нагревания
Экстремумы (пики) на кривой ДТА на базисной линии соответствуют термическим эффектам. Так, эндотермические превращения отображаются отклонением кривой ДТА ниже базисной линии, выше базисной линии – экзотермическими. Первые обычно обозначаются знаком «минус», вторые – «плюс». Положение термических эффектов на термограмме кривой ДТА характеризуется температурными границами протекания реакции. Значение температур определяют графически, снося соответствующие точки с кривой ДТА на простую температурную кривую, а затем на ось температур. Устанавливают температуры начала Т 0, максимума Т max и окончания термического эффекта Тк. Вследствие трудностей, связанных с определением графических путей температуры начала реакции, наиболее надежной характеристикой является температура Т mах. Изменения температуры образца вызываются физическими переходами или химическими реакциями, связанными с изменением энтальпии. К ним относятся фазовые переходы, плавление, перестройка кристаллической структуры, реакции дегидратации и разложения, разрушение кристаллической решетки и др. В общем случае фазовые переходы, дегидратация, восстановление и некоторые реакции разложения сопровождаются эндотермическими эффектами, а кристаллизация, окисление и отдельные процессы термолиза – экзотермическими эффектами. Дериватография (от лат. derivatus- отведенный, отклоненный и греч. Apho-пишу)-комплексный метод исследования химических и физико-химических процессов, происходящих в твердом теле в условиях программного подъема температуры, получивший в настоящее время широкое распространение. Дериватография основана на сочетании дифференциального термического анализа с другими физико-химическими методами термогравиметрией, масс-спектрометрией и т.д. Дериватографом называется прибор, совмещающий термогравиметрический и дифференциальный термический анализы. При проведении дериватографических исследований регистрируются четыре кривые (рис. 4.5): - зависимость температуры от времени носит линейный характер и показывает скорость нагрева образца (Т); - термогравиметрическая кривая показывает зависимость изменения массы от температуры нагрева образца (ТГ); - кривая дифференциально-термического анализа отражает тепловые эффекты процессов, происходящих при нагревании вещества (ДТА); - дифференциально-термогравиметрическая кривая отражает скорость изменения массы образца (ДТГ). Основным отличием дериватографа от других термических установок является тождественность условий опыта, что достигается путем одновременной регистрации всех кривых на одном листе для одной и той же навески при соответствующих одинаковых температурах нагрева. Совместное получение простой и дифференциальной кривых дает возможность обнаружить и количественно оценить даже очень слабые эффекты потери массы в изучаемом веществе. Дериватограф Q-1500D позволяет проводить термогравиметрические исследования при нагревании образца до 1500 оС, а также квазитермические и квазиизобарные измерения при температурах до 100 оС. Последние обеспечивают значительно большую селективность по сравнению с традиционными измерениями, при которых нагрев печи производится по линейному закону. При этом происходит удлинение температурного интервала разложения, вызываемое прежде всего перепадом температуры внутри пробы, что несомненно является следствием динамического нагревания печи. Такое явление особенно ярко проявляется при нагреве с высокой скоростью. Однако при медленном нагреве или при изотермическом исследовании значительно реже проявляются погрешности. Желаемый нагрев со скоростью 0,1-0,2 град/мин в практических условиях неосуществим вследствие высокой продолжительности опыта. Решением этой проблемы является Q -дериватография. Квазитермический режим предусматривает нагрев образца с большой скоростью (2-5 о/мин) до момента разложения, затем нагрев прекращается. Регулирование температуры производится таким образом, чтобы изменение массы происходило с очень малой скоростью, величина которой задается путем изменения порога чувствительности усилителя. Схематическое устройство дериватографа марки Q-1500D приведено на рис. 4.5.
Рис.5. Принципиальная схема дериватографа Q-1500D: 1 − тигель с исследуемым образцом; 2 − печь; 3 − керамическая трубка с термопарами; 4 − весы; 5 − программатор нагрева; 6 − датчик скорости изменения массы; 7 − датчик изменения массы; 8 − усилитель выходного сигнала; 9 − дериватограммма; 10 − термопара; 11 − защитный кварцевый стакан; 12 − подвод инертного газа; a – изменение температуры эталона (Т); и- запись дифференциального термического анализа (DTA); с- изменение массы образца (TG); в- скорость изменения массы образца (DTG).
Важнейшей частью дериватографа является термовесовой блок, в котором располагаются равноплечные аналитические весы (4), снабженные пневмозатухающим устройством. На одном плече весов находятся на керамическом стержне с термоэлементом (1) два тигля, в одном из которых находится исследуемый образец, а в другом − инертное вещество. Устройство тиглей изображено на поз. 10. Внутри тигля имеется термопарный чехол, для регистрации температуры внутри образца. Керамическая трубка с тиглем в процессе работы помещается в печь (2), подъем и опускание которой производятся автоматически. Режим работы дериватографа, а именно скорость нагрева, задаются с помощью программатора нагрева (5). Изменение массы регистрируется с помощью датчика изменения массы (7). Определение скорости изменения массы производится с помощью дифференциального трансформатора – датчика изменения массы (6), который преобразует движение плеча весов в соответствующий электрический сигнал. Затем с помощью усилителя выходного сигнала (8) информация преобразовывается в дериватограмму (9), на которой представлено одновременно четыре кривых. В зависимости от условий опыта возможно проведение термического анализа в инертной среде, например в аргоне, для чего в приборе предусмотрен ввод газа (12). Иногда для температурной стабилизации и уменьшения градиента температур используют защитный кварцевый стакан (11). Особое внимание необходимо уделить рассмотрению влияния скорости нагревания на наблюдаемую температуру разложения образца. Неизотермические методы определения кинетических параметров по сравнению с изотермическими обладают рядом преимуществ: требуется гораздо меньше данных; кинетические параметры могут быть рассчитаны для всего диапазона температур; при нагревании до исследуемой температуры образец часто вступает в реакцию, поэтому результаты, полученные изотермическими методами, нередко оказываются недостоверными; для исследования требуется одни образец. Однако неизотермический метод не дает информации о механизме реакции, о достоверных значения энергии активации и порядка реакции. Расчет кинетических параметров по ТГ −кривой основаны на формальном кинетическом уравнении. где Это уравнение хорошо описывает кинетику термического разложения твердых веществ, например оксалатов, перманганатов и перхлоратов металлов. Зависимость удельной константы скорости от температуры описывается уравнением Аррениуса: k = A·e - E / RT , (4.2) где А – предэкспоненциальный множитель; Е - энергия активации; R - универсальная газовая постоянная. Для изучения кинетики разложения используются дифференциальный и интегральный методы, а также метод аппроксимации. Остановимся более подробно на методах расчета кинетических параметров, получивших наибольшее распространение Метод Ньюкирка На основании ТГ -кривой Ньюкирк получил выражение для расчета скорости реакции разложения. Для температур Т1 и Т2 остаточные массы образца составляют Зависимость ln k = f (1/ T) в этом случае носит линейный характер. ЛЕКЦИЯ № 1 НАУЧНЫЙ ЭКСПЕРИМЕНТ В ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Наука — область человеческой деятельности, направленная на выработку и систематизацию объективных знаний. Основой этой деятельности является сбор информации, ее постоянное обновление, систематизация и критический анализ. На основании этого разрабатываются новые знания или обобщения, позволяющие анализировать наблюдаемые явления и выделять причинно-следственные связи с целью последующего прогнозирования и управления протекающими процессами. Задачи науки:
|
|||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 41; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.149.229.253 (0.104 с.) |




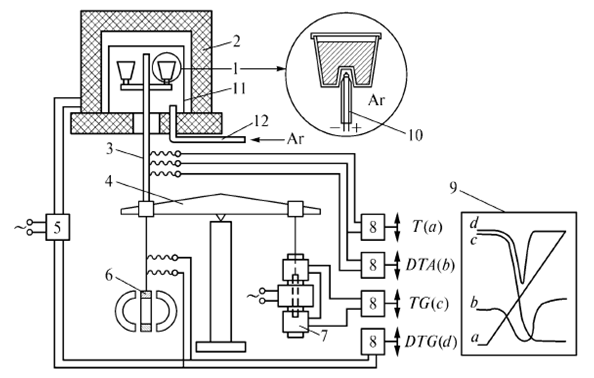
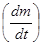 от времени нагрева t. Каждый пик на дифференциальной кривой ДТГ соответствует максимальной скорости изменения массы, т.е. истинной температуре химической реакции.
от времени нагрева t. Каждый пик на дифференциальной кривой ДТГ соответствует максимальной скорости изменения массы, т.е. истинной температуре химической реакции.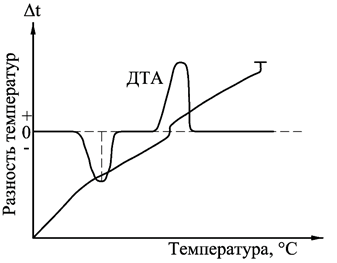
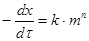 ,
, 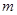 - масса образца, вступившая в реакцию; n - порядок реакции; k - удельная константа скорости реакции.
- масса образца, вступившая в реакцию; n - порядок реакции; k - удельная константа скорости реакции.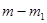 и
и 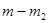 , при этом скорости реакции
, при этом скорости реакции 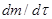 определяются как тангенсы углов наклона касательных к ТГ - кривой в точках 1 и 2. Для реакции первого порядка уравнение имеет следующий вид:
определяются как тангенсы углов наклона касательных к ТГ - кривой в точках 1 и 2. Для реакции первого порядка уравнение имеет следующий вид: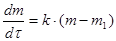 .
. 


