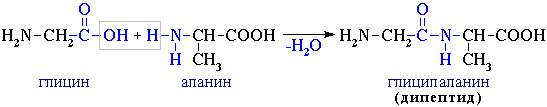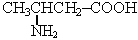Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Проверка знаний теоретического материалаСтр 1 из 11Следующая ⇒
Проверка знаний теоретического материала Номенклатура. Вещества называют по тем радикалам, которые входят в состав молекулы, с прибавлением слова “амин”.
Назвать вещества. а).CH3 – CH2 – CН2 – NH2 1 - аминпропан б). CH3 – CН2 – CН2 – CН2 – NH2 1 – аминобутан в)
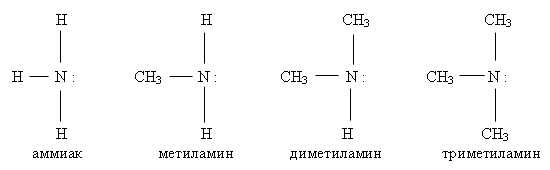
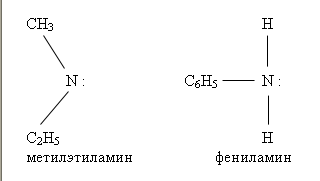
5.Амины делятся на: Первичные СН3 – NН2, С2Н5 – NН2 Вторичные СН3 – NН – СН3, С2Н5 – NН2 –С2Н5 Третичные СН3 – N – СН3, С2Н5 – NН2 –С2Н5 СН3 СН3 Физические свойства аминов. Метиламин, диметиламин и триметиламин — газообразные вещества, с запахом аммиака, хорошо растворяются в воде. Средние члены алифатического ряда – жидкости со слабым запахом тухлой рыбы.Высшие амины (начиная с С16Н35N — твердые нерастворимые вещества, не имеющие запаха. Ароматические амины – бесцветные высококипящие жидкости или твердые вещества, практически нерастворимые в воде. Анилин (фениламин) С6H5NH2 – важнейший из ароматических аминов: Анилин представляет собой бесцветную маслянистую жидкость с характерным запахом На воздухе быстро окисляется и приобретает красно-бурую окраску. Ядовит. Химические свойства. Опыт №1. Взаимодействие анилина с соляной кислотой. С6H5NH2 + HCl → (С6H5NH3)+ Cl- получился хлорид фениламмония Таким образом, АМИНЫ представляют собой органические основания. Опыт №2. Горение анилина. 4CH3NH2 + 9O2 → 4CO2 + 2N2 + 10 H2O Опыт №3. Галогенирование анилина. C 6 H 5 N H 2 + 3 Br 2 → C 6 H 2 N H 2 Br 3 + 3 H Br
Получение аминов Из-за запаха низшие амины долгое время принимали за аммиак, пока в 1849 году французский химик Шарль Вюрц не выяснил, что в отличие от аммиака, они горят на воздухе с образованием углекислого газа. Он же синтезировал метиламин и этиламин. Г Н. Н. Зинин получил анилин восстановлением нитробензола - в промышленности Восстановление нитросоединений: R-NO2+3(NH4)2S t, Fe в кислой среде →R-NH2 +3S↓ +6NH3↑ + 2H2O (р. Зинина) гордимся!! Другие способы: 1). Промышленный CH3Br + 2NH3 t, ↑p → CH3-NH2 + NH4Br 2). Пропусканием паров спирта и аммиака при 300оС над катализатором. С Применение. Амины используют при получении лекарственных веществ, красителей и исходных продуктов для органического синтеза. Гексаметилендиамин при поликонденсации с адипиновой кислотой дает полиамидные волокна.
Анилин находит широкое применение в качестве полупродукта в производстве красителей, взрывчатых веществ и лекарственных средств (сульфаниламидные препараты). Аминокислоты 1. Аминокислотами называются азотсодержащие соединения, в молекулах которых содержатся аминогруппа – NH2 и карбоксильная группа – СООН, связанные с углеводородным радикалом 2. Общая формула аминокислот: NH2—R—COOH 3. Номенклатура, аминокислот в основном выражается разным строением углеродной цепи и положением аминогруппы: 4 3 2 1 СН3 – СН2 – СН – СООН 2 – аминобутановая кислота | NH2
СН3 3 2 | 1 СН2 – СН – СООН 3- амино- 2- метилпропановая кислота | NH2 Кроме международной номенклатуры, употребляются еще названия аминокислот, в которых вместо цифр ставят буквы греческого алфавита: α, β, γ и.т.д. Например: (записываем на доске)
γ β α СН3 – СН2 – СН – СООН | NH2
α – аминобутановая кислота
γ β α СН3 – СН – СН2 – СООН | NH2 β – аминобутановая кислота 4.Физические свойства: бесцветные кристаллические вещества с температурами плавления 150 - 250oС, хорошо растворимы в воде (лучше, чем в органических растворителях), многие - сладкие Химические свойства 1) Реакции с растворами кислот: NH2CH2COOH + HCl 2) Реакции с растворами щелочей: NH2CH2COOH + NaOH Аминокислоты - амфотерные органические вещества. В водных растворах большинства аминокислот среда слабокислотная. 4NH2CH2COOH + 13O2
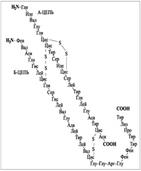
При взаимодействии двух α-аминокислот образуется дипептид.
1 стадия CH3—CH2—COOH + Cl2 2 стадия Значение аминокислот. а)Усваиваясь, аминокислоты производят такие важные вещества, как ферменты, которые поддерживают биохимические реакции, гормоны, оказывающие влияние на метаболизм, гемоглобин, который доставляет кислород по всему организму, и антитела, помогающие иммунной системе бороться с инфекциями. б)От аминокислот зависит работа нервной системы. Если вы не получаете достаточного количества незаменимых аминокислот для производства нейротрансмиттеров - веществ, которые дают возможность сигналам в нервной системе перемещаться от нерва к нерву, - ваша нервная система не сможет функционировать должным образом. К примеру, недостаток аминокислоты триптофан может привести к низкому уровню важного нейротрансмиттера серотонина. Сниженный уровень серотонина в головном мозге связан с такими расстройствами, как депрессия и бессонница, и даже с расстройствами пищеварения.
в)По причине удивительного биологического и терапевтического действия аминокислот они все больше и больше интересуют ученых. г)Недавние исследования показывают, что аминокислоты, принимаемые в виде капсул или таблеток, могут облегчитъ протекание некоторых заболеваний и способствовать излечению. Например, фенилаланин приносит облегчение при хронических болях, глут амин помогает понизить тягу к сладкому и алкоголю. 8. Самостоятельная работа с последующим самоконтролем:
2) Составьте формулу 3 – аминопропановой кислоты 3) С какими из перечисленных веществ не реагирует аминокислота: 4) Как называется способность вещества проявлять кислотные и основные свойства?
История открытия витаминов Во второй половине XIX века считалось, что пищевая ценность продуктов определяется содержанием в них белков, жиров, углеводов, минеральных солей и воды. Между тем за века человечество накопило немалый опыт длительных морских путешествий, когда при достаточных запасах продовольствия люди гибли от цинги. Впервые (1880 г) с витаминами столкнулся русский ученых Н.И. Лунин. Он провел эксперимент с мышами, разделив их на 2 группы. Одну группу он кормил натуральным цельным молоком, а другую держал на искусственной диете, состоящей из белка-казеина, сахара, жира, минеральный солей и воды. Через 3 мес. мыши второй группы погибли, а первой остались здоровыми. Этот опыт показал, что помимо питательных веществ для нормальной жизнедеятельности организма необходимо еще какие-то факторы. Немного позднее голландский ученый Христиан Эйкман - врач, который работал на острове Ява, обратил внимание на то что, среди населения те, кто питался полированным очищенным рисом, болели заболеванием, связанным с поражением нервной системы - полиневрит. Эти же случаи были отмечены в тюрьме, среди заключенных. Это заболевание было названо Бери-Бери. В 1911 году поляк Казимир Функ выделил из кожуры риса вещество, которое предупреждало заболевание Бери-Бери. Это вещество содержало аминогруппу, и он его назвал витамин (вита - жизнь, амин - амин, то есть жизненный амин). К настоящему времени известно более 30 витаминов. Некоторые из них не содержат аминогруппу, но по традиции они тоже называются витаминами. (Приложение 1)
Роль витаминов в организме Витамины - низкомолекулярные органические соединения различной химической природы, необходимые для осуществления жизненно важных биохимических и физиологических процессов в живых организмах. Витамины необходимые для нормальной жизнедеятельности человека и животных; они играют решающую роль в обмене веществ. Витамины не синтезируются в организме или синтезируются в недостаточном количестве. Витамины выполняют в организме каталитические функции. Они поступают с растительной или животной пищей. Суточная потребность в витаминах измеряется в миллиграммах, микро граммах.
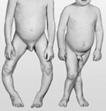
Гиповитаминоз (от гипо (греч. ὑπο — под, внизу) и витамины), болезненное состояние, возникающее при нарушении соответствия между расходованием витаминов и поступлением их в организм; то же, что витаминная недостаточность. Гиповитаминоз развивается при недостаточном поступлении витаминов. Гиповитаминоз развивается незаметно: появляется раздражительность, повышенная утомляемость, снижается внимание, ухудшается аппетит, нарушается сон. Систематический длительный недостаток витаминов в пище снижает работоспособность, сказывается на состоянии отдельных органов и тканей (кожа, слизистые, мышцы, костная ткань) и важнейших функциях организма, таких как рост, интеллектуальные и физические возможности, продолжение рода, защитные силы организма. Авитамино́з — заболевание, являющееся следствием длительного неполноценного питания, в котором отсутствуют какие-либо витамины. Признаки авитаминоза: зависят от того витамина, которого не хватает организму. Причины, вызывающие авитаминоз: · нарушение поступления витаминов с пищей при неправильном питании, недостаточном или некачественном питании; · нарушение процессов пищеварения или нарушение работы органов, связанных непосредственно с пищеварением; · поступление в организм антивитаминов, например лекарственных препаратов синкумар, дикумарол, применяющихся при лечении повышенной свертываемость крови. Некоторые авитаминозы: Цинга - болезнь, вызываемая острым недостатком витамина C (аскорбиновая кислота), который приводит к нарушению синтеза коллагена, и соединительная ткань теряет свою прочность (кровоточивость десен). Куринная слепота – болезньпри нехватке витамина А. Человек ощущает постоянное ухудшение способностей четко видеть в сумерках или при плохом освещении, сетчатка глаз становится крайне чувствительной к яркому дневному свету. Бери-бери - болезнь, возникающая вследствие недостатка тиамина (витамина В1) в организме человека. Это состояние возникает у людей, питающихся преимущественно белым рисом (рисом, лишённым оболочки) и некоторыми видами других зерновых культур.
Рахит — болезнь, возникающая при недостатке витамина D. Заболевание детей грудного и раннего возраста, протекающее с нарушением образования костей и недостаточностью их минерализации, обусловленное главным образом дефицитом кальция. Пелла́гра (шершавая кожа) редкое заболевание, обусловленное недостаточным поступлением в организм или неполным усвоением никотиновой кислоты (витамина РР). Г ѝ первитамино́з — острое расстройство в результате интоксикации сверхвысокой дозой одного или нескольких витаминов (содержащихся в пище или витаминсодержащих препаратах). Различают 2 типа гипервитаминоза: · острый гипервитаминоз - возникает в случае единовременного приема большого количества витаминов определенной группы или нескольких групп. По симптоматике схож с острым отравлением; · хронический гипервитаминоз - развивается при регулярном приеме в пищу определенного витамина в дозе, превышающей норму. Симптомы этой разновидности менее остры. Основной причиной гипервитаминоза является превышение рекомендованной дозы препаратов (в то числе и БАД), содержащих этот витамин. Также вероятность возникновения гипервитаминоза возможна в случае приема дополнительных витаминов, в сочетании с употреблением продуктов и так богатых этим витамином. (Приложение 2)
Классификация витаминов
Каждая из этих групп содержит большое количество различных витаминов, которые обычно обозначают буквами латинского алфавита. Следует обратить внимание, что порядок этих букв не соответствует их обычному расположению в алфавите и не вполне отвечает исторической последовательности открытия витаминов. По химическому строению и физико-химическим свойствам (в частности, по растворимости) витамины делят на 2 группы: 1) Водорастворимые - витамины при их избыточном поступлении в организм, будучи хорошо растворимыми в воде, быстро выводятся из организма. 2) Жирорастворимые - витамины хорошо растворимы в жирах и легко накапливаются в организме при их избыточном поступлении с пищей. Их накопление в организме может вызвать расстройство веществ, называемое гипервитаминозом, и даже гибель организма.
Водорастворимые витамины Жирорастворимые витамины Витаминоподобные соединения Тиамин (витамин В1) Рибофлавин (витамин В2) Ниацин (никотиновая кислота, витамин РР) Пиридоксин (витамин В6) Цианкобаламин (витамин В12) Фолацин (фолиевая кислота) Пантотеновая кислота (витамин Вз) Биотин (витамин Н) Аскорбиновая кислота (витамин С) Ретинол (витамин А) Кальциферолы (витамин D) Токоферолы (витамин Е) Филлохиноны (витамин К) Биофлавоноиды (витамин Р) Пангамовая кислота (витамин В15) Парааминобензойная кислота (витамин H1) Оротовая кислота (витамин B13) Холин (витамин В4) Инозит (витамин В8) Метилметионинсульфоний (витамин U) Липоевая кислота
Водорастворимые витамины
Жирорастворимые витамины
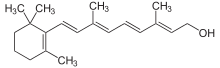
Витамин А (ретинол)
Физиологическая функция: принимает участие в ряде окислительно-восстановительных процессов, обеспечении функции зрения, процессах роста и регенерации тканей; усиливает иммунитет. Суточная доза: 1–2,5 мг витамина А или 2–5 мг бета-каротина (провитамина А). Источник: яичный желток, молоко, сметана, сливки, красно-мякотные овощи (морковь, томаты, перец и др.) В организме депонируется: в печени, в норме печень человека содержит около 20 мг витамина на 100 г своего веса. Гиповитаминоз: проявляется в нарушениях зрения в сумерках и при низкой освещенности; торможении процессов регенерации тканей при травмах; специфических изменениях кожи и слизистых оболочек с тенденцией к сухости и ороговению. Недостаток: бледность, сухость и шелушение кожных покровов; предрасположенность к образованию угрей и фурункулов; ломкость и расслоение ногтей; повышенная утомляемость. Витаминоподобные вещества
История изучения ферментов
Ферменты или энзимы - это органические катализаторы белковой природы, которые ускоряют реакции, необходимые для функционирования живых организмов. Термин фермент предложен в XVII веке химиком ван Гельмонтом при обсуждении механизмов пищеварения. В кон. ХVIII — нач. XIX вв. уже было известно, что мясо переваривается желудочным соком, а крахмал превращается в сахар под действием слюны. Однако механизм этих явлений был неизвестен. В XIX в. Луи Пастер, изучая превращение углеводов в этиловый спирт под действием дрожжей, пришёл к выводу, что этот процесс (брожение) катализируется некой жизненной силой (ферментом), находящейся в дрожжевых клетках, причём он считал, что эти «силы» неотделимы от структуры живой клетки дрожжей. Эта точка зрения господствовала в науке в течение длительного времени и шла в разрез с господствовавшей тогда теорией брожения Ю. Либиха, согласно которой все процессы брожения представлялись чисто химическими явлениями каталитического характера, (будто бы спиртовое брожение происходит вследствие того, что молекулярные колебания разлагающихся частиц дрожжей передаются сахару и сахар начинает распадаться на спирт и углекислый газ). Таким образом, дрожжи вызывают брожение не при жизни, а только после своей смерти.. Различные точки зрения о природе спиртового брожения в теоретическом споре Л. Пастера с одной стороны, и механицистов М. Бертло и Ю. Либиха — с другой привели к разделению в научной среде двух соответствующих терминов. Собственно ферментами (от лат. fermentum — закваска) стали называть «организованные ферменты», то есть сами живые микроорганизмы. В противовес этому подходу в 1876 году В. Кюне предложил термин энзим (от греч. ἐν- — в- и ζύμη — дрожжи, закваска, то есть «в дрожжах») для обозначения «неорганизованных ферментов», секретируемых клетками, например, в желудок (пепсин) или кишечник (трипсин, амилаза). Через два года после смерти Л. Пастера в 1897 году Э. Бухнер опубликовал работу «Спиртовое брожение без дрожжевых клеток», в которой экспериментально показал, что бесклеточный дрожжевой сок осуществляет спиртовое брожение так же, как и неразрушенные дрожжевые клетки. В 1907 году за эту работу он был удостоен Нобелевской премии. Впервые высокоочищенный кристаллический фермент (уреаза) был выделен в 1926 году Дж. Самнером. В течение последующих 10 лет было выделено ещё несколько ферментов, и белковая природа ферментов была окончательно доказана. Строение ферментов
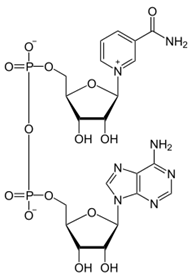
Ферменты представляют собой простые белки (протеины) глобулярного строения или являются протеидами – сложные ферменты, состоящие из белковой и небелковой частей (чаще всего). Сложный фермент – холофермент. Апофермент – белковая часть фермента. КФ - кофермент- небелковая часть фермента, сравнительно независимая от белковой части. ПГ – простетическая группа – прочно и постоянно связанная с белковой частью группа. Строение некоторых КФ и ПГ: · Кофермент NAD +:
никотинамид-аденин-динуклеотид · Простетическая группа FMN:
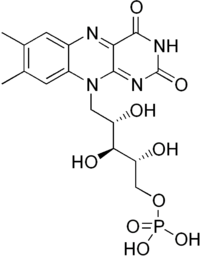
FMN флавин-мононуклеотид(рибофлавин -5-фосфат) КФ или ПГ участвует в акте катализа, осуществляя контакт между энзимом и субстратом. АЦ- активный центр (имеет каталитическую и связывающую зоны) и представляет собой часть молекулы фермента, где происходит связывание и превращение субстрата. (Приложение 4) Классификация ферментов
В клетке исчисляется около 10 000 ферментов, которые катализируют около 2000 реакций. Известно 1800 ферментов, из них 150 выделены в кристаллическом виде. В основу классификации ферментов положена их способность катализировать реакции определенного типа. Выделяют 6 классов ферментов: 1. Оксидоредуктазы – ферменты, каталиирующие окислительно-восстрновительные реакции. Подклассы: · дегидрогеназы; · оксидазы; · редуктазы; · трансгидрогеназы; · гидроксилазы. Пример: алкогольдегидрогеназа катализирует окисление этанола в уксусный альдегид. 2. Трансферазы- ферменты, ускоряющие процессы переноса различных группировок атомов (метильной, аминной, карбоксильнойц…) с одной молекулы на другую. Подклассы: · трансаминазы; · киназы. Пример: фермент тирозинаминотрансфераза катализирует перенос аминогрупп. 3. Гидролазы – ферменты, катализирующие реакции гидролиза. Подклассы: · гликозидазы; · эстеразы; · пептидазы; · фосфотазы. Пример: лиаза катализирует гидролиз глицеридов до глиуерина и жирых кислот, а фермент амилаза - гидролиз крахмала. 4. Лиазы – ферменты, катализирующие процессы негдролитического расщепления связей С-С, C-O, C-N, C-S Подклассы: · декарбоксилазы; · альдолазы. Пример: пируват декарбоксилаза катализирует процесс отщепления молекулы оксида углерода от органических кислот. 5. Изомеразы ферменты, ускоряющие процессы изомеразы (внутримолекулярная перестройка). Подклассы: · рецемазы; · эпимеразы; · муазы. Пример: глюкозо-6-фосфат-изомераза осуществляет превращение глюкозо-6-фосфата в фруктозу-6-фосфат и наоборот. 6. Лигазы (синтетазы) - катализируют процессы соединения субстратов (образование связей С-О, С-S, C-N, C-C) Подкласс: · синтетазы Пример: аспартат-синтетаза катализирует превращение аспаргиново кислоты в аспаргин.
Номенклатура ферментов
Ферменты могут быть названы по систематической номенклатуре, либо используют их тривиальное названия, либо нумеруют согласно десятичной классификации. Например, фермент лактатдегидрогеназа (тривиальное название) может быть назван еще как L –лактат – NAD- оксидоредуктаза (систематическое название) или ЕС1.1.1.27 (ЕС-номер). Систематическое название фермента описывает катализируемую им реакцию. Чаще всего используют тривиальные названия, которые состоят из названия субстрата (вещество, на которое действует фермент), указания на тип катализируемой реакции и окончания – аза. Например: тирозинаминотрансфераза
субстракт перенос окончание аминогруппы
ЕС- собственный кодовый номер фермента, состоящий из частей, присваивается ферменту при нумерации по десятичной классификации. Каждый фермент имеет свой определенный номер, состоящий из четырех групп цифр, разделенных точками. Класс фермента-первая цифра в кодовом номере. Остальные номера предполагают указание номера более мелких единиц классификации (подкласса, подподкласса и собственно фермента). NAD(NADP) Пример: ЕС1.1.1.27 класс подкласс действующих lactate dehydrogenase оксидоредуктаз на СН-ОН группы (лактат дегидрогеназа) донора
Свойства ферментов Ферменты как биологические катализаторы ведет себя в химических реакциях подобно катализаторам небелковой природы: · не расходуются в процессе ферментации (катализа); · увеличивают скорость возможных реакций; · не смещают положение равновесия, а способствуют скорейшему его достижению. Особенности ферментов как катализаторов: · ферменты имеют большие значения Mr в отличие от небиологических катализаторов Mr (амилазы) = 50 000, а Mr (Pt) = 195; · скорость ферментативного катализа значительно превышает скорость небиологического катализа за счет значительного снижения Еакт; · в процессах, протекающих с участием ферментов, нет побочных продуктов; · ферментный катализ протекает в «мягких» условиях (низкие температуры (0-50°) и нормальное давление). Размер молекул. Будучи по своей природе белками, ферменты должны иметь большие значения молекулярной массы. Действительно, она может колебаться в пределах от 105 до 107, а это значит, что по своему размеру молекулы ферментов попадают в разряд коллоидных частиц. Селективность. Каждый фермент ускоряет только одну какую-либо реакцию или группу однотипных реакций. Эту их особенность называют селективностью (избирательностью) действия. Она позволяет организму быстро и точно выполнить четкую программу синтеза нужных ему соединений на основе молекул пищевых веществ или продуктов их превращения. Располагая богатым набором ферментов, клетка разлагает молекулы белков, жиров и углеводов до небольших фрагментов - мономеров и из них заново строит белковые и иные молекулы, которые будут точно соответствовать потребностям данного организма. Эффективность. Большинство ферментов обладают очень высокой эффективностью. Скорость некоторых ферментативных реакций может быть в 1015 раз больше скорости реакций, протекающих в их отсутствие. Такая эффективность ферментов объясняется тем, что их молекулы в процессе «работы» очень быстро восстанавливаются. Например, фермент каталаза за одну секунду при температуре, близкой к точке замерзания воды. Одна молекула этого вещества разлагает около 50 000 молекул пероксида водорода: 2H2O2 каталаза→ 2 H2O + O2 Этот катализатор снижает энергию активации от 75 кДж/моль до 21 кДж/моль. Зависимость от температуры. Многие ферменты обладают наибольшей эффективностью при температуре человеческого тела, т.е. приблизительно при 37°С. Человек погибает при более низких и более высоких температурах не столько из-за того, что его убила болезнь, а в первую очередь из-за того, что перестают действовать ферменты, а следовательно прекращаются обменные процессы, которые и определяют сам процесс жизни. Зависимость от среды раствора. Ферменты наиболее эффективно действуют на субстрат при строго определенной среде раствора, при определенны значениях так называемого рН. Величина рН характеризует кислотность и основность растворов и может принимать значение от 1 до 14.
рН 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 среда сильно- слабо- слабо- сильно- раствора кислая кислая щелочная щелочная
фермент желудочного сока пепсин наиболее активен при рН 1,5-2 (сильно кислая), каталаза крови – при рН7 (нейтральная) и т.д. (Приложение 5) Общие свойства гормонов Гормоны – биологически активные органические вещества, которые вырабатываются железами внутренней секреции и регулируют деятельность органов и тканей живого организма. Железы внутренней секреции (эндокринные) – железы, выделяющие продукты своей жизнедеятельности – гормоны – во внутреннюю среду организма (кровь, лимфа, тканевые жидкости). Гормоны выполняя столь и соответствующим набором характерных свойств, среди которых важнейшими являются: · чрезвычайно высокая физиологическая активность - очень малые количества гормонов вызывают весьма значительные изменения в работе органов и тканей; · дистанционное действие – способность регулировать работу органов, удаленных от желез, вырабатывающей гормон; это становится возможным, потому что гормоны – продукты желез внутренней секреции, достигаются к этим органам с током крови; · быстрое разрушение в тканях, так как, оказывая очень сильное влияние на работу органов и тканей, не должны накапливаться в них; · непрерывное продуцирование (секреция) соответствующей железой вызвано необходимостью постоянного регулирования, более или менее сильного воздействия на работу соответствующего органа в каждый момент времени.
Механизм действия гормонов
Гормоны оказывают влияние на клетки-мишени. Клетки-мишени - это клетки, которые специфически взаимодействуют с гормонами с помощью специальных белков-рецепторов. Эти белки-рецепторы располагаются на наружной мембране клетки, или в цитоплазме, или на ядерной мембране и на других органеллах клетки. Биохимические механизмы передачи сигнала от гормона в клетку-мишень. Любой белок-рецептор состоит, минимум из двух доменов (участков), которые обеспечивают выполнение двух функций: · узнавание гормона; · преобразование и передачу полученного сигнала в клетку. Каким образом белок-рецептор узнает ту молекулу гормона, с которой он может взаимодействовать? Один из доменов белка-рецептора имеет в своем составе участок, комплементарный какой-то части сигнальной молекулы. Процесс связывания рецептора с сигнальной молекулой похож на процесс образования фермент-субстратного комплекса и может, определяется величиной константы сродства. Большинство рецепторов изучены недостаточно, потому что их выделение и очистка очень сложные, а содержание каждого вида рецепторов в клетках очень низкое. Но известно, что гормоны взаимодействуют со своими рецепторами физико-химическим путем. Между молекулой гормона и рецептором формируются электростатические и гидрофобные взаимодействия. При связывании рецептора с гормоном происходят конформационные изменения белка-рецептора и комплекс сигнальной молекулы с белком-рецептором активируется. В активном состоянии он может вызывать специфические внутриклеточные реакции в ответ на принятый сигнал. Если нарушен синтез или способность белков-рецепторов связываться с сигнальными молекулами, возникают заболевания - эндокринные нарушения. Есть три типа таких заболеваний. 1. Связанные с недостаточностью синтеза белков-рецепторов. 2. Связанные с изменением структуры рецептора - генетические дефекты. 3. Связанные с блокированием белков-рецепторов антителами. Механизмы действия гормонов на клетки-мишени. Для получения клеточного ответа на гормональный сигнал в случае гидрофильных молекул действует внутриклеточный механизм передачи сигнала. Это происходит с участием веществ, которых называют вторыми посредниками. Молекулы гормонов очень разнообразны по форме, а "вторые посредники" - нет. Надежность передачи сигнала обеспечивает очень высокое сродство гормона к своему белку-рецептору. Гормоны являются основными гуморальными регуляторами физиологических функций организма, и в настоящее время хорошо известны их свойства, процессы биосинтеза и механизмы действия. Гормоны являются высокоспецифичными веществами по отношению к клеткам-мишеням и обладают очень высокой биологической активностью.
Классификация гормонов
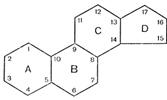
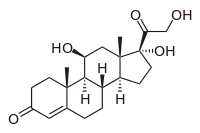
По химическому строению гормоны делят на 4 класса: · стероидные (стероиды); · гормоны – производные аминокислот; · пептидные; · белковые. 3.1. Стероидные гормоны (стероиды) - производные углеводорода стерана.
Стероиды можно разделить на две группы: стероидные половые гормоны и гормоны коры надпочечников. а) половые гормоны делятся: · эстрогены – женские половые гормоны, или стероиды, содержащие в молекуле 18 атомов углерода (С18- соединения).
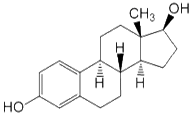
эстрадиол – С18Н24О2 прогестерон – С21Н30О2
Эстрадиол — основной и наиболее активный для человека женский половой гормон; эстроген. Вырабатывается фолликулярным аппаратом яичников у женщин. Небольшие количества эстрадиола вырабатываются также корой надпочечников у обоих полов и яичками у мужчин. У человека выделяют три типа эстрогенов: эстрадиол, эстриол и эстрон. Прогестерон — стероидный гормон желтого тела яичников и надпочечников. (Приложение 6) · андрогены – мужские половые гормоны, или С19-стероиды, в основе молекулы которых лежит скелет молекулы углеводорода сложного строения – андростана.
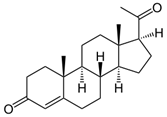
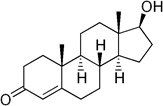
тестостерон- С19Н28О2 андростендиол Тестостеро́н — основной мужской половой гормон, андроген. Секретируется клетками Лейдига семенников у мужчин, а также в небольших количествах яичниками у женщин и корой надпочечников и у мужчин, и у женщин. Андростендион — основной андроген, секретируемый яичниками. Также в небольших количествах андростендион секретируется корой надпочечников у обоих полов и яичками у мужчин. (Приложение 6) б) гормоны коры надпочечников – вырабатываются корковым слоем надпочечников.
кортизол Кортизо́л — биологически активный глюкокортикоидный гормон стероидной природы, то есть в своей структуре имеет стерановое ядро. Кортизол секретируется наружным слоем (корой) надпочечников под воздействием адренокортикотропного гормона (АКТГ). Секреция АКТГ, в свою очередь, стимулируется соответствующим рилизинг-фактором гипоталамуса. Кортизол является регулятором углеводного обмена организма, а также принимает участие в развитии стрессовых реакций. (Приложение 7)
Пептидные гормоны К пептидным гормонам относится вазопрессин и окситоцин, вырабатываемые гипофизом – железой внутренней секреции.
вазопрессин окситоцин
Вазопресси́н, или антидиурети́ческий гормо́н (АДГ) — гормон гипоталамуса, который накапливается в задней доле гипофиза (в нейрогипофизе) и оттуда секретируется в кровь. Вазопрессин увеличивает реабсорбцию воды почкой, таким образом повышая концентрацию мочи и уменьшая её объём. Окситоцин — гормон гипоталамуса, который затем транспортируется в заднюю долю гипофиза, где накапливается (депонируется) и выделяется в кровь. (Приложение 8) Белковые гормоны К гормонам белкового характера относится инсулин – гормон, вырабатываемый поджелудочной железой. (Приложение 8)
инсулин
|
|||||||||||||||||||
|
Последнее изменение этой страницы: 2021-06-14; просмотров: 53; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.197.201 (0.242 с.) |
||||||||||||||||||||
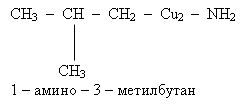
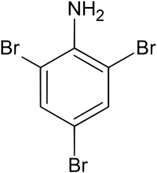 2,4,6-Триброманилин
2,4,6-Триброманилин 2Н5ОН + NН3 С2Н5-NН2 +Н2О
2Н5ОН + NН3 С2Н5-NН2 +Н2О (NH3CH2COOH)Cl
(NH3CH2COOH)Cl