Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
И микроэлементов в организме человека
Ферменты
1. История изучения ферментов. 2. Строение ферментов. 3. Классификация ферментов. 4. Номенклатура ферментов. 5. Свойства ферментов. 6. Значение и применение ферментов
История изучения ферментов
Ферменты или энзимы - это органические катализаторы белковой природы, которые ускоряют реакции, необходимые для функционирования живых организмов. Термин фермент предложен в XVII веке химиком ван Гельмонтом при обсуждении механизмов пищеварения. В кон. ХVIII — нач. XIX вв. уже было известно, что мясо переваривается желудочным соком, а крахмал превращается в сахар под действием слюны. Однако механизм этих явлений был неизвестен. В XIX в. Луи Пастер, изучая превращение углеводов в этиловый спирт под действием дрожжей, пришёл к выводу, что этот процесс (брожение) катализируется некой жизненной силой (ферментом), находящейся в дрожжевых клетках, причём он считал, что эти «силы» неотделимы от структуры живой клетки дрожжей. Эта точка зрения господствовала в науке в течение длительного времени и шла в разрез с господствовавшей тогда теорией брожения Ю. Либиха, согласно которой все процессы брожения представлялись чисто химическими явлениями каталитического характера, (будто бы спиртовое брожение происходит вследствие того, что молекулярные колебания разлагающихся частиц дрожжей передаются сахару и сахар начинает распадаться на спирт и углекислый газ). Таким образом, дрожжи вызывают брожение не при жизни, а только после своей смерти.. Различные точки зрения о природе спиртового брожения в теоретическом споре Л. Пастера с одной стороны, и механицистов М. Бертло и Ю. Либиха — с другой привели к разделению в научной среде двух соответствующих терминов. Собственно ферментами (от лат. fermentum — закваска) стали называть «организованные ферменты», то есть сами живые микроорганизмы. В противовес этому подходу в 1876 году В. Кюне предложил термин энзим (от греч. ἐν- — в- и ζύμη — дрожжи, закваска, то есть «в дрожжах») для обозначения «неорганизованных ферментов», секретируемых клетками, например, в желудок (пепсин) или кишечник (трипсин, амилаза). Через два года после смерти Л. Пастера в 1897 году Э. Бухнер опубликовал работу «Спиртовое брожение без дрожжевых клеток», в которой экспериментально показал, что бесклеточный дрожжевой сок осуществляет спиртовое брожение так же, как и неразрушенные дрожжевые клетки. В 1907 году за эту работу он был удостоен Нобелевской премии. Впервые высокоочищенный кристаллический фермент (уреаза) был выделен в 1926 году Дж. Самнером. В течение последующих 10 лет было выделено ещё несколько ферментов, и белковая природа ферментов была окончательно доказана.
Строение ферментов
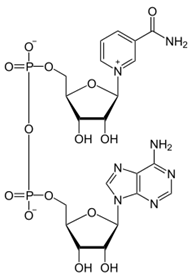
Ферменты представляют собой простые белки (протеины) глобулярного строения или являются протеидами – сложные ферменты, состоящие из белковой и небелковой частей (чаще всего). Сложный фермент – холофермент. Апофермент – белковая часть фермента. КФ - кофермент- небелковая часть фермента, сравнительно независимая от белковой части. ПГ – простетическая группа – прочно и постоянно связанная с белковой частью группа. Строение некоторых КФ и ПГ: · Кофермент NAD +:
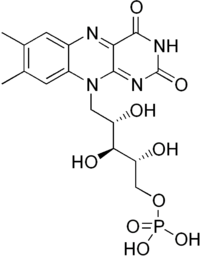
никотинамид-аденин-динуклеотид · Простетическая группа FMN:
FMN флавин-мононуклеотид(рибофлавин -5-фосфат) КФ или ПГ участвует в акте катализа, осуществляя контакт между энзимом и субстратом. АЦ- активный центр (имеет каталитическую и связывающую зоны) и представляет собой часть молекулы фермента, где происходит связывание и превращение субстрата. (Приложение 4) Классификация ферментов
В клетке исчисляется около 10 000 ферментов, которые катализируют около 2000 реакций. Известно 1800 ферментов, из них 150 выделены в кристаллическом виде. В основу классификации ферментов положена их способность катализировать реакции определенного типа. Выделяют 6 классов ферментов: 1. Оксидоредуктазы – ферменты, каталиирующие окислительно-восстрновительные реакции. Подклассы: · дегидрогеназы; · оксидазы; · редуктазы; · трансгидрогеназы; · гидроксилазы. Пример: алкогольдегидрогеназа катализирует окисление этанола в уксусный альдегид. 2. Трансферазы- ферменты, ускоряющие процессы переноса различных группировок атомов (метильной, аминной, карбоксильнойц…) с одной молекулы на другую. Подклассы: · трансаминазы;
· киназы. Пример: фермент тирозинаминотрансфераза катализирует перенос аминогрупп. 3. Гидролазы – ферменты, катализирующие реакции гидролиза. Подклассы: · гликозидазы; · эстеразы; · пептидазы; · фосфотазы. Пример: лиаза катализирует гидролиз глицеридов до глиуерина и жирых кислот, а фермент амилаза - гидролиз крахмала. 4. Лиазы – ферменты, катализирующие процессы негдролитического расщепления связей С-С, C-O, C-N, C-S Подклассы: · декарбоксилазы; · альдолазы. Пример: пируват декарбоксилаза катализирует процесс отщепления молекулы оксида углерода от органических кислот. 5. Изомеразы ферменты, ускоряющие процессы изомеразы (внутримолекулярная перестройка). Подклассы: · рецемазы; · эпимеразы; · муазы. Пример: глюкозо-6-фосфат-изомераза осуществляет превращение глюкозо-6-фосфата в фруктозу-6-фосфат и наоборот. 6. Лигазы (синтетазы) - катализируют процессы соединения субстратов (образование связей С-О, С-S, C-N, C-C) Подкласс: · синтетазы Пример: аспартат-синтетаза катализирует превращение аспаргиново кислоты в аспаргин.
Номенклатура ферментов
Ферменты могут быть названы по систематической номенклатуре, либо используют их тривиальное названия, либо нумеруют согласно десятичной классификации. Например, фермент лактатдегидрогеназа (тривиальное название) может быть назван еще как L –лактат – NAD- оксидоредуктаза (систематическое название) или ЕС1.1.1.27 (ЕС-номер). Систематическое название фермента описывает катализируемую им реакцию. Чаще всего используют тривиальные названия, которые состоят из названия субстрата (вещество, на которое действует фермент), указания на тип катализируемой реакции и окончания – аза. Например: тирозинаминотрансфераза
субстракт перенос окончание аминогруппы
ЕС- собственный кодовый номер фермента, состоящий из частей, присваивается ферменту при нумерации по десятичной классификации. Каждый фермент имеет свой определенный номер, состоящий из четырех групп цифр, разделенных точками. Класс фермента-первая цифра в кодовом номере. Остальные номера предполагают указание номера более мелких единиц классификации (подкласса, подподкласса и собственно фермента). NAD(NADP) Пример: ЕС1.1.1.27 класс подкласс действующих lactate dehydrogenase оксидоредуктаз на СН-ОН группы (лактат дегидрогеназа) донора
Свойства ферментов Ферменты как биологические катализаторы ведет себя в химических реакциях подобно катализаторам небелковой природы: · не расходуются в процессе ферментации (катализа); · увеличивают скорость возможных реакций; · не смещают положение равновесия, а способствуют скорейшему его достижению. Особенности ферментов как катализаторов: · ферменты имеют большие значения Mr в отличие от небиологических катализаторов Mr (амилазы) = 50 000, а Mr (Pt) = 195; · скорость ферментативного катализа значительно превышает скорость небиологического катализа за счет значительного снижения Еакт; · в процессах, протекающих с участием ферментов, нет побочных продуктов; · ферментный катализ протекает в «мягких» условиях (низкие температуры (0-50°) и нормальное давление). Размер молекул. Будучи по своей природе белками, ферменты должны иметь большие значения молекулярной массы. Действительно, она может колебаться в пределах от 105 до 107, а это значит, что по своему размеру молекулы ферментов попадают в разряд коллоидных частиц.
Селективность. Каждый фермент ускоряет только одну какую-либо реакцию или группу однотипных реакций. Эту их особенность называют селективностью (избирательностью) действия. Она позволяет организму быстро и точно выполнить четкую программу синтеза нужных ему соединений на основе молекул пищевых веществ или продуктов их превращения. Располагая богатым набором ферментов, клетка разлагает молекулы белков, жиров и углеводов до небольших фрагментов - мономеров и из них заново строит белковые и иные молекулы, которые будут точно соответствовать потребностям данного организма. Эффективность. Большинство ферментов обладают очень высокой эффективностью. Скорость некоторых ферментативных реакций может быть в 1015 раз больше скорости реакций, протекающих в их отсутствие. Такая эффективность ферментов объясняется тем, что их молекулы в процессе «работы» очень быстро восстанавливаются. Например, фермент каталаза за одну секунду при температуре, близкой к точке замерзания воды. Одна молекула этого вещества разлагает около 50 000 молекул пероксида водорода: 2H2O2 каталаза→ 2 H2O + O2 Этот катализатор снижает энергию активации от 75 кДж/моль до 21 кДж/моль. Зависимость от температуры. Многие ферменты обладают наибольшей эффективностью при температуре человеческого тела, т.е. приблизительно при 37°С. Человек погибает при более низких и более высоких температурах не столько из-за того, что его убила болезнь, а в первую очередь из-за того, что перестают действовать ферменты, а следовательно прекращаются обменные процессы, которые и определяют сам процесс жизни. Зависимость от среды раствора. Ферменты наиболее эффективно действуют на субстрат при строго определенной среде раствора, при определенны значениях так называемого рН. Величина рН характеризует кислотность и основность растворов и может принимать значение от 1 до 14.
рН 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 среда сильно- слабо- слабо- сильно- раствора кислая кислая щелочная щелочная
фермент желудочного сока пепсин наиболее активен при рН 1,5-2 (сильно кислая), каталаза крови – при рН7 (нейтральная) и т.д. (Приложение 5)
|
|||||||
|
Последнее изменение этой страницы: 2021-06-14; просмотров: 80; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.58.60.192 (0.017 с.) |