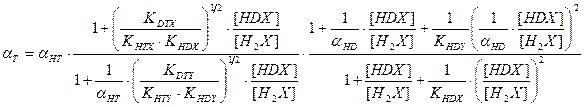Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Связь между коэффициентами разделения для бинарных изотопных смесей
В настоящее время все более значимой становится задача детритизациитритий содержащих отходов, в большом количестве накопившихся во многих странах мира в результате эксплуатации различных ядерных объектов. Для решения этой задачи применяются те же химобменные системы, которые используются для получения тяжелой воды или детритизации тяжелой воды – замедлителя в тяжеловодных ядерных реакторах. Как правило, значения коэффициентов разделения в используемых системах для изотопных смесей протий – дейтерий и дейтерий – тритий известны. В настоящем разделе приводятся расчетные уравнения, позволяющие определить коэффициент разделения для смеси протий – тритий по известным значениям для смесей протий – дейтерий и дейтерий – тритий. Наиболее простая связь коэффициентов разделения для бинарных изотопных смесей справедлива только для случая изотопного обмена между полностью замещенными формами изотопологов mAnX + nBmY ↔ mBnX + nAmY. Из всего изложенного выше следует, что при протекании реакции ГМИО хотя бы в одном из обменивающихся веществ такая реакция на практике невозможна, так как в ней, в зависимости от концентрации тяжелого изотопа, ступенчато протекают реакции между всеми изотопологами веществ с разным замещением по тяжелому изотопу. Заметим, однако, что соотношение между концентрациями всех изотопологов вещества (х i) связано через константу равновесия соответствующей реакции ГМИО и концентрации полностью замещенных форм (x 0 и xn): Использование этого соотношения позволяет получить выражение для связи коэффициентов разделения в бинарных изотопных смесях, которые для наиболее значимых с практической точки зрения химобменных систем представлены ниже: - для изотопного обмена в системе вода – водород - для изотопного обмена в системе вода – сероводород - для изотопного обмена в системе аммиак – водород
-для изотопного обмена в системе водород – гидрид палладия 7.3. Распределения трития между равновесными фазами в трехизотопных смесях протий – дейтерий – тритий Выше было отмечено, что понятие коэффициента разделения введено для случая разделения бинарной смеси изотопов. Однако на практике часто приходится сталкиваться с необходимостью удаления трития из изотопной смеси, содержащей все три изотопа водорода. При этом в задачах детритизации с использованием химобменных систем с участием воды, сероводорода, аммиака их возможности с точки зрения максимальной концентрации трития в рабочих веществах ограничены вероятностью протекания процесса саморадиолиза вещества. Практически рекомендуемая максимальная концентрация трития в этих системах соответствует уровню 100 Kи/кг или 3,7.1012 Бк/кг. Такое содержание трития, с учетом величины его удельной активности (1г трития≡104 Ки или 3.7.1014 Бк), соответствует концентрации трития, выраженной в атомных долях, например, в воде, равной 3.10-5. Это означает, что содержание трития в этих рабочих веществах всегда находится на уровне микроконцентраций, а сумма концентраций протия и дейтерия в пределах точности определения остается равной.1. Учитывая, что понятие коэффициента разделения введено для двухкомпонентной смеси, в такой трехизотопной смеси для характеристики распределения трития в двухфазной системе используется понятие коэффициента распределения трития: где (1- xT)= xH + xD и (1- yT)= yH + yD. Для большинства практически значимых случаев Если молекулы обмениваются только одним атомом водорода, значение коэффициента распределения при любой концентрации дейтерия в смеси xD можно определить по правилу аддитивности: В общем случае выражение для коэффициента распределения более сложное. Приведем его без вывода для молекул, содержащих по два обменивающихся атома:
(7.24) В табл. 5 в качестве примера приведены значения коэффициентов распределения трития в зависимости от концентрации дейтерия в трехизотопной смеси для химобменной системы вода-водород. Таблица 5 Зависимость a Т и a HD (a DH) от концентрации дейтерия в трехизотопной смеси для химобменной системы вода – водород при Т=328 К
Значения a HD (a DH), приведенные в таблице, рассчитаны по уравнению (7.15), описывающем концентрационную зависимость коэффициента разделения для бинарной изотопной смеси протий-дейтерий, а величины a Т – по уравнению (7.24). Видно, что значения коэффициента распределения трития существенно зависят от концентрации дейтерия в смеси, уменьшаясь при переходе от природной воды к тяжелой более чем в 3 раза. 8. Экспериментальные методы определения коэффициента разделения Коэффициент разделения для процессов разделения изотопов является фундаментальной величиной, от погрешности в определении которой зависят размеры разделительных установок, энергозатраты и, в конечном итоге, стоимость изотопной продукции. Выше уже отмечалось, что для всех изотопов легких элементов, кроме водорода, абсолютная величина коэффициента разделения мало отличается от 1. С другой стороны, уже при значении a =1,1 относительная ошибка в его определении в 2 % приведет в погрешности в определении размера разделительной установки не менее чем в 20 %, а при a =1,02 такая же относительная ошибка даст 100 % погрешность в размерах установки. Практика требует, чтобы значения a были известны, как правило, с погрешностью не более 1 %. Это, в свою очередь, требует особого внимания как к методике проведения самого эксперимента по его определению, так и выдвигает жесткие требования к точности изотопного анализа при определении изотопного состава обменивающихся веществ, причем, соответствие погрешности анализа требованию к точности определения a должно быть установлено до начала эксперимента. Методы изучения распределения изотопов в системах жидкость – пар, жидкость – газ, газ – твердое тело можно разбить на две группы: - методы, основанные на измерении однократных эффектов разделения, - методы, основанные на умножении однократного эффекта разделения. Вариантов этих методов известно большое количество. В настоящем пособии будут рассмотрены по два метода для каждой группы.
|
||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-06-14; просмотров: 71; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.200.211 (0.008 с.) |
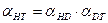 (7.16)
(7.16)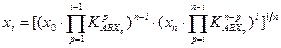 . (7.17)
. (7.17)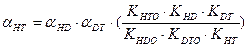 , (7.18)
, (7.18)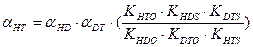 , (7.19)
, (7.19)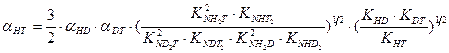 , (7.20)
, (7.20)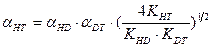 . (7.21)
. (7.21) 
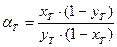 , (7.22)
, (7.22)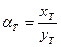 , так как xT ,, yT ® 0.
, так как xT ,, yT ® 0.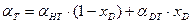 . (7.23)
. (7.23)