
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Коэффициент разделения при фазовом равновесии
3.1. Коэффициент разделения в системе жидкость – пар При выводе уравнения для расчета коэффициента разделения в системе жидкость – пар с использованием давления насыщенных паров индивидуальных изотопологов примем, что: - смесь изотопологов данного вещества является идеальной как в жидкой, так и паровой фазах, - реакции ГМИО в веществах, содержащих более одного атома изотопа, протекают быстро с константой равновесия, соответствующей равновероятностному распределению изотопов. Рассмотрим процесс AXж + BXп ↔ BXж + AXп, (3.1) протекающий при температуре Т. В соответствии с законом Дальтона парциальное давление изотополога BX в паровой фазе равно
т.е. значение коэффициента разделения равно отношению давления насыщенных паров изотопологов вещества при данной Т. Выражение для a в случае, если фазовое равновесие устанавливается для вещества с двумя атомами изотопа, рассмотрим на примере воды H2Oж + D2Oп ↔ D2Oж + H2Oп, (3.3) Ранее уже отмечалось, что реакция ГМИО (2.7) Н2О + D2O ↔ 2HDO в воде протекает быстро. Поэтому, в зависимости от концентрации дейтерия, изотопный обмен протекает по двум реакциям H2Oж+HDOп ↔ HDOж+H2Oп HDOж+D2Oп ↔ D2Oж+HDOп. По определению коэффициента разделения
Из условия идеальности изотопной смеси следует следующее соотношение:
Из уравнения равновесия для реакции ГМИО (2.7) следует, что
Для парциальных давлений H2O и D2O справедливы следующие уравнения: Выразив из уравнений (3.6 – 3.8) величины yHDO , yH 2 O , yD 2 O и подставив их в уравнение (3.4), получим после алгебраических преобразований:
При выводе уравнения типа (3.9) можно использовать и другой подход. Проиллюстрируем это на примере ФИО аммиака: NH3(ж)+ND3(п) ↔ ND3(ж)+NH3(п). (3.10) Эту реакцию можно представить в виде последовательных стадий и соответствующих им коэффициентов разделения: 1. NH3(ж)+NH2D(п) ↔ NH2D(ж)+NH3(п) - 2. NH2D(ж)+NHD2(п)↔ NHD2(ж)+NH2D(п) - 3. NHD2(ж)+ND3(п) ↔ ND3(ж)+NHD2(п) - При условии равновероятностного распределения изотопов по всем изотопологам аммиака a 11 = a 22 = a 33 = a 0 и, следовательно, для реакции (3.10) a 3 = a 11 . a 22 . a 33. Поставляя в это уравнение соответствующие выражения для a ii, получим
Таким образом, значения коэффициентов разделения для процесса ФИО в системе жидкость – пар можно получить, используя давления насыщенных паров индивидуальных изотопологов вещества при данной температуре. Кроме того, в пределах сделанных выше допущений, коэффициент разделения не зависит от области изотопных концентраций, при которых проводится процесс. А. М. Розен показал, что для большинства веществ и их изотопологов величина отклонения между расчетными и экспериментальными величинами a не превышает 1,5 отн.%. Исключения составляют изотопы самых легких элементов – водорода и гелия, равновесие жидкость-пар для которых реализуется при низких температурах (температура кипения водорода при давлении 0,1 МПа составляет 20,2 К, гелия – 4,1 К) В этих условиях ни жидкая, ни паровая фаза не являются идеальными. Кроме того, для реакции ГМИО водорода наблюдается максимальное отличие константы равновесия реакции от равновероятностного значения. Однако даже для водорода при нормальной температуре кипения экспериментальные значения коэффициента разделения при изменении концентрации дейтерия от 0 до 100 ат.% изменяются не более чем на 6 отн.% (от 2,67 до 2.53).
|
||||||
|
Последнее изменение этой страницы: 2021-06-14; просмотров: 94; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.174.156 (0.008 с.) |
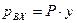 , а законом Рауля
, а законом Рауля 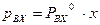 (P – общее давление в паровой фазе,
(P – общее давление в паровой фазе, 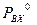 – давление насыщенных паров при данной Т). Аналогично для изотополога АХ:
– давление насыщенных паров при данной Т). Аналогично для изотополога АХ: 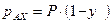 и
и 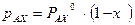 . Из приведенных уравнений следует, что
. Из приведенных уравнений следует, что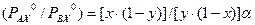 , (3.2)
, (3.2)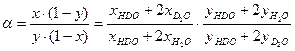 . (3.4)
. (3.4)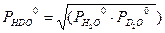 . Далее, с использованием уравнений Дальтона и Рауля, получим:
. Далее, с использованием уравнений Дальтона и Рауля, получим: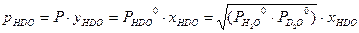 . (3.5)
. (3.5)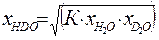 . Ниже будет показано, что константа равновесия реакции (2.7) при равновероятностном распределении изотопов равна 4. Таким образом:
. Ниже будет показано, что константа равновесия реакции (2.7) при равновероятностном распределении изотопов равна 4. Таким образом: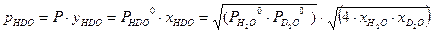 . (3.6)
. (3.6) 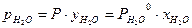 и (3.7)
и (3.7)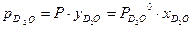 . (3.8)
. (3.8)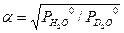 . (3.9)
. (3.9)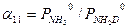 (3.11)
(3.11)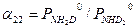 (3.12)
(3.12) (3.13)
(3.13)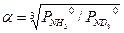 . (3.14)
. (3.14)


