
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Коэффициент разделения реакций ХИО в гетерогенных системах
Выше уже отмечалось, что квантово-статистический метод расчета коэффициентов разделения в реакциях ХИО применим в случаях, когда реагирующие вещества находятся в одной (газовой или парогазовой) фазе. Реальные процессы разделения методом ХИО всегда протекают с участием реагирующих веществ, находящихся в различных фазах. Такие реакции сопровождаются равновесными процессами межфазного переноса вещества (растворение газов в жидкости, испарение жидкости, адсорбция и абсорбция), которые в свою очередь сопровождаются изотопными эффектами. В этом разделе рассматриваются различные варианты определения коэффициента разделения при протекании реакции химического изотопного обмена в двухфазных системах. Рассмотрим, например, реакцию: H2Oж + НDг ↔ HDOж + Н2,г. (6.1) Заметим, что эта реакция является каталитической, так как водород в отсутствии катализатора, обладая большой энергией связи, практически не способен к изотопному обмену с водой. Катализаторы этой реакции, в свою очередь, могут быть различными: находящимися в парогазовой фазе гетерогенными, на которых реакция ХИО протекает между парами воды и водородом, и гомогенными (растворенными в воде) или распределенными в жидкой фазе в виде суспензии, на которых реакция протекает между водой и растворенным в ней водородом. Если при этом известен коэффициент разделения реакции ХИО между парами воды и водородом (a пг), то в первом случае коэффициент разделения для двухфазной системы определяется следующим уравнением:
где a ф – коэффициент разделения реакции ФИО H2Oж + НDОп ↔ HDOж + Н2Оп (6.3) при температуре, при которой протекает реакция ХИО. Таким образом, множитель a ф позволяет учесть изотопный эффект при испарении – конденсации воды. В случае, если реакция ХИО протекает в жидкой фазе, при расчете a жг необходимо дополнительно учитывать изотопный эффект при растворении водорода в воде (растворимость тяжелых изотопологов водорода в воде меньше, чем легких). В этом случае уравнение для расчета a жг будет следующим:
где a р – изотопный эффект при растворении водорода. Заметим, что все изотопные эффекты, учтенные уравнением (6.4), являются независимыми друг от друга. Например, изотопные эффекты при растворении водорода в воде или при испарении – конденсации воды имеют место независимо от того, присутствует ли в данной системе катализатор или нет, иными словами, протекает реакция ХИО или нет. В последнем случае, однако, суммарный изотопный эффект будет определяться только величиной дроби в уравнении (6.4), так как при этом величина Для учета параллельно протекающих процессов в двухфазных химобменных системах жидкость – газ вводится понятие эффективного коэффициента разделения
Для области малых концентраций целевого изотопа: где Очевидно, что где х и y – концентрации изотопа в жидкости и газе, хф – концентрация изотопа в парах жидкости, yp – концентрация изотопа в растворенном газе. Учитывая, что
Полученное общее выражение (6.7) для частных случаев, когда можно пренебречь либо растворимостью газа в жидкости, либо его влажностью, упрощается. В частности, для изотопного обмена водорода с водой вследствие малой растворимости водорода в воде при давлении, меньше 0,3 – 0,5 МПа, выражение для эффективного коэффициента разделения будет следующим:
В качестве примера можно рассмотреть другой частный случай, когда в химобменной системе протекают две параллельные реакции изотопного обмена. При разделении изотопов азота может использоваться изотопный обмен между аммиаком в газовой фазе и раствором соли аммония, например, в воде:
(147NH4+)p-p + 157NH3,г ↔ (157NH4+)p-p + 147NH3,г, Параллельно в системе протекает другая реакция: 147NH3,p-p + 157NH3,г ↔ 157NH3,p-p + 147NH3,г,, Обе эти реакции являются независимыми, и величина эффективного коэффициента разделения является аддитивной, зависящей от соотношения концентраций аммиака и ионов аммония в жидкой фазе. Обозначив для рассматриваемого случая через s отношение молей NH3 в жидкой фазе к числу молей соли аммония, получим:
|
||||||
|
Последнее изменение этой страницы: 2021-06-14; просмотров: 66; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.1.232 (0.006 с.) |
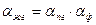 , (6.2)
, (6.2)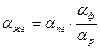 , (6.4)
, (6.4) пг =1.
пг =1. , который учитывает взаимный захват фаз. При этом вводится два дополнительных параметра – растворимость газа в жидкости s [моль газа/моль жидкости] и влажность газа h [моль пара/моль газа]. С учетом введенных обозначений, получим:
, который учитывает взаимный захват фаз. При этом вводится два дополнительных параметра – растворимость газа в жидкости s [моль газа/моль жидкости] и влажность газа h [моль пара/моль газа]. С учетом введенных обозначений, получим: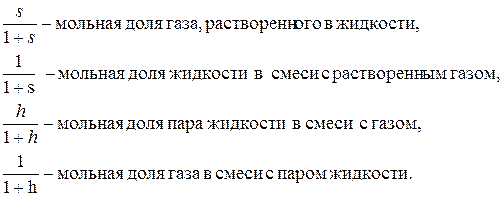
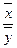 , (6.5)
, (6.5)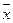 и
и 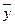 – эффективные концентрации целевого изотопа в жидкой и паро – газовой фазах.
– эффективные концентрации целевого изотопа в жидкой и паро – газовой фазах.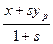 и
и 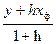 , (6.6)
, (6.6)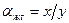 ,
, 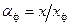 и
и 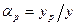 , в соответствии с уравнениями (6.6) получим следующее выражение для эффективного коэффициента разделения:
, в соответствии с уравнениями (6.6) получим следующее выражение для эффективного коэффициента разделения: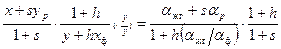 . (6.7)
. (6.7)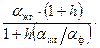 (6.8)
(6.8)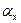 (6.9)
(6.9) 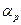 . (6.10)
. (6.10)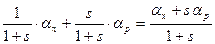 . (6.11)
. (6.11)


