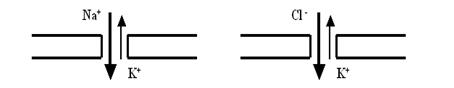Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Постсинаптические потенциалы ⇐ ПредыдущаяСтр 5 из 5
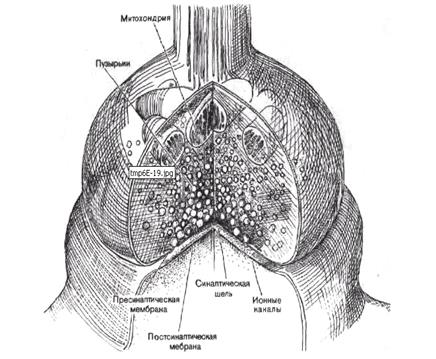
Подробное описание строения синапса и его свойств будет предметом следующей книжки. Надеюсь, в общих чертах это Вам знакомо (рис. 43).
Рис. 43. Реконструкция синапса, на которой представлены его основные компоненты. Сейчас же хотелось бы вкратце напомнить, что под синапсом понимают щелевой контакт между нейроном и другими возбудимыми клетками (не только нервной, но и мышечной или эндокринной), в котором происходит передача и переработка (!!!) информации (рис. 44). Пока мы не будем касаться особенностей работы электрических синапсов. Если бы мы были разумными ракообразными, это была бы наиважнейшая тема, но для нас, млекопитающих, гораздо важнее синапсы химические, потому что именно они формируют сложнейший информационный аппарат нашего мозга.
Рис. 44. Среди нескольких вариантов межнейрональных синапсов (аксо-аксональ-ные, аксо-дендритные, дендро-аксональные и т. д.) мы для анализа выбрали аксо-соматический синапс. Причём на этой нашей схеме магистральный синапс (по горизонтали) «отягощён» ещё двумя подобными ему. Будем считать, что сотни остальных остались где-то за плоскостью картинки. Обратите внимание на важную деталь: характеры импульсации в левом (передающем) нейроне и в правом (принимающем) существенно различны. То, что было недопустимым на уровне нервного волокна (изменение импульсного сигнала), становится чуть ли не обязательным для синаптической передачи.
Напоминаем, что на каждом из 1011 — 1012 нейронов, составляющих нашу нервную систему, в среднем сходится около 1000 синапсов. Каждый синапс — весьма сложно организованный аппарат, в котором имеется масса процессов и механизмов, большинство из которых просто бесполезно для простой передачи сигнала. Вся история научного поиска учит, что природа до чрезвычайности ленива и никогда не будет создавать сложную систему там, где можно было бы обойтись простой. Это просто невыгодно, и эволюция с лёгкостью вымывает, элиминирует все «архитектурные излишества». Стало быть, очень усложнённая структура синапса призвана обслуживать и очень сложную функцию, а это никак не передача сигнала (вот уж для чего электрические синапсы оптимальны!), а именно его обработка. Вот давайте и попробуем для начала проанализировать, какие особенности электрических процессов в химическом синапсе позволяют нейронам перерабатывать, а не просто пересылать информацию. Как работает химический синапс?
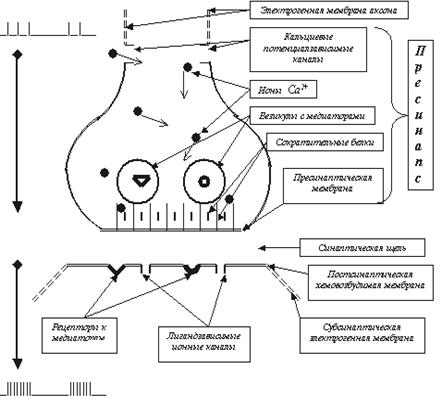
Для начала вспомним, как он устроен (рис. 45).
Рис. 45. Крайне упрощённая схема синапса, в которой из реального межнейронного контакта остались только принципиально значимые для обсуждения элементы.
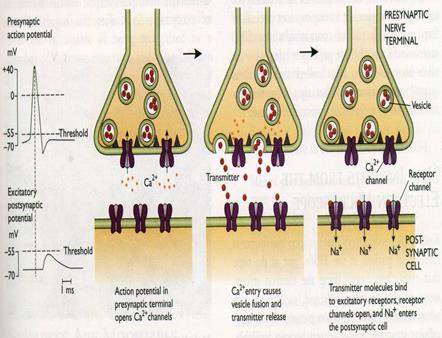
Если на первых этапах не вдаваться в особо тонкие детали, то главными элементами химического синапса являются: пресинаптическое окончание (пресинапс), на электрогенной мембране которого имеются потенциалзависимые кальциевые каналы (там есть и другие каналы, но пока в эти подробности вдаваться не будем), а внутри пресинапса расположены мембранные везикулы (пузырьки) с молекулами медиаторов. Непосредственно к обращённой в синаптическую щель пресинаптической мембране примыкают сократительные белки (SNARE-белки). отметим, что в каждом пресинапсе может присутствовать до 10000 везикул, в каждой из которых может быть до 10000 молекул разных (это принципиально важно!) медиаторов; синаптическая щель, разделяющая передающий и принимающий информацию нейроны. Ширина этой щели около 40 нм (для сравнения: толщина клеточной мембраны около 20 нм); постсинаптическая мембрана, на которой расположены рецепторные белки, способные с высоким сродством связываться с медиаторами и другими специфическими лигандами (например, ядами или лекарствами), и управляемые этими рецепторами лигандзависимые ионные каналы. Безусловно, эта схема сугубо примитивно характеризует чрезвычайно сложный в реальности синапс, но для описания базового алгоритма его работы она достаточна. А теперь сам короткий алгоритм (буквально по пунктам) передачи информации от нейрона к нейрону: По электрогенной мембране (например, аксона) ПД достигает пресинапса (тем, кто уже забыл, как распространяются нервные импульсы по электрогенной мембране, неплохо бы отлистать эту книжку на несколько страниц назад). Так как механизм распространения ПД включает в себя деполяризацию мембраны, то и мембрана пресинапса тоже деполяризуется.
В результате этой деполяризации активируются потенциалзависимые кальциевые каналы. В этом смысле они очень напоминают уже знакомые нам потенциалзависимые каналы, пропускающие по концентрационному градиенту ионы натрия и калия при генерации ПД. Ионы кальция по градиенту концентрации проникают в пресинапс. Вообще о кальции стоит поговорить подробнее: это чрезвычайно «популярный» в биологических системах катион. Он абсолютно необходим и для прочности костей (без кальция их хоть узлом завязывай!), и для мышечных сокращений, и для системы свёртывания крови, и для иммунной системы, и для работы сердца, и т. д. Вот и синапс без ионов кальция работать не будет. Кальций вызывает активацию сократительных белков пресинапса, и они дружно, синхронно притягивают везикулы с медиаторами к пресинаптической мембране, обращённой в синаптическую щель. И снова есть необходимость в уточнениях. Дело в том, что сократительные белки пресинапса (так называемые SNARE-белки) и по химическим свойствам, и по механизмам функционирования чрезвычайно похожи на сократительные белки нашей поперечно-полосатой мускулатуры. Поэтому имеет смысл чуть более детально остановиться на том, как работают наши скелетные мышцы (рис. 46). Главными рабочими элементами каждого мышечного волокна являются фибриллярные (нитчатые) белки: актин и миозин. Миозин значительно крупнее и тяжелее, чем актин. Эти белки расположены в мышечном волокне квазипараллельно, подобно зубцам двух расчёсок, направленных навстречу друг другу. Уникальной особенностью актина и миозина является их способность динамически взаимодействовать друг с другом путём образования временных химических «мостиков».

Рис. 46. Схематическое изображение процесса сокращения мышечного волокна. А — локальный участок (фрагмент саркомера) мышечного волокна в покое: между квазипараллельными фибриллярными молекулами сократительных белков актина и миозина расположен блокирующий белок тропомиозин, препятствующий взаимодействию этих белков. В — деполяризующие мембрану мышечного волокна (в том числе и мембрану поперечных трубочек) потенциалы действия опосредованно активируют (пока ещё не совсем ясно, как именно, хотя гипотезы есть вполне красивые) кальциевые каналы терминальных цистерн продольных трубочек, и ионы Ca2+ по градиенту концентрации выходят из продольных трубочек в область сократительных белков; в результате тропонин (белок-сателлит тропомиозина) связывается с ионами Ca2+, снимая тропомиозиновый блок; между освобождёнными нитями актина и миозина возникает динамическое взаимодействие: формируются временные мостики, перемещающиеся вдоль нитей (подобно рукам участников двух команд, перетягивающих канат) и обеспечивающие скольжение нитей актина и миозина навстречу друг другу. Если внимательно приглядеться, можно увидеть, что на схеме В Z-пластинки расположены ближе друг к другу, чем на рис. А, то есть саркомер укоротился (мышца сократилась). Кстати, наши мышцы могут укорачиваться на 50% своей длины. Эти мостики пробрасываются от миозина к актину, быстро меняют угол своего прикрепления (белки «подтягиваются» за них навстречу друг другу), отсоединяются, перемещаются вперёд, снова подтягиваются и т. д. В результате нити сократительных белков начинают скользить друг навстречу другу, и мышца сокращается. Естественно, что этот механизм «скользящих нитей» весьма энергозатратен, — ведь мы хорошо знакомы с усталостью после физической работы. В детали этих энергетических процессов мы вдаваться не будем — они выходят за рамки данного раздела.
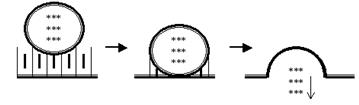
Гораздо важнее для нас, почему же это происходит не всегда, а только «по приказу» от мотонейрона? Дело в том, что в покое нити актина и миозина разобщены блокирующим белком тропомиозином и их взаимодействие невозможно. Для снятия этого блока нужно, чтобы тропомиозин изменил свою конформацию, а это, в свою очередь, достигается при взаимодействии ещё одного белка — тропонина (белка-саттелита тропомиозина) с ионами Ca2+. Тропонин — типичный представитель довольно обширного семейства кальцийсвязывающих белков (ещё один яркий пример такого белка — кальмодулин, играющий роль второго посредника, то есть внутриклеточного переносчика информации. Наберитесь терпения — об этом поговорим чуть позже). И вот отсюда становится понятной роль кальция: высвободившись в результате деполяризующего действия ПД из терминальных цистерн продольных трубочек (вполне тривиальные для клетки мембранные структуры — вспомним комплекс Гольджи, эндоплазматический ретикулум и т. п.), он диффундирует к сократительным белкам, связывается с тропонином и таким образом снимает блокировку с акто-миозинового взаимодействия. Значит, активация сократительных белков происходит не случайно, не спонтанно, а исключительно под влиянием ПД, то есть управляемо. А теперь вернёмся к пресинапсу. Аналогия между SNARE — белками и сократительными белками мышечного волокна — пусть и не абсолютно точная, но вполне допустимая. И кальций здесь отрабатывает ту же роль. Только задача в пресинапсе другая: не обеспечить сокращение нейрона (ещё не хватало, чтобы «шевеление мозгами» происходило буквально!), а добиться одновременного, сугубо синхронизированного притягивания множества везикул с медиаторами к пресинаптической мембране. То есть опять же — процесс высвобождения медиаторов идёт не спонтанно, не хаотично (такое, впрочем, случается, в своё время мы поговорим о так называемых МПКП), а управляемо, в ответ на приход ПД в пресинапс. При взаимодействии пресинаптической мембраны с везикулярными мембранами везикулы лопаются, и молекулы медиаторов высвобождаются в синаптическую щель (экзоцитоз). Этот процесс тоже заслуживает особого комментария (рис. 47).
Рис. 47. Схема экзоцитоза. Везикулы, заполненные молекулами медиаторов, сталкиваются с пресинаптической мембраной и вскрываются в синаптическую щель. В результате множество (около 10000 в каждой везикуле) молекул медиаторов оказывается в узком (до 40 нм) щелевом пространстве между передающей и принимающей информацию клетками.
В принципе, слияние двух липидных мембран при их простом соприкосновении — процесс, термодинамически вполне естественный. Представьте себе две янтарные капельки жира в тарелке с горячим (!!) бульоном. Достаточно согнать их ложкой вместе, слегка ткнуть этой же ложкой вдоль получившейся восьмёрки, и на Ваших глазах из двух капель получится одна большая. Отработает гидрофобность жирнокислотных «хвостов» липидных молекул, категорически не желающих общаться с водной фазой. Однако наш мозг — всё же не бульон с капельками жира, поэтому процесс экзоцитоза посложнее, чем только что описанный. Сегодня открыта целая команда мембранных белков, принимающих в нём участие, да и ионы кальция нужны для активации не только SNARE-белков, но и самого экзоцитоза. К сожалению, эти интересные детали далеко выходят за рамки нашего курса. Высвободившиеся из везикул молекулы медиаторов диффундируют через синаптическую щель к постсинаптической мембране. Нужно заметить, что за один цикл (то есть в ответ на один ПД) из пресинапса одновременно высвободится содержимое примерно 10000 везикул, то есть около 100000000 молекул медиаторов. Молекулы медиаторов с высоким сродством («высокоаффинно») связываются со своими специфическими рецепторами и активируют их. И этот процесс заслуживает особого рассмотрения (рис. 48). Нам ещё предстоит серьёзный разговор о многочисленных медиаторах и других информонах. Однако сейчас имеет смысл приглядеться к самым важным проблемам лиганд-рецепторных взаимодействий. И прежде всего это принцип комплементарности, согласно которому медиаторы связываются сугубо со «своими» рецепторами (например, ацетилхолин — с холинорецептором, адреналин — с адренорецептором, и т. д.).
Рис. 48. Принцип комплементарного связывания медиаторов сугубо со «своими» рецепторами на первый взгляд прост и примитивен. «Ключ к замку», «рука к перчатке» — всем знакомы такие метафоры, описывающие этот принцип (например, антиген-антитело, фермент-субстрат и т. п.). Нужно всего лишь, чтобы две взаимодействующие молекулы зеркально, подобно пазлам, подходили друг к другу (пространственно, энергетически, ещё как-нибудь…). И, казалось бы, при современных возможностях физико-химических методов ничего не стоит доказать эту идею. Однако мы не имеем пока прямых доказательств и опираемся только или на математические модели, или на косвенные данные (например, результаты фармакологического анализа). Есть ещё и проблема чисто теоретического плана: в последние десятилетия открыто множество биологически активных веществ (в первую очередь, медиаторов), способных высокоспецифично связываться с белковыми сайтами мембраны, то есть рецепторами. Прогресс в этой области явно не собирается тормозиться, так что уже скоро счёт таких веществ (рецепторных лигандов) пойдёт на сотни, а то и на тысячи. Возникает резонное недоумение: сколько же генетической памяти надо потратить, чтобы закодировать этакую прорву специализированных рецепторных белков?! Нет у нас такого запаса ДНК — на все случаи жизни! Так что исследовать ещё и исследовать…
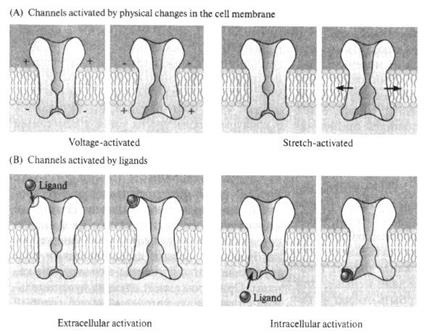
Механизмы таких лиганд-рецепторных взаимодействий достаточно неплохо изучены, но их детализация выходит за рамки этого издания. Второй важный момент заключается в том, что активация рецептора (то есть изменение его энергетики и конформации) происходит мгновенно, именно в тот миг, когда идет прямое химическое взаимодействие крохотной молекулы медиатора и громадного рецепторного белка. Активированные рецепторные белки, в свою очередь, активируют систему передаточных (G-) белков, которые одним из двух возможных способов (рис. 49, 50) открывают лигандзависимые ионные каналы постсинаптической мембраны.
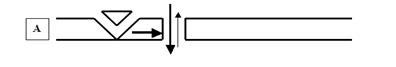
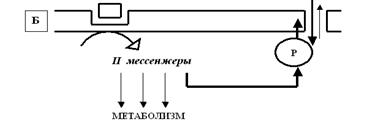
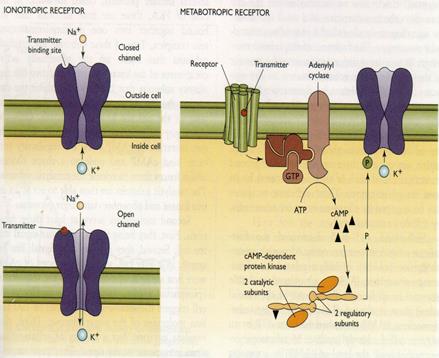
Рис. 49. На чрезвычайно упрощённой схеме представлены два принципиальных механизма активации лигандзависимых ионных каналов. А — «быстрый» способ, который реализуется при активации медиатором ионотропных рецепторов постсинаптической мембраны. Так как данные рецепторы являются, по существу, элементами ионного канала (напомню, что каналы — это надмолекулярные белковые комплексы, состоящие из нескольких субъединиц белка), процесс активации происходит практически мгновенно, без потерь времени. Б — «медленный» механизм, при котором активация рецептора запускает систему II мессенжеров (это внутриклеточные передатчики информации; речь о них пойдёт чуть позже), которые способны активировать различные метаболические каскады внутри клетки, в том числе процесс фосфорилирования (обозначено на схеме буквой Р) канальных белков. В результате лигандзависимые каналы переходят в активированное состояние и могут оставаться открытыми не несколько миллисекунд (как в «быстром» способе), а секунды, минуты и даже часы. Рецепторы, запускающие такой механизм, получили название метаботропных. Ещё раз подчеркну, что схема не учитывает очень многие детали процесса активации каналов (например, участие в нём G-белков и фосфолипидов мембраны) и иллюстрирует только главные этапы. Первый способ получил название «быстрого», при нём рецептор и канал — это, по сути, единый комплекс, и активация ионотропных рецепторов (способных только активировать ионные каналы) приводит к быстрому и непродолжительному открыванию ионных каналов постсинаптической мембраны. Второй способ — «медленный»: активированные медиаторами метаботропные рецепторы (способные влиять на обмен веществ — метаболизм — в клетке) запускают систему II мессенжеров, которые, в свою очередь, стимулируют цепочку биохимических реакций, приводящих в конечном итоге к фосфорилированию мембранных канальных белков; в результате ионные каналы открываются медленнее, но открытыми могут оставаться существенно дольше, чем в первом случае (секунду, минуты и даже часы). Есть необходимость сказать два слова о II мессенжерах. Когда в начале 60-х годов прошлого века Сазерленд открыл первый из вторых мессенжеров (именно «вторых», а не «вторичных», как по недомыслию закрепилось в нашей литературе) — циклический аденозинмонофосфат (цАМФ), это стало настоящим событием! К этому времени давно уже были открыты межклеточные химические коммуникаторы: гормоны (первый в истории гормон — секретин — был открыт Бейлиссом и Старлингом в далёком 1902 году) и медиаторы (здесь приоритет принадлежит Отто Леви, который в 1920 году доказал медиаторную функцию ацетилхолина, за что был удостоен Нобелевской премии).
Рис. 50. Более совершенная в художественном смысле реконструкция ионотропных и метаботропных рецепторов и управляемых ими каналов, показанных на рис. 49.
Открытие Сазерленда стало следующим шагом в понимании химических механизмов передачи информации в живых системах. За без малого полвека удалось обнаружить не так уж много II мессенжеров. Кроме цАМФ, это его «собрат» — ещё один циклический нуклеотид цГМФ (циклический гуанозинмонофосфат), кальцийсвязывающий белок кальмодулин, некоторые фосфолипиды мембраны (например, инозитол-3-фосфат, диацилглицерол) и, что стало научной сенсацией конца ХХ века, совсем уж простые молекулы типа оксида азота (NO). Несмотря на невеликое количество этих внутриклеточных посредников, их роль в работе клеток чрезвычайно значительна. В следующем издании я надеюсь познакомить Вас с этим более подробно, но уже сейчас возьмите на заметку, что чашка чаю или кофе бодрит именно потому, что кофеин стимулирует систему II мессенжеров. Однако продолжим путешествие по синапсу. Что за каналы открываются «по приказу» рецепторов? Это очень важно понять. так как на постсинаптической мембране ионные каналы принципиально отличаются от тех, которые мы рассматривали при анализе ПД, характер ионных токов, и соответственно потенциалов, будет очень существенно отличаться от тех, которые формируют нервные импульсы: а) во-первых, каналы постсинаптической мембраны являются лигандзависимыми, а не потенциалзависимыми, то есть эти каналы активируются исключительно «по команде» рецептора и принципиально неадекватно реагируют на изменения потенциала, поэтому цикл Ходжкина на них запустить невозможно; б) во-вторых, эти каналы значительно менее селективны, чем потенциалзависимые, поэтому через них возможны даже встречные потоки ионов. Например, на постсинаптической мембране различают Na+—K+-каналы и Cl-— K+-каналы (рис. 51, 52); в) в-третьих, длительность активированного состояния таких каналов значительно больше, чем у потенциалзависимых (для каналов, активированных ионотропными рецепторами, больше примерно в 5 раз, а для управляемых с метаботропных рецепторов — секунды, минуты и даже часы!).
Рис. 51. На постсинаптической мембране главную роль играют два типа лигандзависимых каналов: Na+—K+ и Cl–—K+. Они значительно менее селективны, чем потенциалзависимые (причём определяющими для изменения потенциала мембраны являются потоки ионов натрия и хлора, а не калия), и гораздо дольше остаются в открытом состоянии.
Рис. 52. Очень, на мой взгляд, выразительные схемы двух видов (и двух подвидов) ионных каналов, управляемых физическими (А) и химическими (В) стимулами. А — потенциалзависимые (слева) и механозависимые (справа) каналы; В — слева показан канал, активирующийся медиатором, справа — активирующийся через запуск системы II мессенжеров. Исходя из этих особенностей каналов постсинаптической мембраны, сами постсинаптические потенциалы (ПСП) также вопиюще не совпадают по своим свойствам с потенциалами действия (табл. 1): 1) ПСП не подчиняются закону «всё или ничего», так как на постсинаптической мембране нет субстрата для его воспроизведения — потенциалзависимых каналов. Поэтому ПСП относятся к электротоническим процессам и способны меняться градуально: чем больше ионных каналов активировалось, тем больше (по модулю) будет сам потенциал. 2) длительность ПСП всегда значительно больше, чем у ПД (минимум в 5 раз). 3) в отличие от ПД, ПСП могут быть как деполяризационными Таким образом, во-первых, мы видим, что уже по первым трём свойствам градуальные постсинаптические потенциалы принципиально отличаются от потенциалов действия. Во-вторых, самое время вспомнить, что при рассмотрении первых трёх свойств ПД мы обсуждали прежде всего условия его генерирования (напомню: стартовый стимул должен быть надпороговым по амплитуде и по длительности, а также катодическим). С учетом «задач» ПСП (обеспечить возникновение ПД на электрогенной мембране) особенности его свойств становятся всё более актуальными — не для имитации ли постсинаптических процессов существуют электростимуляторы, а? Подумайте об этом! Однако вернёмся пока к нашему алгоритму.
Таблица 1. Сравнительная характеристика потенциалов действия (ПД)
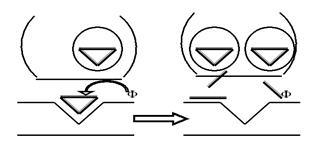
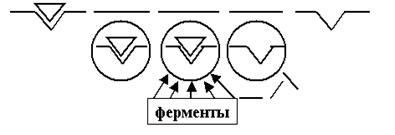
4) Как Вы, надеюсь, помните, потенциалы действия не суммируются на одном волокне (из-за наличия рефрактерности). Для ПСП таких запретов не существует: убедительно доказано, что постсинаптические потенциалы могут суммироваться, причём эта суммация может быть как пространственной, так и временной. Следовательно, к градуальности каждого ПСП добавляется ещё и возможность суммации множества потенциалов, возникших более-менее одновременно на нескольких соседних синапсах. Причём такая суммация может привести и к наращиванию ПСП (если суммируются ВПСП), так и к его вырождению (когда в процесс вмешиваются ещё и ТПСП). 5) Наконец, в отличие от ПД, постсинаптические потенциалы распространяются с угасанием, ведь на постсинаптической мембране нет субстрата для формирования цикла Ходжкина (и соответственно бездекрементного проведения) — потенциалзависимых ионных каналов. А вот теперь самое главное: мы можем попытаться понять, каким образом возникающие на постсинаптической мембране Na+, K+ и Cl– ионные токи формируют постсинаптические потенциалы, и как затем эти ВПСП/ТПСП, многократно суммируясь и неизбежно угасая, обеспечивают возникновение разного количества ПД на электрогенной мембране за пределами синапсов (прежде всего в аксональном холмике нейрона). По существу, можно повторить наше обсуждение механизмов генерации ПД, в ходе которого мы подавали начальный стимул с помощью электростимулятора. Напомню, что этот стимул должен быть надпороговой амплитуды (силы), надпороговой длительности и обязательно катодическим. Теперь представьте себе, что в результате суммации ВПСП и ТПСП у нас сформировался некий ПСП, отвечающий всем этим требованиям, то есть сумма ВПСП оказалась заведомо больше суммы ТПСП. Можем ли мы быть уверены в том, что теперь за возникновение ПД на электрогенной мембране принимающего нейрона можно не беспокоиться? Увы, нет. Потому что электротонический характер ПСП не даёт никаких гарантий по поводу того, будет ли достигший электрогенной субсинаптической мембраны суммарный постсинаптический потенциал надпороговым для генерации там ПД или угаснет до подпорогового уровня. 11. Казалось бы, вопрос о синаптической передаче информации исчерпан. Исходный набор нервных импульсов, пройдя через несколько перекодирований, преобразовался в конечный набор, как правило, отличающийся от исходного. И механизмы этих перекодирований более-менее понятны. Но есть ещё одна немаловажная деталь в алгоритме работы синапса. В 7-м пункте нашего обсуждения мы говорили о том, что медиаторы, высокоспецифично связываясь с мембранными рецепторами, активируют их. Сам процесс активации с энергетических позиций выглядит достаточно очевидным: конформация белковой молекулы (а рецептор, напомню, — белок) в большой мере зависит от её энергии, то есть при прочих равных условиях белок «выбирает» такую(-ие) конформацию (-ии), в которой его молекула обладает минимумом свободной энергии. При взаимодействии маленькой молекулы медиатора с огромной рецепторной молекулой энергетическое состояние белка-рецептора на короткий миг меняется, и соответственно меняется и его конформация. Этого мига достаточно, чтобы активировать дальнейшие процессы в мембране (вспомним G-белок!) и передать информацию по цепочке дальше. А что же медиатор? Ведь он свою роль уже исполнил? Что ж, «мавр сделал своё дело и мавр может уйти». Даже не может, а должен! Должен, потому что импульсы поступают в пресинапс один за другим, выделяются всё новые и новые порции медиаторов, а с чем эти молекулы будут связываться, если рецептор ещё занят? Чтобы такого не случилось, существует несколько молекулярных «дворников», которые должны быстро очистить рецептор от отработавшего медиатора. Трёх главных «блюстителей чистоты» Вы сейчас увидите. 1) Ферментативное расщепление медиатора (рис. 53). Взаимодействие медиатора с рецептором вызывает активацию фермента, как правило, связанного с постсинаптической мембраной. Фермент катализирует реакцию распада молекулы медиатора, и рецептор очищается. Так, например, происходит инактивация самого известного из медиаторов — ацетилхолина.
Рис. 53. Благодаря ферментативному катализу молекула медиатора распадается на отдельные компоненты непосредственно в синаптической щели. Компоненты утилизируются (в том числе могут пойти на синтез новых молекул медиаторов), а очищенный рецептор готов к приёму следующей порции медиатора.
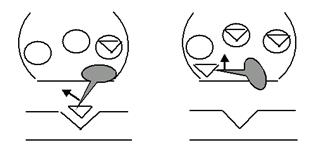
2) Обратный захват медиатора (рис. 54). После взаимодействия медиатора с рецептором запускается система белков-транспортеров, которые возвращают медиатор в пресинаптическое окончание (своего рода «безотходное производство»). 3) Интернализация рецептора. Этот сравнительно недавно открытый механизм очистки рецептора от отработавшего медиатора может лечь в основу объяснения одного из базовых механизмов наркотической толерантности/зависимости. Поэтому рассмотрим его более детально (рис. 55). Интернализация рецептора представляет собой очень быстрый (по некоторым данным, несколько микросекунд) процесс, реализующийся через несколько этапов: медиатор связывается с рецептором и активирует его; рецептор транслирует сигнал в клетку, а медиатор становится для него «обузой», от которой надо избавиться; рецептор вместе с медиатором и частью липидного бислоя «ныряет» в цитоплазму и замыкается в микровезикулу; на комплекс «медиатор-рецептор» набрасываются ферменты (учитывая, что интернализация характерна для рецепторов к медиаторам пептидной природы, это пептидазы) и расщепляют молекулу медиатора; освободившийся от медиатора рецептор «всплывает» на мембрану (сразу же или в ответ на новый синаптический сигнал) — он готов к новым информационным подвигам!
Рис. 54. Чрезвычайно упрощенная иллюстрация механизма обратного захвата медиаторов (например, моноаминов) или их отдельных фрагментов. Трудно представить, что, управляя этим процессом, можно вытащить человека из тяжёлой депрессии. Однако это факт…
Рис. 55. Упрощенная схема процесса интернализации рецептора. Показаны последовательные этапы: активированный медиатором рецептор, успев передать сигнал дальше, «тонет» под мембрану; в подмембранном пространстве медиатор подвергается ферментативному расщеплению, а освободившийся от него рецептор возвращается на мембрану. Нарушение этого процесса (на этапе ферментативного расщепления) при наркомании является одной из базовых причин толерантности/зависимости.
Маленькое заключение. Таким образом, мы вкратце рассмотрели базовый механизм передачи сигнала в химическом синапсе (рис. 56). По существу, мы убедились, что закодированная последовательностью нервных импульсов информация, как минимум, три раза меняет в процессе синаптической передачи свой материальный «субстрат»: а) первое преобразование происходит в пресинапсе, когда ПД провоцирует выделение медиаторов, и информация, образно выражаясь, переносится на химический носитель — медиатор; б) второе перекодирование — это формирование градуальных постсинаптических потенциалов вследствие активации медиаторами рецепторов и последующей активации ионных каналов постсинаптической мембраны; в) и третий шаг — генерация новой последовательности нервных импульсов в аксонном холмике под влиянием постсинаптических потенциалов всех активированных на текущий момент синапсов.
Рис. 56. Вы видите последовательность событий в чрезвычайно примитивном химическом синапсе, в котором присутствует только один вид медиатора. Активация постсинаптической мембраны происходит только через ионотропные рецепторы, а натриевый ток через каналы постсинаптической мембраны формирует исключительно ВПСП. В реальных синапсах всё, как правило, гораздо сложнее…
Вместо заключения Надеюсь, прочитанные Вами страницы хоть в некоторой степени позволили Вам представить себе, какие электрические процессы в нейронах обеспечивают передачу и переработку информации в нервной системе. Если так — значит, книжка писалась не зря! Напоминаю, что это пособие написано для тех, кто делает первые шаги к пониманию работы мозга (не так важно, кто это: физики, психологи, математики, биологи…). Поэтому и нарочито упрощённый язык, и ограниченный круг вопросов, которые здесь рассмотрены. Ведь даже просто история изучения «живого электричества», начавшаяся несколько веков назад с Л. Гальвани и А. Вольта, — это уже бесконечно увлекательная сага о великих находках, искренних заблуждениях и цистернах пролитого пота (и крови, между прочим, правда, в основном крови экспериментальных животных). Сегодняшний день электробиологии — это гимн точности измерений на самых разных уровнях, и прежде всего на микроуровне (очень модная сегодня приставка «нано-» — это ведь как раз про клеточную и молекулярную нейробиологию: здесь и нанометры, и нановольты, и наномоли). А там, где измерено, там в конечном итоге и понято! Однако рискну напомнить, что мозг — это не только электрическая, но и химическая «машина». Поэтому не советую расслабляться: следующее издание — про медиаторы, гормоны и другие информоны — уже на компьютере. Так что, ДО ВСТРЕЧИ!
Литература 1. Албертс, Б. Молекулярная биология клетки. В 3 т. / Б. Албертс, Д. Брей, Дж. Льюис, М. Рэфф, К. Робертс, Дж. Уотсон. — М.: Мир, 1994. 2. Ашмарин, И. П. Нейрохимия / И. П. Ашмарин. — М.: МГУ, 1996. 3. Блум, Ф. Мозг, разум, поведение /Ф. Блум, А. Лейзерсон, Л. Хофстедтер. — М.: Мир, 1988. 4. Буреш, Я. Методики и основные эксперименты по изучению мозга и поведения / Я. Буреш, О. Бурешова, Д. П. Хьюстон; пер. с англ.; под ред. А. С. Батуева. — М.: Высшая школа, 1991. 5. Катц, Б. Нерв, мышца, синапс / Б. Катц. — М.: Мир, 1968. 6. Катцунг, Б. Г. Базисная и клиническая фармакология/ Б. Г. Катцунг. — М.: Бином; СПб.: Невский диалект, 1998. 7. Коган, А. Б. Основы физиологии высшей нервной деятельности / А. Б. Коган. — М.: Высшая школа, 1988. 8. Костюк, П. Г. Кальций и клеточная проводимость / П. Г. Костюк. — М.: Наука, 1984. 9. Костюк, П. Г. Механизмы электрической возбудимости нервной клетки/ П. Г. Костюк, О. А. Крышталь. — М.: Наука, 1981. 10. Костюк, П. Г. Внутриклеточная сигнализация / П. Г. Костюк, М. А. Островский. — М.: Наука, 1988. 11. Крутецкая, З. И. Механизмы внутриклеточной сигнализации/З. И. Крутецкая, О. Е. Лебедев, Л. С. Курилова. — СПб.: Изд-во СПбГУ, 2003. 12. Куффлер, С. От нейрона к мозгу /С. Куффлер, Дж. Г. Николлс. — М.: Мир, 1979. 13. Кэндел, Э. Клеточные основы поведения/Э. Кэндел. — М.: Мир, 1980.
|
|||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-06-14; просмотров: 435; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.179.186 (0.115 с.) |