Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
П18 Парин Сергей БорисовичСтр 1 из 5Следующая ⇒
С. Б. Парин
ОСОБЕННОСТИ БИОЭЛЕКТРОГЕНЕЗА
Принципы Методическое пособие
Нижний Новгород Издательство ИПФ РАН 2009 УДК 573 ББК 28.707.3
Р е ц е н з е н т ы
К.В.Анохин, член-корреспондент РАН и РАМН, доктор медицинских наук, зав. лабораторией нейробиологии памяти Научно-исследовательского института нормальной физиологии им. П.К.Анохина РАМН; Д. Б. Гелашвили, доктор биологических наук, профессор, зав. кафедрой экологии биологического В. Г. Яхно, доктор физико-математических наук, зав. лабораторией автоволновых процессов ИПФ РАН.
П18 Парин Сергей Борисович Особенности биоэлектрогенеза. Принципы переработки информации в нервной системе: Методическое пособие. ― Нижний Новгород: Изд-во ИПФ РАН, 2009. ― 72 с. ISBN Данное методическое пособие обобщает тридцатилетний опыт чтения автором различных нейробиологических курсов студентам технических, биологических, медицинских и психологических специальностей. В максимально образной форме описаны базовые принципы передачи информации в нервной системе с помощью электрических сигналов. Предназначено для представителей физико-математических специальностей, а также психологов, биологов и медиков, изучающих введение в механизмы переработки информации в нервной системе и желающих разобраться в основах биоэлектрогенеза в нервных тканях, то есть начинающих свой путь в современной нейробиологии.
ISBN 978-5-8048-0068-1 © Институт прикладной физики РАН, 2008. © Парин С. Б., 2008. Введение
Книжка, которую Вы держите в руках, написана как своеобразный самоучитель для тех, кто хочет разобраться в основах биоэлектрогенеза в животных тканях (прежде всего, в нервной системе животных). Она не претендует на глубину анализа, у неё совсем другая задача: дать начинающим свой путь в нейробиологии физикам, химикам, психологам, медикам и (как это ни грустно) биологам стартовую площадку, базу для дальнейшего погружения. Думаю, Вы уже успели заметить, что учебная литература бывает двух типов. По первому типу написаны немногочисленные (в основном, увы, неотечественные) учебники, авторы которых просто и внятно описывают те сложные закономерности, в выявлении которых им посчастливилось участвовать самим. В таких книжках легко дышится и продуктивно думается. Второй тип представляют бесконечно переписываемые из издания в издание нагромождения фактов и гипотез, многие из которых по ходу дела возводятся в ранг фундаментальных теорий, каковыми ни в коей мере не являются. Эти книжки опасны для доверчивого читателя, потому что создают иллюзию всепознанности и становятся питательной средой для всяческого парарелигиозного мракобесия. «Учёные показали…» ― эта очень страшная фраза переселилась в многочисленные рекламные клипы именно из вполне наукообразной учебной литературы.
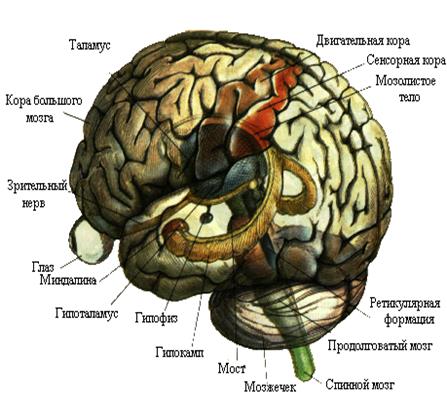
Нейробиологии в этом смысле, казалось бы, повезло. Есть прекрасные отечественные издания, написанные признанными в мире классиками «жанра»: это и многократно переиздававшиеся учебники П. Г. Костюка, и книжки П.К.Анохина, А. Б. Когана, В. В. Шульговского, Б. И. Ходорова, А. Д. Ноздрачёва, О. А. Крышталя и многих других, и известные нам благодаря переводам труды Э. Кэндела, К. Прибрама, Ф. Блума, В. Маунткастла, Д. Эдельмана, Г. Шеперда, Д. Экклза, С. Куффлера… Казалось бы, бери и читай! Замечательно, но есть одно «НО»: эти прекрасные книги рассчитаны на уже подготовленного читателя. Значит, есть такая задача – подготовить заинтересованного читателя (независимо от его первоначального образования) к их восприятию. Автор ни в коем случае не гарантирует абсолютной доказанности всех изложенных в пособии научных фактов (здесь найдётся место и гипотезам), однако обещает приложить все усилия, чтобы отделить то, что реально промерено, от того, что является результатом игр разума, пусть и очень красивых. И ещё: я постараюсь не пугать читателя страшными словами там, где можно обойтись простым человеческим языком. Мне хотелось, чтобы получился спокойный разговор с читателем. В конце концов мы ведь будем говорить о том, что смогли открыть, увидеть люди, пытаясь заглянуть в наш мозг (рис. 1). Неужели вместе мы не сможем это понять?
Завершая введение, хочу поблагодарить старшего научного сотрудника ИПФ РАН, доктора биологических наук Софью Александровну Полевую за помощь на всех этапах выполнения этой работы.
Рис. 1. Так выглядел бы наш мозг, если бы мы могли видеть его насквозь. Впрочем, современные томографические методы позволяют это проделывать (пусть и путём компьютерной реконструкции). Возбудимые клетки
Мир, в котором мы все живём, бескрайне многолик и изменчив. Его лица и изменения могут быть прямо обращены к нам, но могут существовать и независимо от нас. в любом случае, как только мы хоть краешком своего Я прикасаемся к этому миру, мы входим с ним во взаимодействие, и должны иметь устройства (аппараты, приборы, системы…), обеспечивающие эффективность этих взаимодействий. первым и главным из этих устройств является наша нервная система. Её задача — собирать информацию из внешнего мира, обрабатывать её и, сопоставив её с накопленным раньше опытом, принимать управленческие решения: как реагировать, и реагировать ли вообще. То есть наша нервная система — это информационная система со всеми её атрибутами. А раз так, должен быть язык, код, правила, по которым записывается информация. Вот мы и добрались до биоэлектрогенеза, до особенностей возникновения электрических процессов в живых системах. Подозрение о том, что базовым, первичным кодом в нервной системе (подобно двоичному коду любого компьютера, где 00, 01, 11 или 10 удивительным образом ухитряется вместить все помыслы писателя, поверяемые им машине) может быть импульсный код, то есть определённая последовательность нервных (по сути, электрических) импульсов, возникло не на пустом месте. Ещё в конце XVII века в ожесточённом споре двух великих физиков — Луиджи Гальвани и Александро Вольта — родилась первая истина на этом долгом пути: в теле животных (и человека, естественно) есть электрические потенциалы и электрический ток. Потребовалось два с лишним века, чтобы мы начали понимать, что именно эти биоэлектрические явления и дают возможность нервной системе работать с информацией, и ещё почти век, чтобы начать понимать, как это происходит. Давайте обсудим, что мы сегодня знаем об этом. Есть устойчивое мнение, что способностью к биоэлектрогенезу обладают только некоторые клетки животных, которые принято называть возбудимыми. Честно говоря, это не совсем правда! Сегодня уже хорошо известно, что электрический заряд на мембране имеют и клетки крови (например, эритроциты), и гепатоциты (то есть клетки печени), и половые клетки животных, и т.д. Более того, некоторые клетки растений тоже способны к генерации электрического заряда на своей поверхности, причём этот заряд меняется и распространяется, что позволяет биофизикам уже полвека говорить о наличии у растений нервной системы (тех, кто, в отличие от ботаников, наблюдал растения в реальной жизни, а не в гербарии, это едва ли удивит). Тем не менее, клетки нервной, эндокринной и мышечной систем традиционно относят к особой группе, называя их (и только их) возбудимыми. Почему же? Ответ начнём с формулирования очень важного в нейробиологии понятия возбудимости. Одно из наиболее точных определений звучит так: возбудимость — это способность некоторых клеток (нервных, мышечных, эндокринных) отвечать на действие стимула закономерными изменениями электрического потенциала своей мембраны. То есть при действии какого-то раздражителя (напомним, что стимул — это вообще-то острый прутик, которым арбакеша побуждает заупрямившегося ослика к началу движения, раздражающий фактор) на мембране этих клеток однотипно, принципиально сходным образом меняются характеристики заряда. А чтобы что-то менять, надо это иметь. Стало быть, возбудимые клетки изначально, ещё до нанесения стимула, обладают зарядом мембраны. Попробуем разобраться, откуда же он берётся и как и почему он может меняться.
Потенциал действия (ПД), или нервный импульс (спайк) Теперь, когда мы выяснили, что в покое мембрана нейрона уже заряжена (поляризована), пришла пора обратиться непосредственно к потенциалу действия (ПД). Представьте, что у регистрируемого нами нейрона закончился межимпульсный интервал и мы дождались импульса. Или, чтобы не ждать милостей от нейрона, мы через так называемые стимулирующие электроды (к замечательному прибору электростимулятору мы ещё вернёмся попозже) нанесли на поверхность этого нейрона слабенький (всего-то несколько милливольт) стимул. И вспомните Что же делать, если изучаемый нами объект так миниатюрен и по амплитуде (десятки милливольт), и по длительности (миллисекунды)? Ответ, вообще говоря, хорошо известен: чтобы увидеть инфузорию-туфельку, надо взять микроскоп. Нам даже и микроскопа не надо, чтобы увеличить наш ПД. Надо просто растянуть на экране компьютера ось времени (X) и ось амплитуды ПД (Y), и мы увидим нервный импульс во всех деталях (рис. 25).
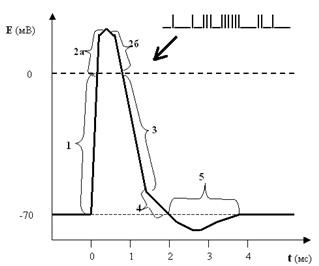
Рис. 25. Потенциал действия (ПД) мембраны нейрона или нервный импульс. Цифрами обозначены фазы ПД: 1 — деполяризация; 2а и 2б — реверсия или овершут; 3 — реполяризация; 4 — следовая деполяризация; 5 — следовая гиперполяризация.
Оказывается, ПД имеет достаточно сложную форму, и, двигаясь по оси времени, мы можем разложить его на 5 фаз:
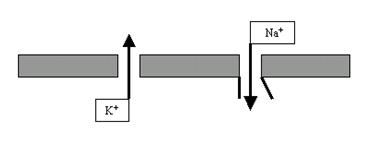
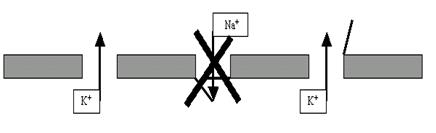
фаза деполяризации — от исходного уровня ПП до 0 (то есть мембрана в это мгновение электронейтральна); реверсия ПД или овершут — уровень ПД выше 0 (то есть в этот момент мембрана внутри становится заряженной положительно, а не отрицательно, как было в покое); фаза реполяризации — уровень мембранного потенциала демонстрирует явственное стремление вернуться к исходному уровню ПП; следовая деполяризация — спад графика ПД становится менее крутым, то есть к исходному уровню ПП потенциал мембраны возвращается несколько медленнее, чем во время реполяризации; следовая гиперполяризация — в этот короткий период времени мембрана поляризована даже больше, чем в состоянии покоя. Не стоит сразу пугаться этих новых терминов: они вполне доступны пониманию и весьма информативны. Мы теперь знаем, что в покое мембрана заряжена, или поляризована. Это и есть коренное слово. А дальше — работа с приставками: де- — приставка негативная, отрицательная; действительно, и в 1-й, и в 4-й фазах мембрана менее поляризована, чем в покое; ре- — возвратная приставка (ретро-), соответственно, в 3-й фазе мы видим возвращение ПД (вектор) к исходному уровню. Гипер- — слишком, чересчур; действительно, в 5-й фазе мембрана поляризована слишком сильно, больше, чем в покое. Наконец, обозначения 2-й фазы выходят за рамки этого правила, просто и реверсия, и овершут — это переворачивание чего-то, в нашем случае — мембранного потенциала. Но назвать ещё не значит объяснить. Давайте разбираться, почему мембрана нейрона в ответ на электрический стимул так прихотливо меняет свой заряд. И снова пойдём по стопам группы Ходжкина. Начнём с фазы деполяризации. Почему в ответ на внешний стимул поляризация мембраны начинает очень быстро уменьшаться? Оказывается, в это мгновение на мембране начинают активироваться потенциалзависимые натриевые каналы (рис. 26).
Рис. 26. В ответ на электрический стимул на мембране нейрона наряду с постоянно открытыми K+-порами открываются потенциалзависимые Na+-каналы, обеспечивающие входящий натриевый ток. В названии этих каналов — 2 ключевых слова: во-первых, они селективны по Na+; а во-вторых, они активируются только при вполне определённых изменениях электрического потенциала мембраны. И вот этот второй момент заставляет нас вернуться к понятиям «стимул» и «электростимулятор». Конечно, можно во время исследования спокойно ждать, когда на нейроне возникнет очередной нервный импульс, тем более что всегда молчащих нейронов по определению не бывает. Но гораздо удобнее, если мы будем точно знать, когда возникнет ПД, а для этого проще всего самим спровоцировать его возникновение. это можно сделать, нанеся на нейрон адекватный (соответствующий его свойствам) стимул. Раз речь идёт о потенциалзависимых каналах мембраны, то стимул должен быть электрическим. И сформировать этот стимул мы можем с помощью лабораторного электростимулятора
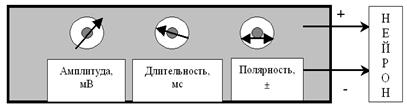
Рис. 27. Примитивный лабораторный электростимулятор позволяет регулировать амплитуду стимула (от 0 до нескольких десятков тысяч милливольт), его длительность (от долей миллисекунды до десятков секунд) и полярность (+ или –). Стимул представляет собой прямоугольный (П-образный) импульс постоянного тока.
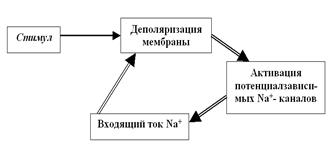
Хорошо известно, что электрические процессы в наших нейронах нужно имитировать не привычным для нас переменным током, а импульсами постоянного тока. Уже совсем скоро (при рассмотрении синапса) мы с Вами поймём, с чем это связано. Именно для имитации реально происходящих в нейронах процессов и были сконструированы первые электростимуляторы данного типа. Итак, мы возвращаемся к ПД. Что же происходит в нейроне сразу в ответ на стимул? Если мы подадим на мембрану слабый (всего несколько милливольт) прямоугольный катодический (то есть идущий от отрицательного полюса нашего стимулятора) стимул, возникнет начальная деполяризация мембраны. Этого незначительного сдвига мембранного потенциала в сторону 0 достаточно, чтобы активировалась первая порция потенциалзависимых Na+-каналов. Естественно, через них с существенно большей вероятностью, чем в покое, возникнет входящий Na+-ток. Катионы Na+, входя в клетку по градиенту концентрации, уменьшают электроотрицательность внутренней поверхности мембраны, то есть деполяризуют её ещё больше (рис. 28).
Рис. 28. Цикл Ходжкина, обеспечивающий восходящую фазу (фазу деполяризации) ПД. Обратите внимание: стимул нужен только на начальном этапе — для запуска цикла Ходжкина, а дальше процесс развивается самопроизвольно, по механизму положительной обратной связи. В результате возникает лавинообразно нарастающий входящий ток катионов Na+. Круг замкнулся, и теперь все будет повторяться и повторяться. Впервые этот механизм был описан всё той же группой Ходжкина и в мировой литературе получил наименование «цикл Ходжкина». По существу, это классический пример системы с положительной обратной связью. Здесь каждый предыдущий шаг подстёгивает следующий за ним, усиливая эффект. В биологических системах такого рода механизмы встречаются не слишком часто (в тех случаях, когда или требуется усилить эффект, или нужно синхронизировать изначально независимые процессы — например, при брачном поведении у животных). В технике системы с положительной обратной связью мы видим сплошь и рядом: это один из самых распространённых видов усилителей. Цикл Ходжкина поучителен, по крайней мере, по двум причинам. Во-первых, мы видим, как остроумно природа решила проблему быстрого усиления входящего тока Na+ и, соответственно, деполяризации мембраны. Не случайно во многих книжках процесс нарастания входящего натриевого тока называют лавинообразным. Во-вторых, становится более понятной роль начального стимула в запуске ПД. Это, по существу, аналог стартёра в современном автомобиле: маленький слабый электромоторчик, работающий от аккумулятора, может раскрутить тяжёлый на подъём двигатель внутреннего сгорания («завести» его), а дальше он будет работать вполне самостоятельно («самопроизвольно», как сказали бы мы). На стартёре, в принципе, тоже можно проехать несколько метров, но лучше этого не делать из гуманистических соображений. И на мембране нейрона стимул тоже нужен только «на старте» ПД, а дальше процесс поддерживает себя сам. Очень важный вопрос «а всякий ли стимул запустит ПД?» мы проанализируем немножко попозже. И ещё один вопрос, связанный с восходящей фазой ПД. Если цикл Ходжкина — самоусиливающийся процесс, то почему он не развивается бесконечно, что служит ограничителем входящего тока Na+? Ответов несколько. Прежде всего это уже обсуждавшееся нами уравнение Нернста, описывающее взаимосвязь электрического потенциала полупроницаемой мембраны и концентрационных градиентов. Естественно, что изменение градиента (одной из действующих сил) неизбежно ведёт и к изменениям потенциала (второй силы), и далее по циклу. Число потенциалзависимых каналов на данном участке мембраны хоть и велико, но не бесконечно. А если учесть, что только что активировавшийся канал не может сразу же открыться вторично (о причинах этого мы поговорим чуть позже), становится понятным наличие ограничений на циклические процессы на мембране. Есть и ещё несколько менее значимых факторов, обсуждение которых мы вынесем за скобки. Итак, вопрос о механизме деполяризации более или менее прояснился. Но ПД развивается дальше, и после пика реверсии, когда внутренняя поверхность мембраны становится положительно заряженной, наступает фаза реполяризации. Какие мембранные механизмы обеспечивают её развитие? Мы должны назвать, как минимум, три фактора: в результате инактивационных процессов закрываются Na+-каналы и прекращается (точнее, минимизируется) входящий натриевый ток; продолжается выходящий ток K+ через поры; развивается дополнительный выходящий ток K+ через потенциалзависимые калиевые каналы (рис. 29).
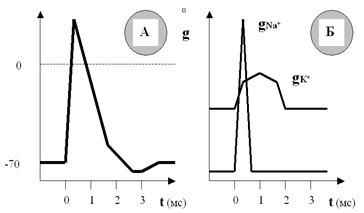
Рис. 29. Фаза реполяризации ПД обусловлена, как минимум, тремя факторами: а) прекращением входящего тока Na+; б) продолжением выхода K+ через поры;в) дополнительным выходящим током K+ через потенциалзависимые калиевые каналы. Думается, Вы почувствовали, что если два первых фактора вполне очевидны, то третий требует дополнительных разъяснений. В самом деле, что же это за «дополнительные» потенциалзависимые K+-каналы, которые активируются так своевременно? И этому открытию уже полвека. Действительно, мы же нигде не оговаривали, что эксклюзивным правом открываться в ответ на изменения потенциала мембраны обладают только Na+-каналы. Белковые субъединицы, образующие K+-каналы, тоже могут быть чувствительными к этим изменениям. Тогда, может быть, для их активации требуются какие-то другие, отличающиеся от необходимых для Na+-каналов параметры изменений потенциала мембраны? Да нет, диапазон примерно тот же. А раз так, значит, эти K+-каналы активируются в ответ на тот же начальный стимул, что и Na+? Ответ пугающе прост: да! Вдумайтесь в этот ответ! Если каналы для двух катионов (натрия и калия) открываются в ответ на сходные изменения потенциала мембраны, то есть на один и тот же стимул, а градиенты концентраций этих катионов направлены навстречу друг другу, то должен возникнуть встречный ток двух этих ионов, и об изменениях потенциала на мембране можно вообще забыть. Но эти изменения есть, иначе информация Вашим мозгом не могла бы обрабатываться, и Вы не могли бы читать эти строки. Где же нестыковка? Какие факторы не были учтены? Чтобы разобраться, нам придётся ввести одно из ключевых понятий мембранологии: проницаемость мембраны для ионов (g). Этот термин означает, сколько данных ионов (Na+, K+, Cl– и т.д.) пропустит единица площади данной мембраны (например, 1 квадратный нанометр) в единицу времени (например, в 1 миллисекунду). Когда мы упоминали уравнения Ходжкина — Хаксли, Катца и др., вскользь было сказано, что они являются развитием идеи Нернста; так вот, одним из элементов этого развития как раз и было введение в уравнения показателя проницаемости мембраны для данных конкретных ионов. Нам этот показатель сейчас нужен для того, чтобы разобраться в загадке «встречных перевозок» катионов через мембрану. Оказывается, хотя процесс активации ионных каналов Na+ и K+ и начинается одновременно (в ответ на стимул), скорость нарастания этой активации, и соответственно проницаемости, существенно различна для ионов Na+ и K+ (рис. 30). Скорость нарастания (а затем и спада) натриевой проницаемости намного выше, чем калиевой. Поэтому массированный вброс Na+ в первые мгновения ПД существенно опережает медленно нарастающий выход K+, даже несмотря на то, что калиевая проницаемость мембраны изначально больше (за счёт постоянно открытых калиевых пор). Соответственно, входящий и выходящий катионные токи разведены по времени, и вслед за деполяризацией развивается реполяризация мембраны.
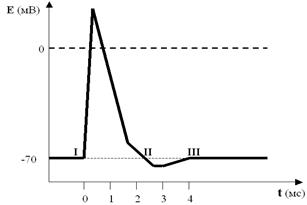
Рис. 30. В одном временном масштабе показаны ПД (А) и изменения проницаемости мембраны (Б) для ионов Na+ и K+. Хорошо видно, что проницаемость для Na+ резко возрастает в ответ на стимул и так же быстро падает почти до нуля. Проницаемость для K+ начинает возрастать одновременно с натриевой, но увеличивается и спадает гораздо медленнее. Кроме того, проницаемость мембраны для K+ уже изначально гораздо выше, чем для Na+, так как калиевые поры остаются открытыми всё время. По существу, с завершением фазы реполяризации завершаются и главные информационно значимые процессы на мембране. Далее, как Вы помните, развиваются следовые процессы, характер которых может различаться в разных возбудимых клетках (вплоть до перемены местами следовой деполяризации и гиперполяризации), и которые, видимо, «не считываются» нашим белковым компьютером напрямую. Но это не значит, что они не влияют на мозговые коды и соответственно на обработку информации. Сегодня существуют вполне биологоправдоподобные модели нейронных сетей, в которых главным изменяемым параметром является период следовой гиперполяризации. Эти виртуальные «мозги» вполне успешно справляются с весьма сложными задачами, что подтверждает небезразличность для информационных процессов следовых («остаточных», как может казаться) изменений поляризации. Однако эти тонкости выходят за пределы нашей книжки. Нам хотелось бы показать на примере следовых процессов значимость ещё одного транспортного механизма мембраны. Речь пойдёт об ионных насосах. Мы с Вами уже рассматривали общие принципы их работы, так что теперь можем обсудить только самое главное. Посмотрите ещё раз на рисунок ПД (рис. 31). Совершенно ясно, что к моменту завершения процесса реполяризации соотношения ионных градиентов по обе стороны мембраны явно не соответствуют «нормативным параметрам», характерным для ПП.
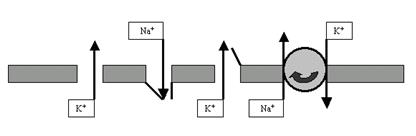
Рис. 31. И снова ПД со всеми его фазами. Обратите внимание на точки I, II и III. Как видите, они лежат на одной прямой, то есть уровень мембранного потенциала в них один и тот же (как мы договорились, около –70 мВ). А что Вы скажете об ионных градиентах по обе стороны мембраны? Ведь совершенно очевидно, что в I и III точках они совпадают или почти совпадают. А во II точке? Тем не менее после окончания следовых процессов мембрана Единственным механизмом, способным так быстро восстанавливать ионные градиенты, является ионный насос. В разбираемом нами случае это Na+-K+-ионообменник, или Na+-K+-помпа. Вы, конечно, помните, что такой насос качает ионы против градиента концентрации, затрачивая на это энергию АТФ. Вопреки декларациям многих современных учебников я утверждаю (основываясь на экспериментальных данных, естественно), что эти насосы работают непрерывно, постоянно поддерживая неравновесие концентраций ионов по разные стороны мембраны. Как Вы уже поняли, во время ПД такое неравновесие нарушается особенно сильно. Замечательно, что натрий-калиевый насос в это время резко увеличивает свою активность, чему способствует его особое свойство — электрогенность (это значит, что он активируется при изменении мембранного потенциала, то есть именно во время ПД). А дальше — своеобразный эффект маскировки: пока потенциалзависимые каналы открыты и пропускают ионы по их концентрационным градиентам, интенсивная работа насосов относительно незаметна и обнаруживается только при достаточно тонкой постановке экспериментов, когда же процессы деполяризации и реполяризации остались позади — активный ионный транспорт с помощью насосов проявляется во всей красе. Таким образом, именно во время следовых процессов мы наиболее явно обнаруживаем присутствие на мембране энергозависимых ионообменников — насосов (рис. 32).
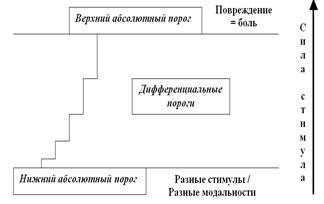
Рис. 32. Относительно полная схема мембраны нейрона, описывающая базовые процессы, которые обеспечивают формирование ПП и ПД: K+-поры (открыты всегда и участвуют как в ПП, так и в ПД), Na+-потенциалзависимые каналы (главный фактор фазы деполяризации ПД), K+-потенциалзависимые каналы (наряду с порами обеспечивают фазу реполяризации ПД), Na+-K+-помпа (восстанавливает и поддерживает катионные градиенты на мембране). Свойства потенциала действия (ПД) Хочется надеяться, что мы с Вами разобрались в основных процессах, формирующих элементы «языка мозга» — нервные импульсы. Но нужно шагать дальше, ведь импульсы способны распространяться только по мембране одного нейрона. Для того чтобы закодированная их последовательностью информация могла быть передана следующему нейрону, требуется преодолеть щелевой контакт между возбудимыми клетками — синапс. А в синапсе принципы передачи и переработки информации будут не совсем такими, как на обычной электрогенной мембране (например, мембране аксона). Парадокс заключается в том, что мы не сможем понять принципы работы синапса, если не разберём ещё один важный момент в принципах работы аксональной мембраны — так называемые свойства потенциала действия. Принято выделять 5 базовых свойств ПД. 1. ПД подчиняется закону «всё или ничего» (рис. 33). Вообще говоря, приведённая схема так очевидна, что не требует дополнительных комментариев. Но сам по себе закон «всё или ничего» настолько интересен, что мы просто обязаны на нём остановиться и поговорить поподробнее. Ведь речь-то идёт об одном из базовых понятий и физиологии, и психологии: о порогах. Самое распространённое определение порога звучит весьма тривиально: порог — это то минимальное значение стимула, на которое живая система отвечает изменением своей активности. Принято различать абсолютные (верхний и нижний) и дифференциальные пороги (или пороги различения стимулов) (рис. 34).
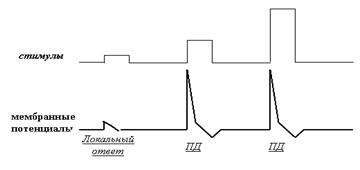
Рис. 33. Схема иллюстрирует закон «всё или ничего». Увеличивая силу наносимого от электростимулятора стимула, мы обнаруживаем, что при подпороговом значении стимула ПД не формируется, а развивается нераспространяющийся электротонический локальный ответ («ничего»). Если же мы перешагнули порог амплитуды стимула, разовьётся полноценный ПД, причём он будет одинаковым независимо от того, насколько нанесённый стимул сильнее порогового («всё»).
Если говорить о ПД, то закон «всё или ничего» как раз характеризует особенности реагирования электрогенной мембраны нейрона на стимулы, превышающие или не превышающие уровень нижнего абсолютного порога. А вот дифференциальные пороги и их особенности нервного импульса как раз никак не касаются! Именно поэтому наивные попытки некоторых авторов вкладывать в форму, длительность, амплитуду и другие характеристики ПД какой-то информационный смысл свидетельствуют о том, что эти авторы никогда не видели импульсную активность нейронов «живьём» и знают о ней сугубо понаслышке. Давайте попробуем разобраться, почему же закон «всё или ничего» так императивен. Вспомните цикл Ходжкина. Для его запуска требуется преодолеть определённое пороговое значение деполяризации (в электрофизиологии его называют КУД — критический уровень деполяризации).
Рис. 34. Понятие порогов чрезвычайно важно и для психологов, и для физиологов. Нижний абсолютный порог характеризует минимальное значение силы стимула, при котором живая система (клетка или её часть, ткань, орган, организм и т. д.) начинает «чувствовать» стимул (и его специфические особенности). Запуск ПД — это как раз игра на уровне нижнего абсолютного порога. Дифференциальные пороги характеризуют возможность различения силы (интенсивности) стимулов; чем больше сила стимула, тем выше эти пороги (закон Вебера — Фехнера). После превышения максимально возможной для данной живой системы интенсивности стимула начинает развиваться повреждение системы и утрачиваются индивидуальные признаки стимула; на сенсорном уровне это ощущается как боль.
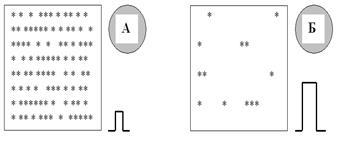
Этот уровень в некоторой степени индивидуален для каждого нейрона (разница иногда смешная — доли микровольта) и зависит исключительно от характеристик мембраны данной возбудимой клетки, а именно от количества (и, между прочим, качества) канальных белков. Давайте решим очень простую задачу: имеются два одинаковых по площади участка мембраны (1 квадратный микрометр, 1 квадратный метр — какая разница?), один весь буквально испещрён ионными каналами (пусть натриевыми), а на другом их ещё поискать придётся (рис. 35). Какую мембрану легче возбудить? Где нужен меньший начальный стимул? Где, стало быть, будет ниже КУД? Ответ-то простой: если на склоне горы лежат пять-шесть камней, потребуется сизифов труд, чтобы заставить их сымитировать хоть маленькую лавинку; если же весь склон в камнях — одного неосторожного движения (крика, слова) достаточно, чтобы сошла настоящая лавина (никогда так не делайте, а то будет, как с Бодровым-младшим!). Стало быть, способность мембраны ответить потенциалом действия на пришедший к ней стимул определяется тем, насколько она возбудима в настоящий момент (очень важно! мы скоро вернёмся к этому), и хватит ли силы стимула, чтобы запустить на ней цикл Ходжкина. Но, оказывается, судьба ПД зависит не только от силы, но и от длительности сти-мула.
Рис. 35. Чем меньше плотность (количество на единицу площади) каналов на мембране, тем труднее эту мембрану возбудить: для мембраны Б потребуется значительно больший стимул, чем для мембраны А. Кстати, важным может оказаться не просто формальное количество каналов, а их способность активироваться: мы можем «отравить» мембрану каким-нибудь нейротропным препаратом (например, анестетиком типа ультракаина), и каналы-то на мембране останутся, а вот открыться в ответ на деполяризацию смогут далеко не все.
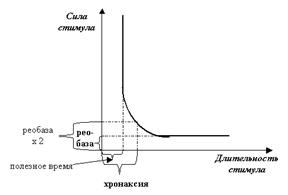
2. Существуют критические для ПД параметры длительности стимула? Мы уже проводили аналогию между стимулом и стартёром автомобиля. Действительно, если аккумулятор сел, стартёру не хватает силы для запуска двигателя. Но если пытаться завести даже вполне исправную машину короткими поворотами ключа зажигания (как это часто делают новоиспечённые водители), толку тоже не будет: двигатель будет «глохнуть». И здесь тоже прямое сходство с ПД: существует не только пороговое значение силы стимула, но и пороговое значение его длительности (рис. 36). Причина та же: при слишком коротких стимулах не удаётся набрать «критическую массу» активированных каналов для запуска цикла Ходжкина. В реальной нервной системе, конечно же, отрабатывают оба эти параметра, и эту общую закономерность хорошо выражает так называемая «кривая силы — длительности» (рис. 37). Очень советую: постарайтесь с ней поработать — это хорошая возможность научиться читать гра-фики.
Рис. 36. Подпороговая длительность стимула так же, как и подпороговая сила, не провоцирует ПД, а вызывает только локальный ответ, который связан с тем, что в нашем теле все ткани являются хорошими проводниками электрического тока, а изоляторов, стало быть, просто нет. Поэтому при нанесении электрического стимула по мембране как простому физическому проводнику пойдёт ток, но «далеко не уйдёт», ведь вокруг-то тоже проводники (представьте себе оголённый провод, упавший в ванну с морской водой, — только экспериментировать не надо, а то весь район без света оставите!). Локальный — «locus=место»: где локальный ответ зародился, там (или почти там) и умрёт. Такие процессы называются электротоническими. В каждом ПД есть элемент локального ответа, но распространяются только потенциалы действия.
Рис. 37. Классическая «кривая силы-длительности» графически выражает сразу оба свойства ПД. Обратите внимание на параллельные осям участки графика: параллельность оси X демонстрирует закон «всё или ничего» (стимул, меньший по силе порогового значения — реобазы, не вызовет ПД); параллельность участка графика оси Y показывает, что и для длительности стимула тоже существует пороговое значение, короче которого наносить стимул бесполезно (отсюда — «полезное время»). Эти показатели оказались не очень удобными, потому что характеризовали только уровни нижних абсолютных порогов. А ведь самой интересной является область перехода от одной параллельности к другой, когда и сила и длительность стимула закономерно дополняют друг друга. Для регистрации характеристик этой области было введено понятие хронаксии, которое отражает минимальную длительность стимула, вызывающего ПД при силе стимула, равной удвоенной реобазе.
3. Судьба ПД определяется также полярностью стимула (законы Пфлюгера) Ещё одним принципиально важным свойством ПД является его зависимость от полярности стимула. Вспомните наш электростимулятор (см. рис. 27): у него 3 главные ручки, позволяющие менять как раз силу, длительности и полярность стимула. То, что направление стимулирующего постоянного тока решительным образом влияет на возбудимость мембраны, впервые было показано ещё в позапрошлом веке замечательным немецким физиологом Пфлюгером в удивительно изящных для того времени экспериментах. Сформулированные Пфлюгером законы действия постоянного тока на возбудимые клетки и ткани звучат, на первый взгляд, довольно сложно даже в осовремененном вольном перевод
|
|||||||||||||||||
|
Последнее изменение этой страницы: 2021-06-14; просмотров: 229; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.123.79 (0.116 с.) |