
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Математическая характеристика необратимых процессов. Принцип возрастания энтропии замкнутой системы при необратимых процессах.
Все реальные процессы являются необратимыми, а значит протекают с потерей энергии. Как было отмечено в первом разделе, основнымии причинами необратимости реальных процессов являются: 1)самопроизвольный переход тепла от тел более нагретых к телам менее нагретым; 2) неупругий удар и трение; 3) расширение газа в пустоту; 4)самопроизвольная диффузия газов. За счет необратимости в реальных термодинамических процессах уменьшается совершаемая полезная работа и возрастают потери энергии.(ht необратимого процесса падает по сравнению с ht обратимого).
Для получения математической характеристики необратимых процессов рассмотрим работу 2-ух двигателей выполняющих цикл Карно, один из которых обратимый, другой нет. (база-2-ой, закон т.д.)
Пусть имеем 2 двигателя: обратимый “0” и необратимый “н”. Каждый из которых выполняет цикл Карно в одном и том же интервале температур.
htн=
В соответствии с учением Карно, при одинаковых температурах теплоотдатчика и теплоприемника КПД необратимого двигателя будет меньше чем htо.
htн<htо=> последнее выражение можно переписать в виде:
Получили, что для необратимых циклов Карно алгебраическая сумма приведенных кислот меньше “0”.
Данную характеристику можно распространить на весь класс необратимых машин.
Рассмотрим произвольный необратимый цикл 1-а-2-в-1. По аналогии с рассмотрением математической характеристики обратимых циклов мы можем с помощью адиабат разбить его на бесконечное множество необратимых циклов Карно, для которых будет справедливо неравенство: если проинтегрировать по процессам а и в то получим:
Полученное нами неравенство (з.н.) носит название второго интеграла Клаузиуса и является общей математической характеристикой необратимых циклов. По сути это математическое выражение второго закона термодинамики.
Сумма приведенных теплот по замкнутому контуру необратимого цикла меньше “0” (отрицательна).
Теперь, на базе уравнения (3.14.) рассмотрим как происходит изменение энтропии в необратимых термодинамических циклах. (мат. х-ка по энтропии).
Пусть мы имеем цикл, состоящий из необратимого процесса расширения 1-н-2 и обратимого процесса сжатия 2-0-1. Т.к. хотя бы один процесс в рассматриваемом цикле необратим, то необратим и весь цикл.
В соответствии со вторым интегралом Клаузиуса для данного цикла 1-н-2-0-1 мы можем записать:
Мы знаем, что для обратимого процесса
Уравнение 3.16. для элементарного необратимого процесса можно переписать в виде: dS
Уравнение 3.17. является математическим выражением второго закона термодинамики для необратимых процессов по энтропии.
Из него мы видим, что изменение энтропии в необратимом процессе не определяется интегралом
Всоответствии с уравнением 3.17. мы можем заметить, что при отсутствии теплообмена рассматриваемой системы с окружающей средой правая часть этого уравнения становится равной “0” (изолированная термодинамическая система).
бq=0=>
Получим, что При необратимых процессах энтропия замкнутой системы возрастает(это принцип возрастания энтропии). Выражение 3.18. тоже является математическим выражением 2-го закона термодинамики.
Мы с вами уже перечислили основные причины необратимости реальных процессов. Давайте еще раз к ним вернемся и посмотрим на них с точки зрения изменения энтропии.
1. Основные причины необратимости с точки зрения возрастания энтропии. Самопроизвольный переход теплоты от более нагретых тел к менее нагретым.
Пусть в системе имеется 2 тела А(Та) и в(ТВ) причем Та>Тв. При контакте этих тел некоторое количество теплоты перешло от тела А к телу В. Предположим, что тела А и В обладают большой общей теплоемкостью и в результате контакта температура их существенно не изменилась.
Изменение энтропии тел А и В можно определить как:
D D
т.к. Та> Тв по условию, то => |DSA|<|DSВ|
Изменение энтропии системы тел А и В в резыльтате такого взаимодействия определится как DS=DSА+DSB=Q
Получим, что при самопроизвольном переходе теплоты (необратимый процесс) от тел более нагретых к менее нагретым энтропия системы тел иозросла.
2. Трение и неупругий удар.
Если при трении 2-х тел образуется теплота Qтр, то она должна рассеиваться в окружающей тело среде, имеющей температуру Т0. Следовательно должноп произойти изменение энтропии окружающей cреды на величину:
DS= Следовательно и в этом случае энтропия системы возрастает.
3. Расширение газа в пустоту.
Предположим, что один киломоль идеального газа расширяется в пустое пространство и при этом объем газа увеличивается в два раза. Проведенные наблюдения показали, что температура газа в таком процессе как правило остается неизменной, т.е. процесс изотермический (условно). Значит изменение энтропии 1 кмоля такого газа может определиться как:
DSm=Rm ln
4. Самопроизвольная диффузия газов.
Пусть в сосуде, разделенном перегородкой на 2 равные части содержатся при одинаковых давлениях и температурах О2 и N2. При удалении перегородки произойдет самопроизвольное смешение газов (диффузия). Данный процесс будет аналогичен предыдущему. Каждый газ увеличится в объеме в 2 раза при постоянной температуре. Энтропия полученной газовой смеси будет равна сумме энтропий компонентов, в условии, что они заняли весь объем:
DSmO2=Rm ln2 >0 и DSmN2=Rm ln 2 >0 => DS>0
Получили, что и в этом случае энтропия системы тел возросла. Таким образом мы видим, что реальные процессы, вследствии необратимости подчиняются не только закону сохранения энергии (1-ый закон термодинамики) но и одновременно принципу возрастания энтропии (2-ой закон термодинамики).
Что дает при этом принцип возрастания энтропии?
Принцип возрастания энтропии позволяет нам: 1) Судить о возможном направлении реальных процессов (всегда в сторону возрастания S).
2) Определять теоретическим путем потери полезной работы вследствии необратимости процессов в реальных тепловых машинах. Это осуществляется на базе уравнения энергетического баланса. Подзаголовок.
|
|||||||
|
Последнее изменение этой страницы: 2021-07-19; просмотров: 116; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.29.224 (0.013 с.) |
 ; htо=
; htо= 
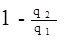 <
< 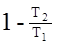 =>
=> 

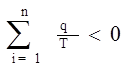 (3.13.)
(3.13.) 

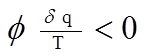 (3.14.)
(3.14.) (3.15.)
(3.15.) 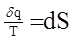 . В нашем случае таким процессом является 2-0-1. Значит можно записать, что:
. В нашем случае таким процессом является 2-0-1. Значит можно записать, что: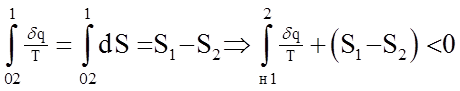
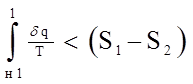 (3.16)
(3.16) 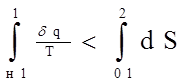
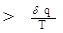 (3.17)
(3.17)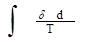 . Оно больше этой величины.
. Оно больше этой величины.
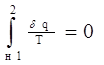 => DS>0; fdS>0 (3.18.)
=> DS>0; fdS>0 (3.18.) ;
; .
. > 0
> 0
 Rm ln 2>0.
Rm ln 2>0.


