Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Маркёры метаболизма костной ткани
Биохимические маркёры дают информацию о патогенезе заболеваний скелета и о фазах ремоделирования костной ткани. Различают биохимические маркёры формирования и резорбции кости, характеризующие функции остеобластов и остеокластов.
Прогностическая значимость определения маркёров метаболизма костной ткани: • проведённый скрининг с использованием данных маркёров позволяет определить пациентов с высоким риском развития остеопороза; • высокие уровни маркёров резорбции костей могут быть связаны с увеличением риска переломов; • повышение уровня маркёров метаболизма костной ткани у пациентов с остеопорозом более чем в 3 раза по сравнению с показателями нормы предполагает иную костную патологию, включая злокачественную; • маркёры резорбции могут быть использованы в качестве дополнительных критериев при решении вопроса о назначении специальной терапии при лечении костной патологии.
Маркёры резорбции кости. Во время обновления костной ткани коллаген I типа, который составляет более 90% органического матрикса кости и синтезируется непосредственно в костях, деградирует, а небольшие пептидные фрагменты попадают в кровь или выделяются почками. Продукции деградации коллагена можно определять как в моче, так и в сыворотке крови. Эти маркёры можно использовать при терапии препаратами, снижающими резорбцию костей, у пациентов с болезнями, связанными с нарушениями метаболизма костной ткани. В качестве критериев резорбции костной ткани выступают продукты деградации коллагена I типа: N- и С-телопептиды и тартрат-резистентная кислая фосфатаза. При первичном остеопорозе и болезни Педжета происходит отчетливое повышение С-концевого телопептида коллагена I типа и количество этого маркёра увеличивается в сыворотке крови в 2 раза.
Распад коллагена - единственный источник свободного гидроксипролина в организме. Преобладающая часть гидроксипролина катаболизируется, а часть выделяется с мочой, главным образом, в составе небольших пептидов (ди- и трипептидов). Поэтому содержание гидроксипролина в крови и моче отражает баланс скорости катаболизма коллагена. У взрослого человека в сутки экскретируется 15-50 мг гидроксипролина, в молодом возрасте до 200 мг, а при некоторых болезнях, связанных с поражением коллагена, например: гиперпаратироидизме, болезни Педжета и наследственной гипергидроксипролинемии, причиной которой является дефект фермента гидроксипролиноксидазы, количество в крови и выделяемого с мочой гидроксипролина увеличивается.
Остекласты секретируют тартрат-резистентную кислую фосфатазу. При возрастании активности остеокластов происходит увеличение содержания тартрат-резистентной кислой фосфатазы и она попадает в повышенном количестве в кровоток. В плазме крови активность этого фермента возрастает при болезни Педжета, онкологических заболеваниях с метастазами в кость. Определение активности этого фермента особенно полезно при мониторинге лечения остеопороза и онкологических заболеваний, сопровождающихся поражением костной ткани.
Маркёры формирования кости. Формирование костной ткани оценивают по количеству остеокальцина, костного изофермента щелочной фосфатазы и остеопротегерина. Измерение количества сывороточного остеокальцина позволяет определять риск развития остеопороза у женщин, проводить мониторинг костного метаболизма во время менопаузы и гормональной заместительной терапии. Рахит у детей раннего возраста сопровождается снижением в крови содержания остеокальцина и степень снижения его концентрации зависит от выраженности рахитического процесса. У больных с гиперкортицизмом и пациентов, получающих преднизолон, значительно снижено содержание остеокальцина в крови, что отражает подавление процессов костеобразования.
Изофермент щелочной фосфатазы присутствует на клеточной поверхности остеобластов. При увеличенном синтезе фермента клетками костной ткани повышается его количество в плазме крови, поэтому определение активности щелочной фосфатазы, особенно костного изофермента, является информативным показателем костного ремоделирования.
Остеопротегерин выступает в качестве рецептора ФНО. Связываясь с преостеокластами, он ингибирует мобилизацию, пролиферацию и активацию остеокластов.
5.4. РЕАКЦИЯ КОСТНОЙ ТКАНИ НА ДЕНТАЛЬНЫЕ ИМПЛАНТАТЫ
При различных формах адентии альтернативой съёмному протезированию являются внутрикостные дентальные имплантаты. Реакцию костной ткани на имплантат можно рассматривать как частный случай репаративной регенерации.
Различают три вида соединения дентальных имплантатов с костной тканью: • прямое приживление - остеоинтеграция; • фиброзно-оссальная интеграция, когда вокруг дентального имплантата образуется слой фиброзной ткани толщиной около 100 мкм; • периодонтальное соединение (самый редкий вид), образующееся в случае периодонтального связочно-подобного сращения с периимплантационными коллагеновыми волокнами или (в некоторых случаях) цементирование внутрикостного дентального имплантата.
Считают, что в процессе остеоинтеграции после постановки дентальных имплантатов образуется тонкая зона из протеогликанов, которая лишена коллагена. Зона склеивания дентального имплантата с костью обеспечивается двойным слоем протеогликанов, включающим молекулы декорина.
При фиброзно-оссальной интеграции в соединении имплантата с костной тканью также участвуют многочисленные компоненты внеклеточного матрикса. За устойчивость имплантата в его капсуле отвечают коллагены I и III типа, а фибронектин играет основную роль в связывании элементов соединительной ткани с имплантатами.
Однако через какой-то период времени под действием механической нагрузки растёт активность коллагеназы, катепсина К и кислой фосфатазы. Это приводит к убыли костной ткани в периимплантационной области и происходит дезинтеграция дентального имплантата. Ранняя дезинтеграция внутрикостных дентальных имплантатов происходит на фоне сниженного количества в кости фибронектина, Gla-белка, тканевого ингибитора матриксных металлопротеиназ (ТИМП-1).
Установлено, что белковый спектр костной ткани верхних и нижних челюстей различен. Для нижней челюсти по сравнению с верхней характерно более низкое содержание фибронектина и Gla-белков, и наиболее часто дезинтеграция дентальных имплантатов наблюдается именно на нижней челюсти.
ГЛАВА 6 СЛЮННЫЕ ЖЕЛЕЗЫ
Состояние твёрдых и мягких тканей полости рта определяется количеством и свойствами слюны, которая выделяется слюнными железами, расположенными в переднем отделе пищеварительного тракта человека.
В слизистой оболочке языка, губ, щёк, твёрдого и мягкого нёба расположены многочисленные мелкие слюнные железы. За пределами полости рта имеются 3 пары крупных желёз - околоушные, подъязычные и поднижнечелюстные и сообщающихся с ней при помощи протоков.
6.1. СТРОЕНИЕ И ФУНКЦИИ СЛЮННЫХ ЖЕЛЁЗ
Крупные слюнные железы относятся к альвеолярно-трубчатым и состоят из секреторных отделов и системы путей, выводящих слюну в полость рта.
В паренхиме слюнных желёз выделяют концевой отдел и систему выводных протоков. Концевые отделы представлены секреторными и миоэпителиальными клетками, которые связываются через десмосомы с секреторными клетками и способствуют выведению секрета из концевых отделов. Концевые отделы переходят во вставочные протоки, а они, в свою очередь, в исчерченные протоки. Для клеток последних характерно наличие расположенных перпендикулярно к базальной мембране вытянутых митохондрий. В апикальных частях этих клеток присутствуют секреторные гранулы. Односторонний транспорт слюны обеспечивается резервуарными и клапанными структурами, а также мышечными элементами.
В зависимости от состава выделяемой слюны различают белковые, слизистые и смешанные секреторные отделы. Околоушные слюнные железы и некоторые железы языка выделяют жидкий белковый секрет. Мелкие слюнные железы вырабатывают более густую и вязкую слюну, содержащую гликопротеины. Поднижнечелюстные и подъязычные, а также слюнные железы губ, щёк и кончика языка выделяют смешанный белково-слизистый секрет. Большую часть слюны образуют поднижнечелюстные слюнные железы (70%), околоушные (25%), подъязычные (4%) и малые (1%). Такая слюна называется собственно слюной или проточной слюной.
Функции слюнных желёз
Секреторная функция. В результате секреторной деятельности больших и малых слюнных желёз увлажняется слизистая оболочка рта, что является необходимым условием для осуществления двустороннего транспорта химических веществ между слизистой оболочкой рта и слюной.
Выделительная (инкреторная) функция. Со слюной выделяются различные гормоны - глюкагон, инсулин, стероиды, тироксин, тиреотропин и др. Инкретируются мочевина, креатинин, дериваты лекарственных средств и другие метаболиты. Слюнные железы обладают избирательным транспортом веществ из плазмы крови в секрет.
Регуляторная (интегративная) функция. Слюнные железы обладают эндокринной функцией, которая обеспечивается благодаря синтезу в ней паротина и факторов роста - эпидермального, инсулиноподобного, роста нервов, роста эндотелия, роста фибробластов, которые оказывают как паракринное, так и аутокринное действие. Все эти вещества выделяются как в кровь, так и в слюну. Со слюной в незначительных количествах они выделяются в полость рта, где способствует быстрому заживлению повреждений слизистой оболочки. Паротин также оказывает действие на эпителий слюнных желёз, стимулируя синтез белка в этих клетках.
6.2. МЕХАНИЗМ СЕКРЕЦИИ СЛЮНЫ
Секреция - внутриклеточный процесс поступления в секреторную клетку веществ, образования из них секрета определённого функционального назначения и последующее выделение секрета из клетки. Периодические изменения в секреторной клетке, связанные с образованием, накоплением, выделением секрета, и восстановление путём дальнейшей секреции называется секреторным циклом. Выделяют от 3 до 5 фаз секреторного цикла, и для каждой из них характерно специфическое состояние клетки и её органелл.
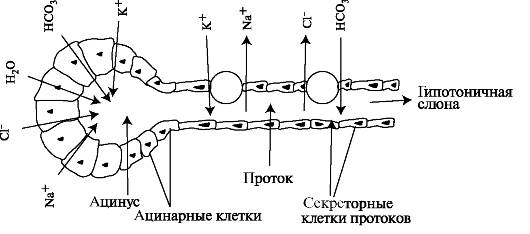
Цикл начинается с поступления в клетку из плазмы крови воды, неорганических и низкомолекулярных органических соединений (аминокислоты, моносахариды и др.) путём пиноцитоза, диффузии и активного транспорта. Поступившие в клетку вещества используются для синтеза секреторного продукта, а также для внутриклеточных энергетических и пластических целей. Во второй фазе формируется первичный секреторный продукт. Эта фаза существенно различается в зависимости от вида образуемого секрета. В конечной фазе происходит выделение секреторного продукта из клетки. По механизму выделения слюны секреторными отделами все слюнные железы относятся к экзокринно-мерокриновым. В этом случае секрет выделяется из клетки без разрушения железистых клеток в растворённом виде через её апикальную мембрану в просвет ацинуса, а в дальнейшем поступает в полость рта (рис. 6.1).
Рис. 6.1. Транспортные системы в слюнных железах, участвующие в формировании слюнного секрета.
Активный транспорт, синтез и секреция белков требуют затраты энергии молекул АТФ. Молекулы АТФ образуются при распаде глюкозы в реакциях субстратного и окислительного фосфорилирования.
Образование первичного слюнного секрета
Секрет слюнных желёз содержит воду, ионы и белки. Специфика и выделение разных по составу продуктов секреции позволили выявить секреторные клетки с тремя видами внутриклеточных конвейеров: белковым, слизистым и минеральным.
Первичная секреция ионов из плазмы крови (изотоническая слюна)
Образование первичного секрета связано с рядом факторов: приток крови по кровеносным сосудам, окружающим секреторные отделы; слюнные железы даже в состоянии покоя имеют высокий объёмный кровоток. При секреции желёз и происходящей при этом вазодилятации кровоток возрастает в 10-12 раз. Кровеносные капилляры слюнных желёз характеризуются высокой проницаемостью, которая в 10 раз выше, чем в капиллярах скелетных мышц. Вероятно, что такая высокая проницаемость обусловлена наличием в клетках слюнных желёз активного калликреина, который расщепляет кининогены. Образующиеся кинины (каллидин и брадикинин) изменяют проницаемость сосудов; ток воды и ионов по околоклеточному пространству, открытие каналов на базолатеральной и апикальной мембранах; сокращение миоэпителиальных клеток, расположенных вокруг секреторных отделов и выводных протоков. В секреторных клетках повышение концентрации ионов Ca2+ сопровождается открытием кальций-зависимых ионных каналов. Синхронное образование секрета в ацинарных клетках и сокращение миоэпителиальных клеток приводит к освобождению первичной слюны в выводные протоки.
|
||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 93; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.16.81.94 (0.022 с.) |