Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Первичная минерализация эмали
Первичная минерализация эмали представляет двухступенчатый процесс, включающий инициацию и последующий рост кристаллов (эпитаксию). Для роста кристаллов необходимы белки с небольшой мол. массой, а в составе секреторных гранул содержатся высокомолекулярные гликофосфопротеины, поэтому эти белки подвергаются ограниченному расщеплению протеолитическими ферментами - энамелизинами (ММП-20), калликреином и матриксными сериновыми протеиназами. Энамелизин секретируется в начальной стадии созревания эмали, как амелобластами, так и одонтобластами, а калликреин-4 - только амелобластами. Каждая протеиназа обладает субстратной специфичностью и расщепляет пептидные связи, образованные определёнными аминокислотами. Процесс протеолиза носит каскадный характер, что сопровождается образованием белков с разной мол. массой и различными функциями. Так, энамелизин гидролизует амелогенины с мол. массой 25 кДа и образуются белки с мол. массой 20 кДа, которые далее подвергаются гидролизу при участии слабощелочной протеиназы - калликреина-4. В результате протеолиза освобождаются амелогенины с мол. массой 6 и 13 кДа. Образующиеся в процессе гидролиза низкомолекулярные белки способны присоединять Ca2+ и PO43-.
К остаткам глутаминовой кислоты, аспарагина и фосфосерила присоединяются ионы кальция и фосфата. В процессе дальнейшей преципитации ионов формируется первичный кристалл гидроксиапатита.
Для образования кристаллов гидроксиапатита необходима высокая концентрация Ca2+. В транспорте Ca2+ участвуют кальций-связывающие белки. Наличие большого количества глутамата и аспартата в эмалевых низкомолекулярных белках и других протеинах минерализованных тканей позволяет присоединять Ca2+ непосредственно к карбоксильным группам этих аминокислот; Ca2+ также связывается с остатками фосфосерила. Присоединение кальция и фосфата к белкам эмали заканчивается формированием кристаллитов гидроксиапатита.
Вначале формируются длинные и тонкие кристаллиты, которые встраиваются в органический матрикс параллельно друг другу. В более позднем периоде кристаллиты утолщаются и превращаются в плоские шестиугольные призмы (рис. 4.4).
Рис. 4.4. Формирование кристаллитов гидроксиапатита.
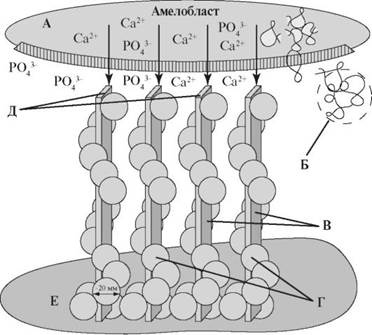
Упорядоченное построение и форма кристаллов эмали отличается от бесформенных пластинчатых призм кристаллов кости и дентина. Уникальность эмалевых кристаллов обусловлена особенностью их формирования и роста. Рост кристаллов регулируется ионами Ca2+ и PO43-, которые транспортируются от амелобластического слоя в эмалевый матрикс. В свою очередь, поток жидкости, изменяющийся в течение развития эмали, регулирует эмалевый матрикс. В регуляции роста кристалла в длину, ширину и толщину участвуют амелогенины, упакованные в наносферы (рис. 4.5).
Рис. 4.5. Регуляция роста кристалла [по Ten Cate A.R., 1998]: А - клеточная мембрана амелобласта; Б - собранная наносфера; В - начальные кристаллиты; Г - ансамбли из наносфер, располагающиеся на поверхности первичных кристаллов; Д - кристаллиты присоединяют дополнительные ионы кальция и фосфата; Е - минерализованный матрикс дентина.
Амелогенины подвижны и не связываются с кристаллами. Считают, что присутствие глутаминовой кислоты в составе амелогенинов позволяет связывать молекулы H2O и Ca2+, тем самым способствуя формированию кристаллов. Предполагают, что амелогенины мигрируют по формирующейся эмали и по мере роста кристаллов вытесняются в сторону энамелобластов. Эмалевые белки обнаруживают во всех участках новообразованной эмали, но наибольшая их концентрация определяется в оболочке эмалевых призм. В формирующейся эмали также обнаружены остатки отростков амелобластов, содержащих небольшое количество глицерофосфолипидов, которое сохраняется в зрелой эмали.
|
|||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 99; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.134.81.206 (0.004 с.) |