Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Адгезивные и антиадгезивные белки
Белки межклеточного матрикса выполняют самые разные функции. Часть из них обладает способностью склеивать компоненты межклеточного вещества и клеток, и эти белки получили название адгезивных. Другая группа белков, напротив, подавляет адгезию клеток и внеклеточных компонентов, и их называют антиадгезивными. Взаимодействие клеток с внеклеточным матриксом является сложным процессом и проявляется как усилением адгезии, так и её ослаблением. В адгезии мезенхимальных и эпителиальных клеток участвуют белки - фибронектин, витронектин, ламинин, нидоген (энтактин) и интегрины. Напротив, антиадгезивные белки - тенасцин, тромбоспондин способны менять форму клеток и частично откреплять их от компонентов внеклеточного матрикса. Вместе с тем, такое разделение белков на адгезивные и антиадгезивные является достаточно условным.
Фибронектин - высокомолекулярный гликопротеин, ключевой белок внеклеточного матрикса, синтезируемый фибробластами. В зависимости от ионной силы и рН внеклеточного матрикса форма молекулы фибронектина может меняться от глобулярной до промежуточной. Молекулы фибронектина представляют собой димеры, состоящие из двух сходных между собой полипептидных цепей, связанных гидрофобными взаимодействиями и двумя дисульфидными связями. Субъединицы подразделяются на ряд различных доменов, способных связываться с клеточными рецепторами через интегрины, а также коллагенами, фибрином и протеогликанами. Связываясь перекрёстно друг с другом через дисульфидные мостики, молекулы фибронектина образуют фибриллярные структуры (рис. 1.23).
Рис. 1.23. Cтруктура молекулы фибронектина (А). Модель молекулы фибронектина (Б). Цифрами обозначены домены, связывающие: 1 - гепарин, 2 - клетки, 3 - коллаген, 4 - другие молекулы фибронектина [по Cooper G.M., 2000, с изменениями].
На молекуле фибронектина имеется центр связывания фермента трансглутаминазы. Трансглутаминаза катализирует реакцию соединения остатков глутамина одной полипептидной цепи с остатками лизина другой белковой молекулы. Это позволяет сшивать поперечными ковалентными связями молекулы фибронектина друг с другом, коллагеном и другими протеинами. Фибронектин вовлечён во множественные клеточные процессы, включающие репарацию тканей, эмбриогенез, миграцию и адгезию клеток.
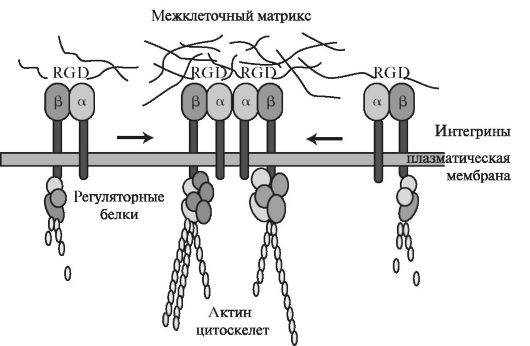
Интегрины представляют собой гетеродимерные белки с мол. массой 100-160 кДа, располагающиеся на плазматической мембране клеток и состоящие из двух нековалентно связанных трансмембранных α- и β-субъединиц. Для функционирования интегринов необходимо присутствие двухвалентных ионов (Ca2+ или Mg2+), поскольку связывание катиона Ca2+ позволяет N-концевым участкам α- и β-субъединиц соединяться друг с другом и прикрепляться к внеклеточному матриксу Они способны узнавать в матриксных белках пептид RGD (арг-гли-асп). Семейство интегринов включает 20 видов рецепторов с разной специфичностью. Такое разнообразие обеспечивается различием в строении α- и β-цепей. Описано 9 разновидностей α-цепей и 14 β-субъединиц. Каждая цепь интегрина пересекает мембрану один раз. Обе цепи интегрина имеют большие внеклеточные домены. Эти домены обеспечивают адгезию клеток к клеткам и к компонентам внеклеточного матрикса - коллагену, фибронектину, витронектину, ламинину (рис. 1.24).
Рис. 1.24. Взаимодействие интегринов с актиновыми белками цитоскелета и межклеточным матриксом [по Campbell N.A., Reece J.B., 2002, с изменениями].
Благодаря трансмембранной ориентации интегрины переносят сигналы от внеклеточного матрикса к цитоскелету Большинство интегринов связано с цитоплазматическими С-концевыми участками с актин-связывающими белками клеток. При связывании лиганда β-субъединицы связывающихся интегринов взаимодействуют с так называемыми белками прикрепления - талином и α-актинином, которые, в свою очередь, инициируют сборку других соединительных белков. Таким образом, происходит связывание интегринов с актиновыми филаментами. Актиновые филаменты через интегрины могут изменять ориентацию секретируемых молекул фибронектина во внеклеточном матриксе. В то же время внеклеточный матрикс может влиять на организацию цитоскелета в клетках-мишенях, что и обеспечивает двустороннюю передачу сигнала. Связывание интегринов с лигандами и сближение клеток необходимы для перестройки базальной мембраны.
Взаимодействие интегринов с белками внеклеточного матрикса в некоторых случаях препятствует апоптозу. Утрата некоторых интегринов (при раке молочной железы, предстательной железы, толстой кишки) или их избыток (при меланоме, плоскоклеточном раке полости рта, носоглотки, гортани) сопряжены с высокой степенью злокачественности опухоли.
Таким образом, информация, которую интегрины передают от внеклеточного матрикса внутрь клетки, в одних случаях стимулирует адгезию и миграцию опухолевых клеток, в других - приводит к их гибели. Иными словами, интегрины играют роль своеобразного «переключателя», определяющего дальнейшую судьбу опухолевой клетки.
Ламинины - представители семейства адгезивных гликопротеинов c мол. массой 850 кДа. Молекула ламинина представляет собой большой гибкий комплекс, состоящий из длинных α-, β1-, β2-полипептидных цепей, ассоциированных в форме асимметричного креста и удерживаемых вместе при помощи дисульфидных связей. Каждая цепь содержит несколько функциональных доменов, способных связываться с коллагеном IV типа, гепарансульфатом, энтактином (нидогеном) и рецепторами на клеточной поверхности. Ламинины склеивают эпителиальные клетки с базальной мембраной (рис. 1.25).
Рис. 1.25. Строение ламинина [по Cooper G.M., 2000, с изменениями].
На ранних этапах морфогенеза базальная мембрана состоит в основном из сети ламинина и не содержит (или содержит мало) коллагена IV типа.
Ламинины в базальной мембране находятся в комплексе с белком нидогеном, который соединяется С-концевым доменом с (32-цепью ламинина. В N-концевой области нидогена располагаются два глобулярных домена, один из которых связывается с коллагеном IV типа и коровым белком протеогликана перлекана. Таким образом, ламинин совместно с нидогеном обеспечивает структурную организацию компонентов базальной мембраны. Кроме того, глобулярные домены содержат центры связывания других лигандов вне зависимости от нидогена. Так β1-цепь нидогена содержит домены, сходные со структурой белков цистатинов, обладающих способностью ингибировать цистеиновые трипсиноподобные протеиназы.
Ламинины обеспечивают миграцию эпителиальных клеток и таким образом участвуют в одонтогенезе, связывании тканей периодонта с цементом корня зуба, построении эпителиальной оболочки на поверхности пульпарной ткани при образовании полипа пульпы.
Витронектин - гликопротеин, содержащийся в плазме крови и внеклеточном матриксе. Витронектин вступает во взаимодействие с гликозаминогликанами, коллагеном, плазминогеном, рецептором урокиназы. Стабилизируя ингибирующую конформацию ингибитора активации плазминогена 1 (протеиназы), регулирует деградацию матрикса. Через связывание витронектина с комплементом, гепарином и комплексами тромбин-антитромбин III, он участвует в иммунном ответе и регуляции свертывания крови. В полипептидной цепи витронектина присутствует аминокислотная последовательность RGD, которая обеспечивает его взаимодействие с αVβ3-рецептором интегрина и участие в прикреплении, распластывании и перемещении клеток.
Тенасцин и тромбоспондин - гликопротеины, обладающие как адгезивными, так и антиадгезивными свойствами. Тенасцин и тромбоспондин играют определённую роль в эмбрио- и морфогенезе. Эти белки обеспечивают изменение клеточной формы в условиях in vitro, которое, в свою очередь, приводит к сдвигам в поведении клеток в культуре. Они способствуют реорганизации актинового цитоскелета путём изменения адгезивных контактов с белковыми факторами, обеспечивающими подвижность клеток. Тенасцин и тромбоспондин формируют комплексы с протеогликанами и при связи тенасцина с хондроитинсульфатом изменяются адгезивные свойства протеогликанов.
Тенасцин - олигомерный гликопротеин с мол. массой более 100 кДа. Молекула данного белка имеет мозаичную структуру, а аминокислотная последовательность сходна с эпидермальным фактором роста. В составе тенацина имеются кальций-связывающие домены. Тромбоспондин - гликопротеин, который проявляет свои антиадгезивные свойства в клетках эндотелия и фибробластов, поскольку с β-трансформирующим и тромбоцитарным факторами роста ослабляют связывание матриксных молекул между собой. Тромбоспондин проявляет и адгезивные свойства при взаимодействии с молекулами интегринов, гликопротеинов, гепарансульфата и гликолипидов. Глобулярные домены, содержащиеся в N- и C-концевых областях, способствуют связыванию кальция с гепарином, после чего тромбоспондин вступает во взаимодействие с коллагеном, фибронектином, фибриногеном, ламинином и плазминогеном.
Помимо адгезивных белков, участвующих в организации надмолекулярных комплексов межклеточного матрикса, в тканях присутствуют гликопротеины, относящиеся к факторам роста.
Факторы роста
В качестве факторов роста обычно выступают небольшие полипептиды, которые стимулируют или ингибируют пролиферацию определённых типов клеток. Как правило, они секретируются одними клетками и действуют на другие клетки, хотя иногда бывает и так, что они действуют на те же клетки, которые их секретируют. Факторы роста связываются со специфическими для них рецепторами, локализованными на поверхности клеточных мембран своих клеток-мишеней. Большинство факторов роста активируют в клетках тирозиновые протеинкиназы и только ТФР-β активирует треониновые протеинкиназы.
Трансформирующий фактор роста (ТФР-β) - семейство гликопротеинов, включающих 6 разнообразных белков. Они представляют собой димеры, состоящие из двух идентичных субъединиц. Белки ТФР-β синтезируются в виде предшественников, секретируются в неактивной форме и активируются путём ограниченного протеолиза.
На клеточной мембране бластных клеток выявлено 3 типа рецепторов к ТФР. Рецепторы третьего типа являются поверхностными протеогликанами и обеспечивают доступ ТФР-β к рецепторам первого и второго типов, которые после связывания ТФР-β образуют гетеродимер с протеинкиназной активностью. Происходит аутофосфорилирование цитоплазматического домена рецепторов по остаткам серина и треонина. Далее происходит фосфорилирование цитоплазматических белков, участвующих в передаче сигнала в ядро, где происходит активация гена транскрипции. Через такой механизмом активируется синтез белков внеклеточного матрикса, например коллагена I типа и металлопротеиназ. Кроме того, ТФР-β действует как фактор хемотаксиса для моноцитов и фибробластов. Он подавляет пролиферацию и функцию Т- и В-лимфоцитов и эндотелиальных клеток. Среди сложной сети цитокинов, которые влияют на функцию одонтобластов в процессе регенерации дентина, важную роль играют ТФР-β, который функционирует как мощный иммунодепрессант и индуктор синтеза белков внеклеточного матрикса. ТФР-β поддерживает гомеостаз в комплексе дентин-пульпа при воспалении.
Морфогенетический белок кости (МБК) - кислый гликофосфопротеин, богатый серином и глицином, содержащий три дисульфидные связи. Восстановление дисульфидных связей вызывает инактивацию МБК. В пульпе зуба секретируется в ответ на внешние раздражители одонтобластами для образования заместительного дентина. МБК очень активен в костной ткани и вызывает дифференцировку стволовых клеток в остеогенные.
Фактор роста эндотелия (ФРЭ) - гликопротеин, связывающийся только с клетками эндотелия сосудов и стимулирующий их пролиферацию. Кроме того, ФРЭ может активировать специфический белок, включающий киназный комплекс. Образующиеся фосфорилированные белки вызывают перемещение клеток, поэтому при повреждении пульпы зуба, костной ткани, слизистой оболочки, периодонта и других тканей полости рта под влиянием ФРЭ происходит быстрое перемещение, увеличение и дифференцировка клеток с активацией щелочной фосфатазы. ФРЭ вызывает расширение кровеносных сосудов, что является важным условием для поддержания кровотока в тканях при воспалении. Он также увеличивает синтез ИЛ-1, фактора некроза опухоли (ФНО), которые вносят существенный вклад в расширение сосудов при патологических процессах. Нарушение регуляции процессов факторов роста эндотелия сопровождается увеличением осмотического давления, болью и необратимыми изменениями в ткани.
Инсулиноподобный фактор роста (ИФР) оказывает аутокринное и паракринное действие. Предполагается его участие в быстром росте клеток, их дифференцировке и минерализации твёрдых тканей зуба.
Фактор роста фибробластов (ФРФ) - семейство структурно связанных полипептидов, представленное девятью белками. Мол. масса различных форм ФРФ колеблется от 168 до 250 кДа. До 50% аминокислотной последовательности молекулы фактора роста фибробластов соответствует структуре фактора роста эндотелия. Оба эти пептида также обнаруживают сходное сродство к гепарину и вызывают расширение сосудов. Фактор роста фибробластов участвует в росте и дифференцировке фибробластов при образовании фиброзной капсулы вокруг очага воспаления.
Фактор роста нервов (ФРН) - семейство белков, стимулирующих рост клеток нервной ткани. Практически все клетки человека синтезируют этот фактор. Фактор роста нервов участвует в быстром восстановлении повреждённого участка за счёт роста аксонов из повреждённого нервного ствола или от ближележащих неповреждённых нервных волокон. Тем самым ФРН может играть важную роль в ответе нервных клеток на повреждение. Выделение ФРН в полость рта со слюной стимулирует заживление повреждённых участков слизистой оболочки.
Фактор роста гепатоцитов (ФРГ) стимулирует пролиферацию клеток различных тканей. Возможно его участие в агрегации клеток при повреждении тканей, а также в морфогенезе тканей зуба.
Эпидермальный фактор роста (ЭФР) - белок с мол. массой 70 кДа. Различают α- и β-формы ЭФР. Оказывает действие на клетки эктодермы: кератиноциты кожи, эпителиоциты слизистой оболочки полости рта, пищевода, глотки, а также мезодермы: хондроцитов, эндотелия сосудов. Эпидермальный фактор роста стимулирует дифференцировку одонтобластов и повышает в них синтез ДНК в момент созревания зубных тканей. С возрастом ЭФР угнетает деление одонтобластов, уменьшает синтез коллагена I типа и снижает активность щелочной фосфатазы. На выработку ЭФР влияют стероидные гормоны, тироксин и прогестерон.
Фактор роста тромбоцитов (ФРТ) влияет на многие клетки. Индуцирует синтез щелочной фосфатазы и протеогликанов в одонтобластических клетках зубной пульпы и костной ткани.
1.5. КАТАБОЛИЗМ БЕЛКОВ МЕЖКЛЕТОЧНОГО МАТРИКСА
Ремоделирование тканей связано с дифференцировкой и миграцией клеток. Клетка, вступившая на путь дифференцировки, неизбежно погибает. Нарождающаяся новая клетка начинает синтезировать новые собственные белки, часть из которых поступает в матрикс.
В катаболизме белков клеток и межклеточного матрикса основная роль отводится матриксным металлопротеиназам (ММП, матриксины). В физиологических условиях ММП играют центральную роль в процессах морфогенеза, ремоделирования и резорбции тканей. Своё действие матриксины проявляют в межклеточном матриксе. В активном центре этих ферментов присутствуют кальций или цинк, поэтому они получили название Са2+-зависимых цинковых матриксных металлопротеиназ. Известно более 20 различных металлопротеиназ, отличающихся по субстратной специфичности и другим свойствам. На основании структурной организации и субстратной специфичности выделено четыре основных подсемейства ММП: • коллагеназы - запускают гидролиз спиральной области коллагенов I, II и III типов; • желатиназы - гидролизуют коллаген IV типа базальных мембран; • стромелизины - расщепляют коровые белки протеогликанов и ряд адгезивных белков матрикса; • металлоэластаза - расщепляет эластин.
В распаде нативного коллагена, период полужизни которого измеряется неделями или месяцами, участвуют коллагеназы, относящиеся к ММП-1 и ММП-13. Коллагеназы рассекают все три пептидные α- цепи молекулы нативного коллагена в спиральной области, примерно на 1/4 расстояния от С-конца, между остатками глицина и лейцина (или изолейцина). Образующиеся фрагменты коллагена становятся растворимыми в воде и денатурируют, после чего их пептидные связи становятся доступными для гидролиза другими пептидазами.
Гидролиз коллагенов базальных мембран происходит при участии желатиназ (ММП-2, ММП-9). В связывании желатинов и коллагенов желатиназами участвуют так называемый фибронектиновый домен, присутствующий в структуре N-концевой области фермента.
Два других фермента - стромелизин -1 (ММП-3) и стромелизин - 2 (ММП-10), расщепляют коровые белки протеогликанов и целый ряд адгезивных белков межклеточного матрикса (табл. 1.4).
Таблица 1.4. Семейство матриксных металлопротеиназ
Активность матриксных металлопротеиназ повышается при деструкции межклеточного матрикса, которая наблюдается при целом ряде заболеваний - пародонтите, пульпите, хронических язвах, инвазии и метастазировании опухолей и др.
|
|||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 396; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.150.163 (0.048 с.) |