Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Протеогликаны и гликозаминогликаныСтр 1 из 14Следующая ⇒
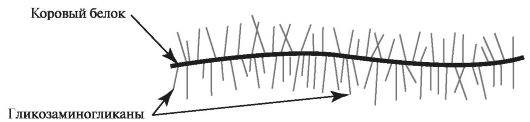
Протеогликаны - класс сложных белков внеклеточного матрикса. Они состоят из различных стержневых (коровых) белков, к которым через N- и О-гликозидные связи присоединены олигосахариды, связанные с цепями гликозамингликанов (рис. 1.15).
Рис. 1.15. Строение протеогликана.
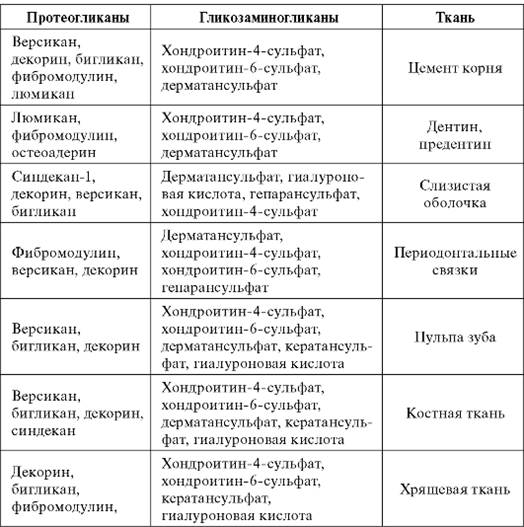
Разные протеогликаны отличаются размерами молекул, относительным содержанием белка и набором гликозаминогликанов. Протеогликаны в больших количествах представлены в дентине, пульпе, цементе, тканях периодонта, слизистых оболочках полости рта (табл. 1.2).
Таблица 1.2 Протеогликаны и гликозаминогликаны в тканях полости рта
Часть протеогликанов - серглицин, матриксный протеогликан хряща, декорин, версикан и др. находятся в растворимом состоянии и локализуются во внеклеточном матриксе. Другие протеогликаны, например, синдекан, представлены трансмембранными интегральными белками. Синдекан имеет внеклеточный трансмембранный и цитоплазматический домены и взаимодействует с актиновым цитоскелетом. Снаружи на клеточной поверхности синдекан связывается с фибронектином и другими компонентами внеклеточного матрикса.
В связывании протеогликанов со специфическими белками участвуют молекулы гликозаминогликанов. Их отрицательно заряженные группы взаимодействуют с положительно заряженными радикалами аминокислот лизина и аргинина, расположенными в определённых областях белковой молекулы. Таким способом связываются высокосульфатированные гликозаминогликаны с фибронектином.
Протеогликаны выполняют функции рецепторов при сборке межклеточного матрикса, облегчают клеточное прикрепление и регулируют процессы роста клеток. Они также могут образовывать комплексы с некоторыми белками, например, факторами роста. В образовавшихся комплексах белки защищены от протеолитических ферментов. Эти комплексы выполняют функцию резервуаров, и только в случае необходимости фактор роста освобождается из них и приобретает способность проявлять свою биологическую активность.
Гликозаминогликаны относятся к гетерополисахаридам. Это линейные структуры, построенные из повторяющихся дисахаридных единиц. Молекула дисахарида состоит из уроновой кислоты и аминосахара, аминогруппа которого обычно ацетилирована. Наличие сульфатных и карбоксильных групп в гликозаминогликанах придает им большой отрицательный заряд и способность связывать воду. Благодаря высокой плотности отрицательного заряда на своей поверхности они связывают катионы Ca2+, Na+, К+ и таким образом принимают участие в минеральном обмене.
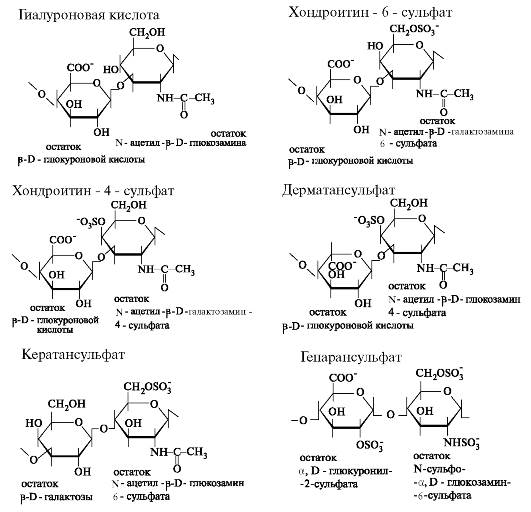
Все гликозаминогликаны делят на 2 группы: сульфатированные и несульфатированные. К несульфатированным гликозаминогликанам относится гиалуроновая кислота. Сульфатированные гликозаминогликаны в свободном виде не встречаются; будучи связаны с небольшим количеством белка, они образуют протеогликаны. Структура дисахаридных единиц, входящих в состав гликозаминогликанов, представлена на рис. 1.16.
Рис. 1.16. Структура повторяющихся дисахаридных единиц в гликозаминогликанах.
Гиалуроновая кислота встречается во многих органах и тканях. Она построена из дисахаридных остатков, соединенных β-(1-4)-гликозидными связями. Дисахаридные фрагменты, в свою очередь, состоят из остатков β-D-глюкуроновой кислоты и N-ацетил-β-D-глюкозамина, связанных между собой β-(1-3)-гликозидными связями. Гиалуроновая кислота имеет высокую мол. массу (Mr 105-107 Да). В ряде органов (стекловидное тело глаза, пупочный канатик, суставная жидкость) она находится в свободном виде, а в хряще формирует протеогликановые агрегаты. В суставной жидкости гиалуроновая кислота играет роль смазочного вещества, уменьшая трение между суставными поверхностями. В процессе развития эмбриона она заполняет межклеточные пространства, облегчая перемещение клеток. В больших количествах гиалуроновая кислота синтезируется во время заживления ран. Связывая воду, она обеспечивает барьерную функцию. Цепи гиалуроновой кислоты способны свертываться, связывая большое количество воды и формируя домен. В этот домен (определенное пространство) имеют доступ небольшие молекулы или ионы, однако крупные молекулы (альбумин, иммуноглобулины) не способны проникать в него. Домены способны контактировать, сжиматься и проникать друг в друга, что и определяет высокую вязкость раствора.
Хондроитинсульфаты содержат повторяющиеся дисахаридные единицы, соединенные β-(1-4)-гликозидными связями. Дисахариды построены из глюкуроновой кислоты и сульфатированного N-ацетилгалактозамина, соединённых между собой β-(1-3)-гликозидными связями. В зависимости от положения сульфатной группы различают хондроитин-4-сульфат и хондроитин-6-сульфат. Одна полисахаридная цепь хондроитинсульфата содержит около 40 повторяющихся дисахаридных единиц. Мол. масса хондроитинсульфатов колеблется от 10 до 600 кДа. Несмотря на минимальные различия в химической структуре, хондроитинсульфаты существенно отличаются по физико-химическим свойствам и распределению в различных видах соединительной ткани. Хондроитин-4-сульфат, преимущественно встречается в составе хрящевой и костной тканей, роговице глаза, а хондроитин-6-сульфат присутствует в сухожилиях, связках, пупочном канатике, а также в костях.
Дерматансульфат - гетерополисахарид, сходный по строению с хондроитинсульфатом. В отличие от последнего дисахаридный фрагмент дерматансульфата содержит вместо D-глюкуроновой кислоты остаток L-идуроновой кислоты. Дерматансульфат присутствует в коже, хрящах, сухожилиях и межпозвонковых дисках, кровеносных сосудах и клапанах сердца. В составе малых протеогликанов (бигликакан и декорин) он содержится в межклеточном веществе костей, хрящей, межпозвоночных дисков и менисков, где участвует в стабилизации коллагеновых волокон.
Кератансульфаты - наиболее гетерогенные гликозаминогликаны; отличаются друг от друга по суммарному содержанию углеводов и распределению в разных тканях. В отличие от всех остальных гликозаминогликанов, кератансульфаты вместо уроновой кислоты содержат остаток D-галактозы. Остатки D-галактозы в дисахаридных фрагментах кератансульфата связаны β-(1-4)-гликозидными связями с остатками N-ацетил-D-глюкозамин-6-сульфата. Между собой дисахаридные фрагменты соединены β-(1-3)-гликозидными связями. Кератансульфат-1 роговицы глаза содержит, кроме повторяющейся дисахаридной единицы, L-фукозу, D-маннозу и сиаловую кислоту. Кератансульфат-2 обнаружен в хрящевой ткани, костях, межпозвоночных дисках. Кератансульфаты входят в состав большого протеогликана - агрекана и некоторых малых протеогликанов хрящевого матрикса.
Гепарансульфат представляет собой гетерополисахарид, построенный из глюкуроновой кислоты и N-ацетилглюкозамина; содержит большее количество N-ацильных групп и меньше сульфатных. Входит в состав протеогликанов базальных мембран и является постоянным компонентом клеточной поверхности.
Большие протеогликаны
К большим протеогликанам относят белки с большой мол. массой, содержащие свыше 100 цепей гликозаминогликанов. В эту группу входят агрекан, версикан, нейрокан, бревикан и др. Их особенностью является способность связываться с коллагенами, гиалуроновой кислотой и образовывать протеогликановые агрегаты.
В цементе, пульпе зуба, слизистой оболочке, костной ткани и коже присутствует большой хондроитинсульфатсодержащий протеогликан - версикан, мол. масса которого около 1000 кДа. Стержневой белок версикана состоит из аминокислотных последовательностей, содержащих остатки глу-гли-фен. Благодаря большому содержанию сульфата, глутаминовой кислоты и связи с гиалуроновой кислотой версикан в гидратированном состоянии занимает значительное по объёму пространство.
Для матрикса хрящевой ткани характерно присутствие другого большого протеогликана - агрекана (см. хрящевую ткань).
Малые протеогликаны
Малые протеогликаны имеют небольшой коровый белок, к которому присоединены 1 или 2 цепи гликозаминогликанов. Среди малых протеогликанов различают протеогликаны, богатые лейцином, протеогликаны, ассоциированные с клетками, и протеогликаны базальных мембран.
Протеогликаны, богатые лейцином. Особенностью малых протеогликанов этого семейства является наличие 9-12 доменов, богатых лейцином в С-концевой области корового белка. Эти домены обладают свойством связывать коллаген. N-концевая область высоко вариабельна в своей аминокислотной последовательности, которая связана с гликозаминогликанами. Домены N-концевой области участвуют во взаимодействиях белков друг с другом и клетками. Белки этого семейства представлены декорином, бигликаном, фибромодулином, люмиканом, остеоадерином, остеоглицином, окулогликаном, оптицином, аспорином.
Малые протеогликаны - фибромодулин, люмикан и остеоадерин в N-концевой области содержат цепи кератансульфата, которые присоединяются к аспарагину, а также сульфатированные остатки тирозина. Фибромодулин - протеогликан с мол. массой около 40 кДа. Показано, что фибромодулин присоединяется к фибриллам коллагена II типа и ограничивает их диаметр. Люмикан по своему строению очень сходен с фибромодулином. Присутствует в межклеточном матриксе мышечной и хрящевой тканей, лёгких, тонкой кишки, роговой оболочки глаза. Предполагается его участие в регуляции образования сетчатой коллагеновой структуры. Остеоадерин - белок с мол. массой 49,1 кДа. Особенностью этого белка является присутствие четырёх сульфатированных остатков тирозина, три из которых располагаются в N-концевой области. В С-концевой области присутствует большое количество отрицательно заряженных аминокислот. Молекула остеоадерина синтезируется зрелыми остеобластами, а также одонтобластами. Он определяется в амелобластическом слое на стадии созревания эмали и участвует в процессах минерализации.
Декорин и бигликан сходны по размерам и структуре, но их синтез находится под контролем различных генов. Мол. масса декорина около 130 кДа, а бигликана - около 270 кДа. Их коровые белки содержат своеобразную 24-аминокислотную последовательность, богатую лейцином, которая тандемно повторяется 10 раз в декорине и 12 раз в бигликане. Бигликан содержит серин в положениях 5 и 11, а декорин в положении 4, что позволяет бигликану присоединять 2 полисахаридные цепи, а декорину - только одну (рис. 1.17). У этих протеогликанов полисахаридные цепи представлены дерматансульфатом. Декорин и бигликан участвуют в межклеточных взаимодействиях, которые могут облегчаться β-структурой в коровом белке. Показано, что декорин и, вероятно, бигликан взаимодействуют с β-трансформирующим фактором роста (ТФР-β).
Рис. 1.17. Доменное строение малых протеогликанов: А - декорин; Б - бигликан; В - фибромодулин.
Локализация декорина совпадает с расположением коллагена. Если назначение бигликана неизвестно, то декорин участвует в связывании с коллагенами I и II типов, а также ингибирует фибринолиз. Кроме того, бигликан и декорин обеспечивают взаимодействия между клетками, эластином и адгезивными белками - фибронектином и ламинином.
|
||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 484; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.129.247.196 (0.019 с.) |