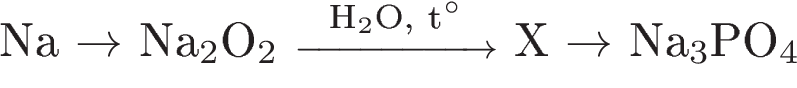Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Техника безопасности. Химия и жизнь.
· В школьной лаборатории есть опасные вещества, поэтому их нельзя смешивать друг с другом в любом порядке. · СО-оксид углерода (II) угарный газ, сильный яд в замкнутом пространстве, угрожающий фактор для здоровья (отравление). · Озоновый слой в стратосфере не вреден для человека, хотя озон сам по себе ядовит. В стратосфере озоновый слой защищает Землю от ультрафиолетовых лучей Солнца. · Производство цемента и других строительных материалов загрязняют окружающую среду. Разлившаяся на поверхности водоёмов нефть вредит живым организмам водоёмов. · Оксиды азота и сернистый газ (отходы производства серной и азотной кислоты), в атмосфере угрожают здоровью человека. Загрязнение воздуха оксидами серы (сернистого газа) вызывает образование кислотных дождей. · Продукты полного сгорания природного газа– углекислый газ и пары воды–не наносят непосредственного ущерба окружающей среде. Некоторые выхлопные газы автомобилей негативно сказываются на состоянии атмосферы. В двигателе внутреннего сгорания идет реакция горения. Самый опасный продукт сгорания автомобильного топлива–не CO2 (углекислый газ), а угарный газ СО и оксиды азота. · Увеличение количества углекислого газа в атмосфере приводит к «парниковому эффекту». Углекислый газ не ядовит, поэтому его повышенное содержание в атмосфере не влияет на жизнь человека. · Неорганические кислоты в промышленных стоках отрицательно влияют на рыб. Ионы тяжелых металлов, содержащихся в овощах, выращенных у дороги, вредят здоровью человека, так же как и избыток удобрений для овощей. · Краска со свинцом на игрушках вредна. Готовить растворы кислот в алюминиевой посуде не рекомендуется. При растворении твёрдой щелочи в воде для перемешивания раствора нельзя использовать алюминиевую ложечку. · Щелочь можно промыть с кожи водой и лимонной кислотой, а кислоту промываем водой и питьевой содой. Пролитые кислоты или щёлочи необходимо засыпать чистым песком. · Дезинфицирующие средства, например, «Доместос» опасны для человека и животных, отходы от моющих средств нельзя выливать в природные водоемы. Растворители и моющие средства, другую бытовую химию, храним в недоступном для детей месте, отдельно от пищевых продуктов, соблюдаем инструкцию при работе с ними.
· Аэрозоли, как средство борьбы против насекомых, опасны для детей и животных, будьте осторожны, нельзя распылять вблизи огня. · При работе с бытовой химией, (с препаратами для ванн и раковин) содержащей щелочь и кислоту нужны резиновые перчатки! Задание 1. Верны ли следующие утверждения об углекислом газе? А. Количество углекислого газа в атмосфере постоянно растёт благодаря деятельности человека. Б. Углекислый газ – самый вредный компонент выхлопных газов. 1) верно только А 2) верно только Б 3) верны оба утверждения 4) оба утверждения неверны Ответ: 1 Тренировочные задания 1. Верны ли суждения о правилах применения и хранения препаратов бытовой химии? А. Аэрозоли, использующиеся в качестве средств для борьбы с бытовыми насекомыми, безопасны для детей и животных. Б. Растворители и моющие средства допускается хранить в доступных для детей местах. 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны 2. Верны ли суждения о правилах применения и опасности для здоровья препаратов бытовой химии? А. Стиральные порошки нельзя использовать для мытья посуды. Б. Работать с хлорсодержащими дезинфицирующими средствами следует при плотно закрытой двери в помещении. 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны 3. Верны ли суждения о правилах применения и хранения препаратов бытовой химии? А. Аэрозоли, использующиеся в качестве средств для борьбы с бытовыми насекомыми, безопасны для детей и животных. Б. Растворители и моющие средства допускается хранить в доступных для детей местах. 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны 4. Верны ли суждения об экологической безопасности? А. Не рекомендуется употреблять в пищу плодоовощные культуры, выращенные вблизи железных дорог и автомобильных магистралей.
Б. Овощные растения, выращенные с использованием избытка минеральных удобрений, не представляют опасности для организма человека. 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны 5. Верны ли суждения об экологической безопасности химических производств? А. Выбросы сернистого газа, образующегося в процессе получения серной кислоты, положительно влияют на здоровье человека, растительный и животный мир. Б. Отходы переработки свинцовых руд не представляют угрозы для окружающей среды и здоровья человека. 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны 6. Верны ли следующие утверждения о воде? А. Водопроводная вода содержит примеси растворимых солей — сульфатов и гидрокарбонатов. Б. Вода обладает памятью, поэтому механические воздействия, например звуковые колебания, меняют её свойства. 1) верно только А 2) верно только Б 3) верны оба утверждения 4) оба утверждения неверны 7. Верны ли следующие утверждения об очистке воды? А. Хлорирование улучшает качество загрязнённой воды, так как хлор убивает бактерии и вирусы. Б. Озонирование воды требует специального контроля, так как озон — сильный яд. 1) верно только А 2) верно только Б 3) верны оба утверждения 4) оба утверждения неверны 8. Верны ли следующие утверждения о выхлопных газах автомобилей? А. Самый вредный компонент выхлопных газов — СО2, так как это парниковый газ. Б. Оксиды азота образуются при взаимодействии автомобильного топлива с азотом воздуха. 1) верно только А 2) верно только Б 3) верны оба утверждения 4) оба утверждения неверны 9. Верны ли суждения о правилах обращения с препаратами бытовой химии? А. Перед использованием застывшую масляную краску рекомендуется подогреть на открытом огне. Б. При использовании органических растворителей во время ремонта, óкна в помещении должны быть плотно закрыты. 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны 10. Верны ли суждения о химическом загрязнении окружающей среды и его последствиях? А. Повышенное содержание в замкнутом пространстве оксида углерода (II) не является угрожающим фактором для здоровья человека. Б. Производство цемента и других строительных материалов не относят к источникам загрязнения атмосферы. 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны Ответы:
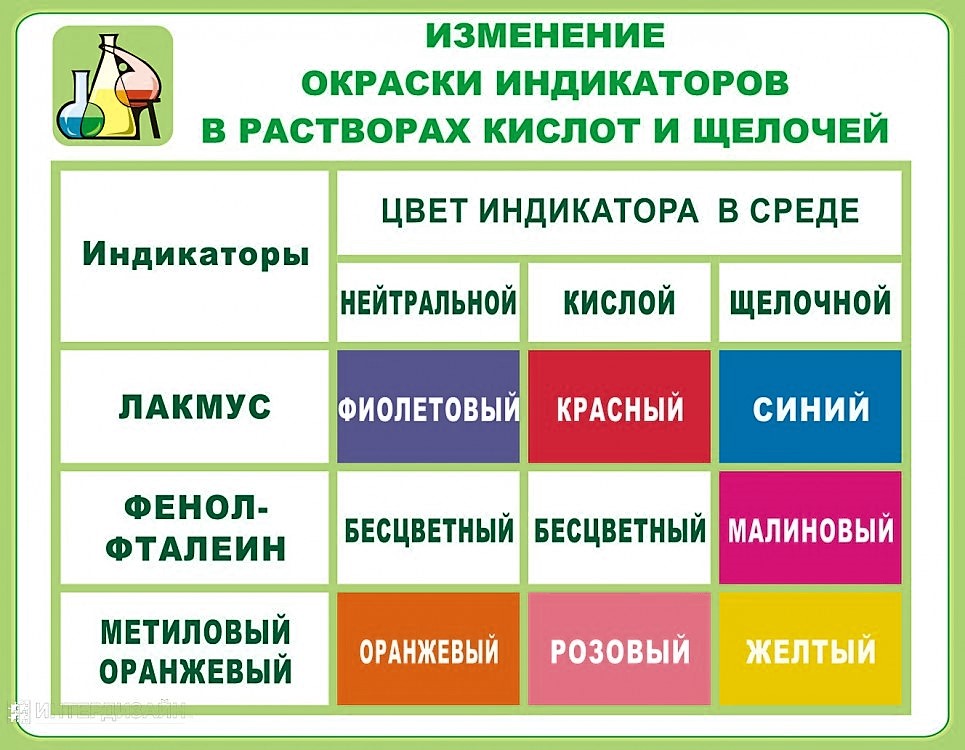
Задание 18 Определение характера среды раствора кислот и щелочей с помощью индикаторов. Качественные реакции на ионы в растворе (хлорид, сульфат-, карбонат, фосфат -, гидроксид – ионы; ионы аммония, бария, серебра, кальция, меди и железа). Получение газообразных веществ. Качественные реакции на газообразные вещества (кислород, водород, углекислый газ, аммиак)
Задание № 18 рассчитано на проверку навыков в области качественного определения неорганических веществ и ионов, умения определять характер среды раствора кислот и щелочей с помощью индикаторов. Перед выполнением предложенных заданий повторите: Некоторые качественные реакции неорганических реакций и изменения, сопровождающие химические превращения
Задание 1. Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества. ВЕЩЕСТВА РЕАКТИВ А) Al (OH)3 (тв.) и KOH (тв.) 1) H 2 O Б) Al (OH)3 (тв.) и BaSO 4 (тв.) 2) KOH В) Br 2 (р-р) и FeCl 3 (р-р) 3) Na 2 SO 4 (р-р) 4) CO 2 (р-р) Ответ: 122
Тренировочные задания 1. Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества. К каждому элементу первого столбца подберите соответствующий элемент из второго столбца. ВЕЩЕСТВА РЕАКТИВ A) Na2CO3 и Na2SiO3 1) CuCl2 Б) K2CO3 и Li2CO3 2) HCl В) Na2SO4 и NaOH 3) MgO 4) K3PO4
2. Установите соответствие между двумя солями и реактивом, с помощью которого можно различить эти соли. ФОРМУЛЫ СОЛЕЙ РЕАКТИВ ДЛЯ КАЧЕСТВЕННОГО АНАЛИЗА А) NaCl и NH4Cl 1) KOH Б) KF и BaBr2 2) Cu(OH)2 В) K2SO4 и Na2CO3 3) AgNO3 4) HCl 3. Установите соответствие между двумя газами и веществом, с помощью которого можно различить эти газы. ФОРМУЛЫ ГАЗОВ ВЕЩЕСТВО ДЛЯ КАЧЕСТВЕННОГО АНАЛИЗА А) CO2 и O2 1) CuO
Б) NH3 и H2 2) раствор Са(ОН)2 В) H2 и O2 3) KMnO4 4) фенолфталеин 4. Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества. ВЕЩЕСТВА РЕАКТИВ А) HCl (р-р) и KOH (р-р) 1) лакмус (р-р) Б) HCl (р-р) и Na2SO4 (р-р) 2) NaOH (р-р) В) KOH (р-р) и Ba(OH)2 (р-р) 3) H2SO4 (р-р) 4) HNO3 (р-р) 5. Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества. ВЕЩЕСТВА РЕАКТИВ А) NaCl и KNO3 1) гидроксид калия Б) Ba(NO3)2 и NaNO3 2) сульфат натрия В) NH4Cl и ZnCl2 3) оксид железа (II) 4) нитрат серебра 6. Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества. ВЕЩЕСТВА РЕАКТИВ А) H2SO4 и Na2SO4 1) соляная кислота Б) KNO3 и Ca(NO3)2 2) карбонат натрия В) NH4Cl и CuCl2 3) медь 4) гидроксид калия
7. Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества. ВЕЩЕСТВА РЕАКТИВ А) HNO3 и HCl 1) соляная кислота Б) K2SO4 и Ba(NO3)2 2) карбонат натрия В) NaCl и NH4Cl 3) медь 4) гидроксид калия 8. Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества. ВЕЩЕСТВА РЕАКТИВ А) Ca(OH)2 и KOH 1) лакмус Б) Ba(NO3)2 и BaCl2 2) нитрат серебра В) HCl и HNO3 3) хлорид натрия 4) карбонат натрия 9. Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества. ВЕЩЕСТВА РЕАКТИВ А) Ba(OH)2 и NaOH 1) фенолфталеин Б) Ca(NO3)2 и BaCl2 2) нитрат серебра В) HCl и KCl 3) цинк 4) сульфат натрия 10. Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества. ВЕЩЕСТВА РЕАКТИВ А) H2SO4 (р-р) и NaOH (р-р) 1) метилоранж Б) HNO3 (р-р) и K2SO4 (р-р) 2) KOH (р-р) В) NaOH (р-р) и Sr(OH)2 (р-р) 3) K3PO4 (р-р) 4) NH3 (р-р) Ответы:
Задание 19 Вычисление массовой доли химического элемента в веществе Задание № 19 рассчитано на проверку умения вычисления массовой доли химического элемента в веществе. Перед выполнением предложенных заданий повторите: Молекулярная масса — масса молекулы, выраженная в атомных единицах массы. Массовая доля (ω) химического элемента — отношение относительной атомной массы данного элемента с учетом всех его атомов в молекуле к относительной молекулярной массе вещества. В формульном выражении это выглядит следующим образом:
ω(э) – массовая доля элемента Ar(э) – относительная атомная масса элемента n – число атомов элемента э в молекуле вещества Mr – относительная молекулярная масса вещества
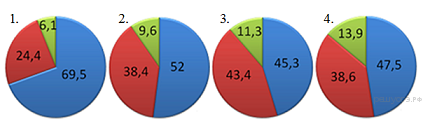
Задание 1. На какой диаграмме распределение массовых долей элементов соответствует количественному составу сульфита натрия?
Ответ: 1 Тренировочные задания 1.На какой диаграмме распределение массовых долей элементов соответствует MgSO4?
2.На какой диаграмме распределение массовых долей элементов соответствует количественному составу сульфата лития?
3.На какой диаграмме распределение массовых долей элементов соответствует количественному составу сульфата железа (II)?
4.На какой диаграмме правильно показаны массовые доли элементов в KNO3?
5.На какой диаграмме распределение массовых долей элементов соответствует MgCO3?
6.Массовая доля кислорода в сульфате алюминия равна 1) 4,7% 2) 12,8% 3) 56,1% 4) 16,0%
7.На какой диаграмме распределение массовых долей элементов соответствует CaCO3?
8.Массовая доля серы в сульфатe железа (III) равна 1) 24,0% 2) 32,0% 3) 8,0% 4) 33,3%
9.Массовая доля углерода в карбонате аммония равна 1) 14,6% 2) 8,3% 3) 4,2% 4) 12,5%
10.На какой диаграмме распределение массовых долей элементов соответствует количественному составу карбоната цинка?
Ответы:
Часть 2 Задание 20 Окислитель. Восстановитель. Окислительно – восстановительные реакции Задание № 20 направлено на проверку умения определять степень окисления химических элементов, окислитель и восстановитель, составлять электронный баланс и на его основе расставлять коэффициенты в уравнении реакции. Перед выполнением предложенных заданий повторите: · Окислительно - восстановительные реакции — это химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем. Алгоритм действий выглядит следующим образом: · Вычисляем изменение степени окисления каждого элемента в уравнении химической реакции; · Выбираем только те элементы, которые поменяли степень окисления; · Для найденных элементов составляем электронный баланс, заключающийся в подсчете количества приобретенных или отданных электронов; · Находим наименьшее общее кратное для переданных электронов; · Полученные значения и есть коэффициенты в уравнении (за редким исключением).
Задание 1. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой: Сu2O + H2SO4 = CuSO4+ SO2 + H2O Определите окислитель и восстановитель. Решение: 1. Cu+1 – 1e→ Cu+2 ½1 Cu +1 - восстановитель S+6 + 2e→ S+4 | 2 S+6 - окислитель С u2O + 3H2SO4 = 2CuSO4+ SO2 + 3H2O
Тренировочные задания 1. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой дана. P +HNO3 →H3PO4 + NO2 + H2O Определите окислитель и восстановитель. 2. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой дана. Zn + H2SO4→ ZnSO4+ H2S + H2O Определите окислитель и восстановитель. 3 Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой дана. FeO + HNO3 → Fe (NO3)3 + NO + H2O Определите окислитель и восстановитель. 4. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой дана. KI + Cu(NO3)2 → CuI + I2 + KNO3 Определите окислитель и восстановитель. 5. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой дана. Mg +H2SO4→ MgSO4 + H 2S + H2O Определите окислитель и восстановитель. 6. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой дана. SO2 + H2S→ S + H2O Определите окислитель и восстановитель. 7. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой дана. Al + Cr2O3 → Al2O3 + Cr Определите окислитель и восстановитель. 8. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой дана. HI + H2SO4 → I2 + H2S + H2 O Определите окислитель и восстановитель. 9. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой дана. P + HNO3→ H3PO4 + NO2 + H2O Определите окислитель и восстановитель. 10. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой дана. HCl + MnO2→MnCl2 + Cl2 + H2O Определите окислитель и восстановитель.
Ответы: 2. P 0 – 5e→ P+5 ½1 P 0 - восстановитель N+5 + 1e→ N+4 | 5 N+5 - окислитель P + 5 HNO 3 = H 3 PO 4 + 5 NO 2 + H 2 O 2. Zn0 – 2e → Zn+2 ½ 4 Zn0 - восстановитель S+6 + 8e → S-2 ½1 S+6 - окислитель 4Zn + 5H2SO4= 4ZnSO4+ H2S + 4H 2O 3. N +5 + 3e → N +2 ½ 1 N +5 - окислитель Fe +2 - 1e → Fe +3 ½ 3 Fe +2 - восстановитель 3FeO +10HNO3 = 3 Fe (NO3)3 + NO + 5H2O 4. Cu+2 +1e → Cu+1 ½ 2 Cu+2 - окислитель 2I-1 -2e → I20 ½ 1 I-1 - восстановитель 4KI + 2Cu(NO3)2 = 2CuI + I2 + KNO3 5. Mg 0 -2e → Mg+2 ½ 4 Mg 0 - восстановитель S +6 +8e →S-2 ½ 1 S +6 - окислитель 4Mg +5H2SO4= 4 MgSO4 + H2S +4H2O 6. S+4 +4e → S0 ½ 1 S+4 - окислитель S-2 -2e → S 0 ½ 2 S-2 - восстановитель SO2 +2H2S = 3S + 2H2O 7. Al 0 - 3e → Al +3 ½ 1 Al 0 – восстановитель Cr +3 +3e → Cr0 ½ 1 Cr +3 - окислитель 2 Al + Cr 2 O 3 = Al 2 O 3 + 2 Cr 8. S+6 +8e → S -2 ½ 1 S+6 - окислитель 2I-1 -2e → I02 ½ 4 I-1 - восстановитель 8HI + H2SO4 = 4I2 + H2S +4H2O 9. P 0 -5e → P +5 ½ 1 P 0 - восстановитель N +5 +1e → N +4 ½ 5 N +5 - окислитель P +5HNO3 = H3PO4 + 5NO2 + H2O 10. Mn+4 +2e → Mn +2 ½ 1 Mn+4 - окислитель 2Cl -1 -2e → Cl20½ 1 Cl -1 - восстановитель 4HCl + MnO2= MnCl2 + Cl2 + 2H2O Задание 21. Взаимосвязь различных классов неорганических веществ. Реакции ионного обмена и условия их осуществления. Задание № 21 направлено на проверку умения составлять реакции на взаимосвязь различных классов неорганических веществ, составлять реакции ионного обмена, записывать полное и сокращенное ионное уравнение. Перед выполнением предложенных заданий повторите: теоретический материал задания № 11
Задание 1. Дана схема превращений: Cu → CuCl2 → Cu(NO3)2 →(t0) X Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции. Ответ: 1. Cu + Cl2 =CuCl2 2. CuCl2 + 2 AgNO3 = 2AgCl↓ + Cu(NO3)2 3. 2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑ 4. Для второй реакции составлено сокращенное ионное уравнение Cl- + Ag+ = AgCl↓
Тренировочные задания 1. Дана схема превращений: Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции. 2. Дана схема превращений: Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции. 3. Дана схема превращений: Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции. 4. Дана схема превращений: Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции. 5. Дана схема превращений: Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции. 6. Дана схема превращений: Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции. 7. Дана схема превращений: Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции. 8. Дана схема превращений: Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции. 9. Дана схема превращений: Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции. 10. Дана схема превращений: Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращенное ионное уравнение реакции.
Ответы: Задание 1.
1) Na2S + FeCl2 = 2NaCl + FeS↓ 2) FeS + 2HCl = H2S↑ + FeCl2 3) 2H2S + 3O2 = 2SO2↑ + 2H2O 4) Составим сокращенное ионное уравнение Fe2+ + S2- = FeS↓
Задание 2.
1) BaO + 2HCl = BaCl2 + H2O 2) BaCl2 + Na2CO3 = BaCO3↓ + 2NaCl 3) BaCO3 + 2HNO3 = Ba(NO3)2 + CO2↑ + H2O 4) Составим сокращенное ионное уравнение Ba2+ + CO32- = BaCO3↓
Задание 3.
1) FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl 2) Fe(OH)3 + 3HBr = FeBr3 + 3H2O 3) FeBr3 + 3KOH = Fe(OH)3↓ + 3KBr 4) Составим сокращенное ионное уравнение Fe3+ + 3OH- = Fe(OH)3↓
Задание 4.
1) 4FeS2 + 11O2 = 2Fe2O3 + 8SO2↑ 2) SO2 + H2O = H2SO3 3) H2SO3 + CaO = CaSO3↓ + H2O 4) Составим сокращенное ионное уравнение H2SO3 + CaO = CaSO3↓ + H2O
Задание 5.
1) FeCl2 + 2KOH = Fe(OH)2↓ + 2KCl 2) Fe(OH)2 + H2SO4 = FeSO4 + 2H2O 3) FeSO4 + Zn = ZnSO4 + Fe 4) Составим сокращенное ионное уравнение Fe2+ +2OH- = Fe(OH)2↓
Задание 6.
1) 2Na + O2 = Na2O2 2) 2Na2O2 + 2H2O = 4NaOH + O2↑ 3) 3NaOH + H3PO4 = Na3PO4 + 3H2O 4) Составим сокращенное ионное уравнение H3PO4 + 3OH- = PO43- + 3H2O
Задание 7.
1) 4NO2 + O2 + 2H2O = 4HNO3 2) HNO3 + NH3 = NH4NO3 3) 2NH4NO3 + Ca(OH)2 = 2NH3↑ + Ca(NO3)2 + 2H2O 4) Составим сокращенное ионное уравнение NH4+ + OH- = NH3↑+ H2O
Задание 8.
1) Al(NO3)3 + 3NaOH = Al(OH)3↓ + 3NaNO3 2) 2Al(OH)3 = Al2O3 + 3H2
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-11; просмотров: 111; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.58.247.31 (0.311 с.) |

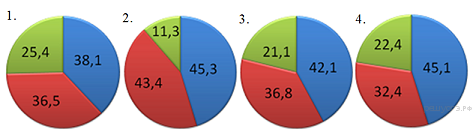

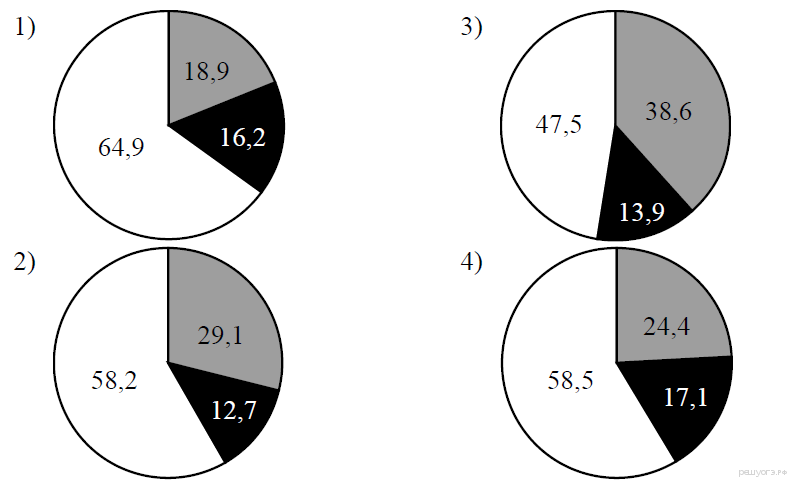
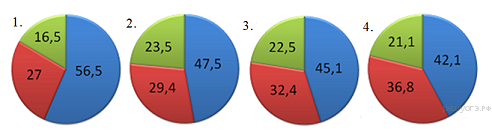
 1) 1 2) 2 3) 3 4) 4
1) 1 2) 2 3) 3 4) 4