Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Закономерность изменения химических свойств элементов и их соединений в группах:
· в группах сверху вниз возрастают металлические свойства элементов; · усиливаются основные свойства их соединений. Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом. Изменения химических свойств элементов и их соединений в периодах: 1) слева направо в периодах радиусы атомов уменьшаются; 2) количество электронов на внешнем слое при этом увеличивается; 3) электроотрицательность элементов = неметаллические свойства усиливаются; Закономерности изменения химических свойств элементов и их соединений в периодах: в периодах слева направо возрастают неметаллические свойства элементов, электроотрицательность, усиливаются кислотные свойства их соединений. Задание 1. Какие два утверждения верны для характеристики как натрия, так и алюминия? 1) Наличие 12 протонов в ядрах их атомов 2) Нахождение валентных электронов в третьем электронном слое 3) Образование простых веществ-металлов 4) Существование в природе в виде двухатомных молекул 5) Образование ими высших оксидов с общей формулой Э2О Ответ: 23 Пояснение: Число протонов равно порядковому номеру элемента, у натрия их 11, у алюминия – 13; металлы существуют в природе в виде одноатомных молекул; алюминий образует оксид с общей формулой Э2О3. Следовательно, правильные ответы – 2,3.
Тренировочные задания 1. Какие два утверждения верны для характеристики как фосфора, так и хлора? 1) Электроны в атоме расположены на трёх электронных слоях; 2) Простое вещество, образуемое химическим элементом, при н. у. является газом; 3) Химический элемент образует высший оксид вида Э2О5; 4) Электроотрицательность химического элемента выше электроотрицательности серы; 5) Химический элемент является p-элементом. 2. Какие два утверждения верны для характеристики как магния, так и кремния?
1) Наличие трёх электронных слоёв в их атомах; 2) Существование соответствующих им простых веществ в виде двухатомных молекул; 3) То, что они относятся к металлам; 4) То, что значение их электроотрицательности меньше, чем у фосфора; 5) Образование ими высших оксидов с общей формулой ЭО2. 3. Какие два утверждения верны для характеристики как хлора, так и брома? 1) В ядре атома химического элемента содержится 17 протонов; 2) Электроны в атоме расположены на трёх электронных слоях; 3) Химический элемент является неметаллом; 4) Соответствующее простое вещество существует в виде двухатомных молекул; 5) Соответствующее простое вещество при н. у. является жидкостью. 4. Какие два утверждения верны для характеристики как серы, так и селена? 1) В ядре атома химического элемента содержится 34 протона; 2) Элемент расположен в VIA группе Периодической системы Д. И. Менделеева; 3) Электроны в атоме расположены на четырёх электронных слоях; 4) В основном состоянии на d-орбитали атома химического элемента есть электроны; 5) Химический элемент образует высший оксид вида ЭО3. 5. Какие два утверждения верны для характеристики как азота, так и кислорода? 1) Атом химического элемента имеет 5 валентных электронов; 2) Низшая степень окисления химического элемента равна -3; 3) Соответствующее простое вещество при н. у. является газом; 4) Число протонов в ядре атома химического элемента равно 7; 5) Электроотрицательность химического элемента выше, чем у углерода. 6. Какие два утверждения верны для характеристики как натрия, так и калия? 1) Электроны в атоме расположены на четырёх электронных слоях; 2) Соответствующее простое вещество — металл; 3) Является s-элементом; 4) Число протонов в ядре атома химического элемента равно 11; 5) Число нейтронов в ядре атома (наиболее распространённого изотопа) химического элемента равно 12. 7. Какие два утверждения верны для характеристики как фосфора, так и кремния? 1) Имеет 4 валентных электрона; 2) Электроны в атоме расположены на трёх электронных слоях; 3) Химический элемент образует высший оксид вида ЭО2;
4) Является p-элементом; 5) Число протонов в ядре атома химического элемента равно 14. 8. Какие два утверждения верны для характеристики как магния, так и кальция? 1) Число нейтронов в ядре атома (наиболее распространённого изотопа) химического элемента равно 12; 2) Электроны в атоме расположены на трёх электронных слоях; 3) Химический элемент имеет 2 валентных электрона; 4) Число протонов в ядре атома химического элемента равно 12; 5) Химический элемент является металлом. 9. Какие два утверждения верны для характеристики как алюминия, так и индия? 1) Химический элемент имеет 3 валентных электрона; 2) Электроны в атоме расположены на трёх электронных слоях; 3) Металлические свойства химического элемента сильнее, чем металлические свойства галлия; 4) Химический элемент является металлом; 5) Число протонов в ядре атома химического элемента равно 49. 10. Какие два утверждения верны для характеристики как углерода, так и кремния? 1) Химический элемент образует летучее водородное соединение вида ЭН4; 2) Простое вещество, образуемое химическим элементом, имеет несколько аллотропных модификаций; 3) Электроны в атоме расположены на трёх электронных слоях; 4) Число нейтронов в ядре атома (наиболее распространённого изотопа) химического элемента равно 12; 5) Число протонов в ядре атома химического элемента равно 14.
Ответы
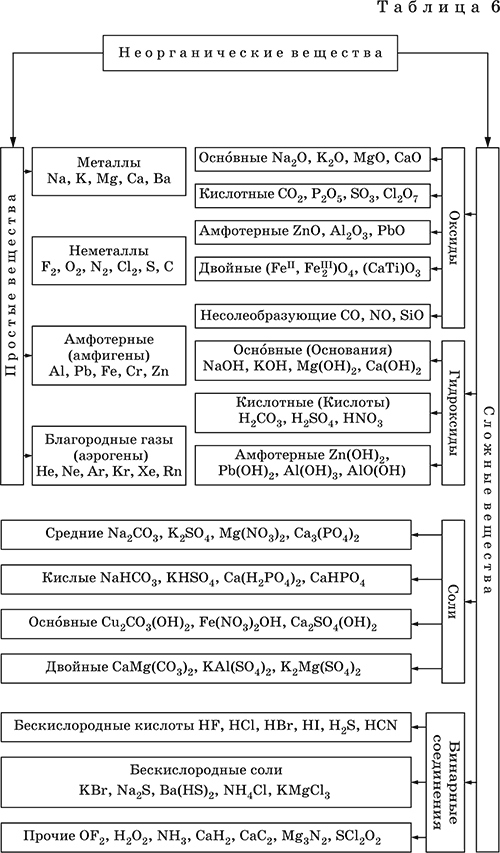
Задание 7. Основные классы неорганических веществ. Задание № 7 рассчитано на проверку навыков в области классификации неорганических соединений по всем известным классификационным признакам, знаний номенклатуры неорганических веществ. Перед выполнением предложенных заданий повторите: Простые вещества образованы атомами одного химического элемента (водород Н2, азот N2, железо Fe и т.д.), сложные вещества - атомами двух и более химических элементов (вода H2O – состоит из 2 элементов (водород, кислород), серная кислота H2SO4 – образована атомами 3 химических элементов (водород, сера, кислород)). Оксиды – сложные вещества, состоящие из двух элементов, один из которых кислород в степени окисления -2. Если оксид образован химическим элементом с переменной валентностью, то после названия элемента, нужно указать его валентность. Точно установить характер оксида можно, только изучая его химические свойства. Например, кислотные оксиды реагируют с основаниями и не реагируют с кислотами. Основные оксиды реагируют с кислотами и не реагируют с основаниями. Амфотерные оксиды могут реагировать и с кислотами, и с основаниями, причём, реагируя с кислотами, они проявляют свойства основных оксидов, а реагируя с основаниями, — кислотных. Основания — сложные вещества, которые состоят из иона металла (или иона аммония) и гидроксогруппы (-OH). Основания делят на растворимые в воде (щёлочи) и нерастворимые в воде. Кислоты — это сложные вещества, в состав молекул которых входит активный атом водорода и кислотный остаток. Этот активный атом водорода в химических реакциях способен замещаться на атом металла, в результате чего всегда получается соль. В химических формулах органических кислот атом водорода стоит в конце, например, СН3СООН – уксусная кислота.
Соли – сложные вещества, образованные атомами металлов, соединёнными с кислотными остатками. В состав некоторых солей входят атомы водорода или группы ОН. Такое различие подсказывает, что соли могут быть разных типов.
Задание 1. Изпредложенногоперечня выберите амфотерный гидроксид и соль. 1) Al2O3 2) Al(OH)3 3) H3PO4 4) PH3 5)(NH4)3PO4 Запишите в поле ответа сначала номер амфотерного гидроксида, а затем номер соли. Ответ: 25 Тренировочные задания: 1. Изпредложенногоперечня выберите кислотный оксид и кислоту. 1) NaNO3 2) NaOH 3) SiO2 4) HNO3 5) SiH4 Запишите в поле ответа сначала номер кислотного оксида, а затем - кислоты. 2. Изпредложенногоперечня выберите кислотный оксид и щелочь. 1) СaO 2) Cu(OH)2 3) CO2 4) NO 5) Ba(OH)2 Запишите в поле ответа сначала номер кислотного оксида, а затем - щелочи. 3. Изпредложенногоперечня выберите соль и основный оксид. 1) СaCO3 2) KOH 3) CO2 4) K2O 5) Fe2O3 Запишите в поле ответа сначала номер соли, а затем номер основного оксида. 4. Изпредложенногоперечня выберите соль и щелочь. 1) H2SO4 2) FeCl2 3) KOH 4) CaO 5) NH3 Запишите в поле ответа сначала номер соли, а затем номер щелочи. 5. Изпредложенногоперечня выберите кислоту и соль. 1) HCl 2) KOH 3) NH4Cl 4) CO2 5) N2O5 Запишите в поле ответа сначала номер кислоты, а затем номер соли. 6. Изпредложенногоперечня выберите кислоту и нерастворимое основание. 1) KOH 2) HCl 3) NaCl 4) P2O5 5) Cu(OH)2 Запишите в поле ответа сначала номер кислоты, а затем номер нерастворимого основания. 7. Изпредложенногоперечня выберите основный оксид и кислоту. 1) CO2 2) Ca(OH)2 3) Na3PO4 4) H3PO4 5) CaO Запишите в поле ответа сначала номер основного оксида, а затем номер кислоты. 8. Изпредложенногоперечня выберите кислотный оксид и основный оксид. 1) K2CO3 2) BaO 3) Ba(OH)2 4) HNO3 5) N2O5 Запишите в поле ответа сначала номер кислотного оксида, а затем номер основного оксида. 9. Изпредложенногоперечня выберите амфотерный оксид и кислоту. 1) Al2O3 2) HBr 3) K2O 4) NaOH 5) CaF2 Запишите в поле ответа сначала номер амфотерного оксида, а затем номер кислоты. 10. Изпредложенногоперечня выберите соль и кислоту. 1) СO2 2) PH3 3) NH4Br 4) H2SO4 5) Ca(OH)2 Запишите в поле ответа сначала номер соли, а затем номер кислоты. Ответы:
Задание 8. Химические свойства простых веществ. Задание № 8 рассчитано на проверку знаний о химических свойствах простых веществ: металлов и неметаллов. Перед выполнением предложенных заданий повторите: · Металлы – сильные восстановители;
· В ряду напряжений восстановительная активность металлов уменьшается; · Металлы, стоящие в ряду напряжений до водорода восстанавливают кислоты – неокислители до водорода; · При взаимодействии HNO3 любой концентрации и H2SO4 (конц.) с металлами водород не выделяется; · Активные металлы образуют с водой растворимое основание и водород; · Более активные металлы вытесняют менее активные из растворов их солей; · Щелочные металлы химически очень активны, легко реагируют с простыми и сложными веществами, в своих соединениях проявляют степень окисления +1; · Щёлочноземельные металлы химически активны; они легко реагируют с простыми и сложными веществами, в своих соединениях проявляют степень окисления +2; · Свойства бериллия и магния несколько отличаются от свойств, характерных для щёлочноземельных металлов. Бериллий по многим свойствам близок к алюминию, а магний — к цинку; · Алюминий пассивируется в воде, концентрированной азотной кислоте из-за образования устойчивой оксидной пленки. Сильный восстановитель; · Неметаллы могут проявлять как окислительные, так и восстановительные свойства; · Неметаллы взаимодействуют с металлами; · Неметаллы взаимодействуют между собой, более электроотрицательный играет роль окислителя, менее электроотрицательный – роль восстановителя. Задание 1. С медью не реагирует 1) хлорид железа (II) (р-р) 2) серная кислота (конц.) 3) кислород 4) хлор Ответ: 1 2. Не реагируют друг с другом 1) хлор и водород 2) кислород и кальций 3) азот и вода 4) железо и сера Ответ: 3 Тренировочные задания 1. Железо реагирует с 1) хлоридом кальция 2) бромом 3) оксидом натрия 4) гидроксидом натрия 2. Хлор реагирует с 1) азотной кислотой 2) сульфатом алюминия 3) кислородом 4) бромидом кальция 3. Фосфор реагирует с 1) аммиаком 2) оксидом углерода (IV) 3) хлором 4) соляной кислотой 4. С каждым из веществ — KOH, HCl, AgNO3 — взаимодействует 1) Mg 2) Fe 3) Al 4) Cu 5. Какой из указанных металлов вступает в реакцию с соляной кислотой? 1) серебро 2) золото 3) алюминий 4) медь 6. С растворами гидроксида натрия и соляной кислоты взаимодействует 1) Ag2) Al3) Fe4) Mg 7. Кислород реагирует с1) FeCl3 2) SO2 3) CO2 4) NaOH 8. С медью не реагирует 1) хлорид железа (II) (р-р) 2) серная кислота (конц.) 3) кислород 4) хлор 9. Водород не реагирует с 1) оксидом меди (II) 2) хлором 3) гидроксидом натрия 4) кислородом 10. В реакцию с водой при комнатной температуре вступают оба вещества пары 1) кислород и углерод 2) магний и сера 3) алюминий и фосфор 4) натрий и кальций Ответы:
Задание 9. Химические свойства оксидов.
Задание № 9 рассчитано на проверку знаний о неорганических соединениях (оксидах) и их химических свойствах, умения определять с какими веществами указанные соединения вступают в реакции. Перед выполнением предложенных заданий повторите: Кислотные оксиды реагируют с основными оксидами с образованием солей; с основаниями, с образованием солей и воды или кислых солей, а также с водой, в том случае если образующаяся в ходе такой реакции кислота растворима в воде: SiO2 + CaO = CaSiO3 SiO2 + 2NaOH = Na2SiO3 + H2O SO3 + NaOH = NaHSO4 SO3 + 2NaOH = Na2SO4 + H2O SO3 + H2O = H2SO4 Кроме того, кислотные оксиды вступают в окислительно-восстановительные и обменные реакции: 2SO2 + O2 = 2SO3 SiO2 + 4HF = SiF4↑ + 2H2O SiO2 + Na2CO3 = Na2SiO3 + CO2↑ Характерные химические свойства основных оксидов: реакции с кислотными оксидами с образованием солей и с кислотами с образованием солей и воды, например: 3MgO + P2O5 = Mg3(PO4)2 MgO + H2SO4 = MgSO4 + H2O Некоторые основные оксиды реагируют с водой с образованием оснований. Эта реакция проходит в том случае, если продукт реакции растворим в воде: Na2O + H2O = 2NaOH В аналогичных условиях, например, оксид железа (II) с водой реагировать не будет, так как гидроксид железа (II) в воде нерастворим. Амфотерные оксиды взаимодействуют как с кислотами, так и с основаниями с образованием солей и воды или комплексных соединений: ZnO + 2HBr = ZnBr2 + H2O Cr2O3 + 2KOH = 2KCrO2 + H2O Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4] Кроме того, амфотерные оксиды могут взаимодействовать как с кислотными, так и с основными оксидами, например: Al2O3 + Na2O = 2NaAlO2 Al2O3 + 3N2O5 = 2Al(NO3)3 С водой амфотерные оксиды не взаимодействуют. Задание 1. В реакцию с оксидом алюминия вступает: 1) Cu(OH)2 2) HNO3 3) O2 4) Be(OH)2 Ответ: 2 Тренировочные задания 1. C оксидом алюминия взаимодействует каждое из двух веществ 1) С и СO2 2) N2 и H2O 3) HCl и NaOH 4) H2SO4 и CuSO4 2.Превращение FeO в Fe2O3 происходит под действием: 1) кислорода 2) алюминия 3) углерода 4) хлора 3.Среди веществ HCl, KOH, H2O, SO3 в реакцию оксидом кальция вступает (-ют) 1) только HCl 2) HCl, KOH 3) HCl, SO3, H2O 4) все перечисленные вещества 4. Между собой могут реагировать два оксида 1) ZnO и K2O 2) N2O и MgO 3) MgO и Li2O 4) CO2 и SO3 5.Оксид углерода (IV) реагирует с каждым из двух веществ 1) S и SO2 2) CaO и KOH 3) H2O и HCl 4) Mg и MgCl2 6. Химическая реакция возможна между: 1) оксидом кальция и кислородом 2) оксидом серы (VI) и оксидом кремния 3) оксидом бария и водой 4) оксидом углерода (IV) и оксидом фосфора (V) 7. Оксид цинка реагирует реагирует с каждым из двух веществ 1) H2O и K2O 2) HCl и Cl2 3) NaOH и HCl 4) Cu и SiO2 8. Оксид серы (VI) реагирует с 1) оксидом кремния 2) бромом 3) оксидом кальция 4) нитратом меди (II) 9.Оксид меди (II) не реагирует с 1) оксидом углерода (IV) 2) соляной кислотой 3) азотом 4) водородом 10.Какое из указанных веществ вступает в реакцию с оксидом фосфора (V)? 1) оксид азота (II) 2) сера 3) оксид углерода (IV) 4) вода Ответы:
Задание 10. Химические свойства простых и сложных неорганических веществ. Задание № 10 рассчитано на проверку знаний о неорганических соединениях и их химических свойствах, умения определять с какими веществами указанные соединения вступают в реакции. Перед выполнением предложенных заданий повторите:
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-11; просмотров: 223; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.183.1 (0.106 с.) |