
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Непредельные карбоновые кислоты
-карбоновые кислоты, образованные от непредельных углеводородов (алкенов, алкинов, алкадиенов). Примеры непредельных кислот: Н2С= СН – СООН – акриловая, пропен-2-овая кислота
СН3 Н3С – СН= СН – СООН – кратоновая, бутен-2-овая кислота Виды изомерии: 1. изомерия углеродного скелета 2. местоположение кратной связи в молекуле 3. пространственная изомерия Н Н
СООН СН3 циссизакратоновая
Н СН3
СООН Н трансизократоновая
Физические свойства: на примере акриловой кислоты: жидкость с резким запахом, неограниченно растворима в воде, температура кипения 141 °С, плотность 1,05 г/мл.
Способы получения:
Схема реакции Н2С=СН – СН2 – ОН + [O] → Н2С=СН – СОН + [O] → Н2С=СН – СООН аллиловый спирт акриловая кислота
t
кратоновая ОН 3-оксибутановая кислота
Химические свойства: Для непредельных карбоновых характерны реакции присоединения по месту кратной связи
t, Ni, Pt Н2С=СН – СООН + Н2 → Н3С – СН – СООН акриловая пропановая
акриловая Вr Вr 2,3 – дибромпропановая 3. Взаимодействие с галогеноводородами Происходит не по правилу Марковникова. Формулировка правила: в реакциях алкенов с различными реагентами Н— X (где X — это Сl, Вr, ОН, OR) водород присоединяется к тому атому углерода при двойной связи, с которым связано больше атомов водорода. Однако при наличии в веществе электроноакцепторного заместителя (функциональной группы, оттягивающей на себя электронную плотность) более стабильным оказывается первичный карбокатион, и правило Марковникова не выполняется:
Владимир Васильевич Марковников.
Н2С=СН – СООН + НВr → H2C – CH2 - COOH
Br 3- бромпропановая кислота 4. Окисление: Н3С – СН=СН – СООН + [O] + Н2О → Н3С – СН – СН – СООН
ОН ОН 2,3 – диоксибутановая
t Н3С – СН=СН – СООН + 4[O] → Н3С – СООН + НООС – СООН уксусная кислота щавелевая кислота 5. Полимеризация:
СООН СООН акриловая полиакриловая
6. Для непредельных карбоновых кислот характерны все реакции, протекающие в группе -СООН.
АРОМАТИЧЕСКИЕ КАРБОНОВЫЕ КИСЛОТЫ
Простейшая ароматическая кислота- бензойная СООН - бесцветное кристаллическое вещество, Способы получения:
СН3 + О2 → СООН
С6Н5ССl + 3 NаОН → С6Н5СООН + NаСl + Н2О
Химические свойства: 1. Взаимодействие с галогенами: FeCl3 СООН + Вr 2 → COOH + HBr
3-бромбензойная кислота
2. Взаимодействие с минеральными кислотами: t, H2SO4 СООН + НNO3 → COOH + H2О
3-нитробензойная кислота
۩ Интересно знать Впервые образование блестящих шелковистых кристаллов наблюдал при сухой перегонке смол алхимик Андреас Либавий. Оказалось, что это бензойная кислота C6H5COOH — вещество, в холодной воде плохо растворимое, а в горячей — хорошо. Сама кислота и её сложные эфиры входят в состав многих эфирных масел (например, гвоздичного) и бальзамов. Содержащие бензойную кислоту ягоды брусники и клюквы могут долго храниться, поскольку почти не подвержены гниению. Дело в том, что бензойная кислота убивает болезнетворные бактерии, вызывающие гниение. Благодаря этому свойству, а также нетоксичности бензойную кислоту и её соли (например, бензоат натрия) активно используют в качестве консерванта в пищевой промышленности — добавляют во фруктовые соки, соусы, джемы, безалкагольные напитки.
При охлаждении горячего раствора бензойная кислота выделяется в виде игольчатых кристаллов. Бензойная кислота содержится в бензойной смоле, в эфирных маслах, особенно её много в клюкве и бруснике.
Как кислота, так и её соль – бензоат натрия является консервирующим вешеством, оказывает менее вредное действие на организм по сравнению с другими консервантами. Эти вещества оказывают сильное бактерицидное действие на дрожжи и другие виды микроорганизмов, подавляет жизнедеятельность бактерий масляного и уксуснокислого брожения, тем самым позволяет предотвратить микробиальную порчу продуктов питания в процессе их приготовления и хранения; увеличить срок хранения пищевых продуктов в несколько раз. Применяются для консервирования маргарина, плодово-ягодных полуфабрикатов, повидла, мармелада, кондитерских изделий, напитков, рыбных пресервов. Бензоат натрия (Е 211) используется в виде водного раствора, который добавляют к продукту и хорошо перемешивают. Стадия внесения консерванта в продукт определяется технологией его производства. Оксибензойная кислота- это салициловая кислота.
СООН + → СООН + СН3СООН
салициловая кислота ацетилсалициловая кислота
|
||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 73; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.200.35 (0.022 с.) |
 Н2С= С – СООН – α- метилакриловая, 2-метилпропен-2 овая кислота
Н2С= С – СООН – α- метилакриловая, 2-метилпропен-2 овая кислота

 Н3С – СН – СН2 – СООН → Н3С – СН=СН – СООН + Н2О
Н3С – СН – СН2 – СООН → Н3С – СН=СН – СООН + Н2О
 n Н2С= СН → (- СН2 – СН -)n
n Н2С= СН → (- СН2 – СН -)n мало растворимо в холодной и довольно легко в горячей воде, температура кипения 249 °С.
мало растворимо в холодной и довольно легко в горячей воде, температура кипения 249 °С.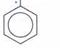


 - Br
- Br 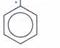
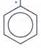 - NO2
- NO2 

 -ОН
-ОН 
 - О – О – С – СН3
- О – О – С – СН3


