
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реакция «серебряного зеркала»
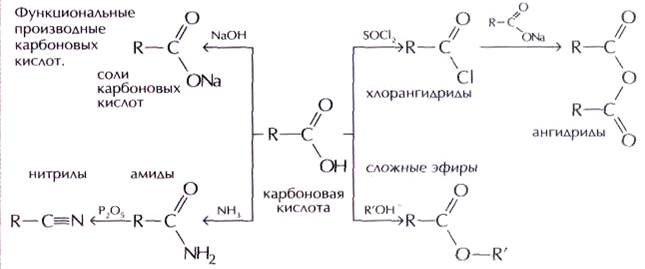
Схема химических свойств карбоновых кислот:
Карбоновые кислоты изменяют цвет индикаторов:
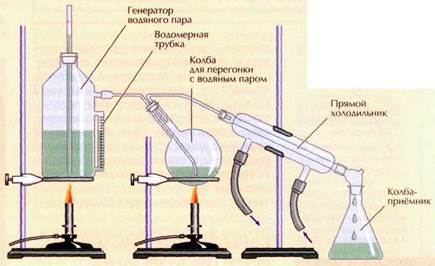
(красный) (бесцветный) Отдельные представители: НСООН – муравьиная кислота. В 1670 г. английский ботаник и зоолог Джон Рей (1627—1705) провёл необычный эксперимент. Он поместил в сосуд рыжих лесных муравьев, налил воды, нагрел её до кипения и пропустил через сосуд струю горячего пара. Такой процесс химики называют перегонкой с паром и широко используют для выделения и очистки многих органических соединений. После конденсации пара Рей получил водный раствор нового химического соединения. Оно проявляло типичные свойства кислот, поэтому и было названо муравьиной кислотой (современное наименование — метановая). Названия солей и эфиров метановой кислоты — формиатов — также связаны с муравьями (лат. formica — «муравей»). Впоследствии энтомологи — специалисты по насекомым (от греч. «энтомон» — «насекомое» и «логос» — «учение», «слово») определили, что у самок и рабочих муравьев в брюшках есть ядовитые железы, вырабатывающие кислоту. У лесного муравья её примерно 5 мг. Кислота служит насекомому оружием для зашиты и нападения. Вряд ли найдётся человек, который не испытал их укусов. Ощущение очень напоминает ожог крапивой, ведь муравьиная кислота содержится и в тончайших волосках этого растения. Вонзаясь в кожу, они обламываются, а их содержимое болезненно обжигает. Муравьиная кислота есть также в пчелином яде, сосновой хвое, гусеницах шелкопряда, в небольших количествах она найдена в различных фруктах, в органах, тканях, выделениях животных и человека. В XIX в. муравьиную кислоту (в виде натриевой соли) получили искусственно действием оксида углерода(II) на влажную щёлочь при повышенной температуре: NaOH + СО® HCOONa. И наоборот, под действием концентрированной серной кислоты муравьиная кислота распадается с выделением газа: НСООН® СО+Н2О. Эта реакция используется в лаборатории для получения чистого СО. При сильном нагревании натриевой соли муравьиной кислоты — формиата натрия — идёт совсем другая реакция: углеродные атомы двух молекул кислоты как бы сшиваются и образуется оксалат натрия — соль щавелевой кислоты: 2HCOONa® NaOOC—COONa + Н2.
Важное отличие муравьиной кислоты от других карбоновых кислот в том, что она, как обладает одновременно свойствами и кислоты, и альдегида: в её молекуле с одной «стороны» можно увидеть кислотную (карбоксильную) группу —СО—ОН, а с другой — тот же атом углерода, входящий в состав альдегидной группы Н—СО— Поэтому муравьиная кислота восстанавливает серебро из его растворов — даёт реакцию «серебряного зеркала», которая характерна для альдегидов, но не свойственна кислотам. ۩ Интересно знать Муравьиная кислота — самая простая и при этом сильная карбоновая кислота, она в десять раз сильнее уксусной. Когда немецкий химик Юстус Либих впервые получил безводную муравьиную кислоту, оказалось, что это очень опасное соединение. При попадании на кожу оно не только жжёт, но и буквально растворяет её, оставляя трудно заживающие раны. Как вспоминал сотрудник Либиха Карл Фогт (1817—1895), у него на всю жизнь остался шрам на руке — результат «эксперимента», проведённого совместно с Либихом. И неудивительно — впоследствии обнаружилось, что безводная муравьиная кислота растворяет лаже капрон, найлон и прочие полимеры, которые не берут разбавленные растворы других кислот и щелочей. Неожиданное применение муравьиная кислота нашла при изготовлении так называемых тяжёлых жидкостей — водных растворов, в которых не тонут даже камни. Такие жидкости нужны геологам для разделения минералов по плотности. Муравьиная кислота обладает сильными бактерицидными свойствами. Поэтому её водные растворы используют как пищевой консервант, а парами дезинфицируют тару для продовольственных товаров (в том числе винные бочки), уничтожают пчелиных клешей. Слабый водно-спиртовой раствор муравьиной кислоты (муравьиный спирт) применяют в медицине для растираний. Для получения муравьиной кислоты используют специальный прибор:
Современный вид прибора для перегонки с водяным паром.
- бесцветная жидкость с острым запахом Физические свойства уксусной кислоты
В уксусе, который образуется при прокисании вина, содержится около 5% уксусной кислоты (столовым уксусом называют 3—15-процентный раствор). Перегонкой такого уксуса получают уксусную эссенцию — раствор с концентрацией уже 70—80%. А чистая (100-процентная) уксусная кислота выделяется в результате воздействия концентрированной серной кислоты на ацетаты: CH3COONa+H2SO4 (конц.) → CH3COOH+NaHSO4 Такая чистая уксусная кислота, не содержащая воды, при охлаждении до 16,8 °С превращается в прозрачные кристаллы, напоминающие лёд. Вот почему её иногда называют ледяной.
В течение многих столетии главным методом синтеза уксусной кислоты было брожение. Таким способом и сейчас производят пищевой уксус. А для производства сложных эфиров и искусственных волокон в качестве сырья используют кислоту, которая получается при каталитическом окислении углеводородов, например бутана:
СН3—СН2—СН2—СН3 + 2,5 О2 ® 2СН3—СООН + Н2О
Яблочный уксус: содержит 20 важнейших минеральных веществ и микроэлементов, а также уксусную, молочную, лимонную кислоты, ферменты, аминокислоты, поташ, пектин. Применяется для приготовления различных блюд и консервировании, прекрасно сочетается со всевозможными салатами, как из свежих овощей, так и мясными и рыбными. В нём можно мариновать мясо, огурцы, капусту, каперсы. Также применяется при повышенном кровяном давлении, мигренях, астме, голово-кружении, артрите, болезнях почек, высокой температуре, ожогах и т.д. Здоровым людям рекомендуется каждый день употреблять полезный и освежающий напиток: в стакане воды размешать ложку мёда и добавить столовую ложку яблочного уксуса. Желающим похудеть, рекомендуется каждый раз во время еды выпивать стакан воды с 2 ложками яблочного уксуса.
Виноградный уксус: в Словении его традиционно используют при приготовлении различных салатов, хорошо сочетается с различными рыбными салатами и блюдами из морских продуктов. При приготовлении шашлыков виноградный уксус просто незаменим.
Аспирин - уксусный эфир салициловой кислоты- ацетилсалициловая кислота.
О имеет запах груши, поэтому используется при производстве фруктовых вод и десертов.
|
||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 280; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.188.64 (0.012 с.) |
|||||||||||||||||||||||||||||||||||||


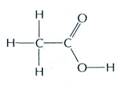 – уксусная кислота.
– уксусная кислота. Сходство не только внешнее: в кристаллах молекулы уксусной кислоты, подобно молекулам воды, образуют систему водородных связей. Межмолекулярное взаимодействие оказывается настолько прочным, что даже в парах уксусной кислоты содержатся не отдельные молекулы, а их агломераты. Жидкая при комнатной температуре ледяная уксусная кислота при охлаждении ниже 1 7 °С превращается в бесцветные кристаллы, действительно похожие на лёд.
Сходство не только внешнее: в кристаллах молекулы уксусной кислоты, подобно молекулам воды, образуют систему водородных связей. Межмолекулярное взаимодействие оказывается настолько прочным, что даже в парах уксусной кислоты содержатся не отдельные молекулы, а их агломераты. Жидкая при комнатной температуре ледяная уксусная кислота при охлаждении ниже 1 7 °С превращается в бесцветные кристаллы, действительно похожие на лёд.
 Уксусноизоамиловый эфир – СН3 – С – О – С5Н11 –
Уксусноизоамиловый эфир – СН3 – С – О – С5Н11 –


