
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Предельные одноатомные спиртыСтр 1 из 8Следующая ⇒
ОПОРНЫЙ КОНСПЕКТ По теме: «СПИРТЫ» Спирты - это производные углеводородов, содержащие в молекуле 1 или несколько гидроксильных групп –ОН у насыщенных атомов углерода.
Общая формула: R – (ОН)n
Классификация: · По строению радикала:
Например, СН3ОН- метанол
Например, СН2= СН – СН2ОН – аллиловый, пропен-2-ол-1 НС=С – СН2ОН – пропангиловый, пропин-2-ол-1
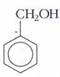
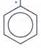
Например, бензиловый спирт
· По количеству групп –ОН:
1. Одноатомные (n=1) Например, СН3 – СН2 – ОН - этиловый спирт, этанол 2. Двухатомные (n=2)
ОН ОН 3. Трёхатомные (n=3)
ОН ОН ОН
Например, СН2ОН – (СНОН)4 – СН2ОН – сорбит
! АТОМНОСТЬ определяется количеством групп –ОН.
1. первичный: СН3 – (СН2)3 – ОН – бутанол-1
ОН 3. третичный: СН3
СН3 – С – СН3 – 2- метилпропанол-2
ОН
Химические свойства: Н Н – С – Н – Оδ- … Нδ+
Н Кислород более электроотрицателен, чем водород, поэтому электронная плотность смещается от водорода к кислороду О ← Н. На атоме кислорода накапливается частично отрицательный заряд, а на атоме водорода – положительный. Т.к. спирты содержат группу ОН, то они должны проявлять основные свойства, а т.к. электронная плотность смещается от водорода к кислороду О ← Н – Н+ , то - кислотные
Реакции, доказывающие, что спирты могут реагировать как кислоты: 1. Замещение на атом металла: 2С2Н5ОН + 2 Nа → 2 С2Н5ОNа + Н2 ↑ – качественная реакция
этилат натрия Натрий реагирует с этиловым спиртом не так энергично, как с водой, поэтому спирт часто используют в лаборатории для уничтожения остатков натрия.
Соли спиртов называются алкоголятами.
2. Замещение на радикал – дегидратация: Н2 S О4, t >140°С С2Н5ОН + С2Н5ОН → С2Н5 – О - С2Н5 + Н2О диэтиловый эфир С2Н5ОН + Н2SО4 → С2Н4 + Н2О + Н2SО4 конц. 3. Этерификация (от лат ether - эфир) t >140°С С2Н5ОН + НОSО3Н ↔ Н3С – СН2 – О – SО3Н + Н2О гидролиз этиловый эфир сложных эфиров серной кислоты Реакции, доказывающие, что спирты могут реагировать как основания:
1. Замещение на атом галогена: к-та, t С2Н5ОН + НВr → C2Н5Вr + Н2О бромэтан 2. Отщепление группы ОН: Н2 S О4, t =170°С С2Н5ОН → Н2С=СН2 + Н2О
Реакции, происходящие в радикале: Вr
Вr трибромэтан (нарколан) 2. Качественная реакция на метанол: СН3 – СН2 – ОН + I2 → CH3COH + 2HI йодная
CH3COH + 3I2 → CI3COH + 3HI
CI3COH + NaOH → CHI3 ↓+ HCOONa водный йодоформ раствор (осадок жёлтого цвета)
Окисление: 1. первичных спиртов: С2Н5ОН + [O] → СН3СОН + Н2О ацетальдегид 2. вторичных спиртов: t СН3 – СН – СН3 + [O] → СН3 – С – СН3 + Н2О
ОН О ацетон 3. третичных спиртов: СН3
СН3 О ацетон Горение: t С2Н5ОН + 3О2 → 2СО2 ↑ + 3Н2О Отдельные представители МЕТАНОЛ СН3ОН - бесцветная жидкость с характерным запахом, температура кипения 64,7 °С. Второе название – древесный спирт, т.к. получают перегонкой древесины. Яд! При попадании внутрь повреждают сетчатку глаза, вызывают гибель зрительного нерва и потерю зрения. Доза до 20 мл смертельна. Виной тому — ещё более ядовитый формальдегид СН2О, который образуется в организме при окислении метанола. Как ни странно, но при отравлении метанолом противоядием служит... этиловый спирт. Дело в том, что в организме различные спирты превращаются в альдегиды под действием одного и того же фермента — алкогольдегидрогеназы, отщепляющей от алкоголя водород. Это вещество используется в производстве ядохимикатов и лекарственных препаратов.
ЭТАНОЛ С2Н5ОН – бесцветная жидкость с характерным запахом, температура кипения 73,8 °С. Второе название – винный спирт. Горюч. Смешивается с водой в любых соотношениях. «Чистый спирт» - 96 %-ный. Формула винного, или этилового, спирта (этанола) С2Н5ОН, несомненно, знакома многим даже совершенно далёким от химии людям. Это соединение, которое образуется при ферментативном брожении крахмала, глюкозы и фруктозы, в быту называют просто спиртом. Получение вина путём сбраживания виноградного сока было освоено людьми уже несколько тысячелетий назад. Однако чистый спирт, содержащий лишь незначительное количество воды, выделили при перегонке вина только в XIII в. В Средние века стали известны многие свойства винного спирта, например горючесть (одно из его латинских названий — aqua ardens, что в переводе означает «огненная вода») и способность извлекать из листьев, плодов и кореньев содержащиеся в них биологически активные вещества и красители (полученные растворы в быту называют настойками). Алхимик Арнальдо из Вилановы упоминает спирт в числе медикаментов и противоядий. Слово «спирт» происходит от древнего латинского названия этого вещества — spiritus vini («дух вина»). Этот термин до сих пор используется в медицине при записи рецептов. В XVI в. в западноевропейских языках, а в XVIII в. и в русском у винного спирта появилось новое название — алкоголь (араб. «ал-кугул»). Безводный (абсолютный) этиловый спирт был впервые получен лишь в 1796 г. российским химиком Товием Егоровичем Ловицем и немецким учёным Иеремией Вениамином Рихтером. Для этой цели они применяли вещества, связывающие воду, например оксид кальция (негашёную известь). Абсолютный спирт легко поглощает влагу воздуха, поэтому его хранят в плотно закрытых сосудах.
Метиловый и этиловый спирты могут быть использованы для решения продовольственной проблемы, для приготовления на их основе пищевого продукта, получаемого при помощи одноклеточного белка. Использование метанола в качестве горючего и других производственных целей сопряжено с рядом трудностей, связанных с токсичностью и достаточно высокой летучестью этого вещества. Метанол- сильный яд нервной системы. Он обладает способностью накапливаться в организме. При попадании в организм в количестве 5-10мл (1-2 чайных ложки) метанол вызывает поражение зрительного нерва, приводящее к полной слепоте. Опасность метанола усиливается из-за его свойства с этанолом по внешнему виду и запаху. С2Н5ОН считается наименее токсичным из неразветв-ленных спиртов. Тем не менее С2Н5ОН уносит ежегодно более человеческих жизней, чем любое другое химическое вещество.
В последние десятилетия рост потребления спиртного и его последствия стали глобальной проблемой. Обострились и связанные с этим последствия, т. к. алкоголь не только является мощным криминогенным фактором, но и вызывает рост соматической, неврологических и психологических заболеваний, отрицательно влияет на потомство. Учеными установлено, что нормальный уровень содержания С2Н50Н в организме составляет всего лишь 0,018%. Он обусловлен естественными процессами бактериального брожения в кишечнике, т. е. спирт в организме- это один из отходов внутренних биохимических процессов, который организму приходится непрерывно утилизировать. Следовательно, потребляя алкогольные напитки, человек привносит в организм химическое вещество, которое является в нем лишним даже в самых малых количествах. Тем самым он перегружает системы организма, ответственные за выделения этого вещества, что сказывается на нервной системе и функционировании внутренних органов. При этом наибольшая нагрузка ложится на печень. У большинства пьющих и у всех хронических алкоголиков поражена печень. В ней разрушается 95% поступившего алкоголя. Воздействие алкоголя на клетки печени ведет к излишнему увеличению активности ферментов, что отрицательно сказывается на функционировании клеток. Следует заметить, что этиловый спирт распадается в организме до конечных продуктов СО2 и Н2О лишь в том случае, если количество его невелико (не более 20г. в сутки). Если эта доза превышается, то в организме накапливается избыток как самого этилового спирта, так и продуктов его распада. Это ведет к целому ряду побочных отрицательных эффектов, повышенному образованию жира и накопления его в клетках печени, накоплению перекисных соединений, способные разрушать клеточные мембраны, в результате чего содержимое клетки «вытекает» через образовавшиеся поры, и другим весьма нежелательным явлениям, вся совокупность которых приводит к разрушению печени- циррозу - гибель клеток печени, замену их клетками соединительной ткани. По мнению зарубежных исследователей, такой финал гарантируется человеку, употребляющему более 180 г алкоголя в сутки, а при дозе от 60 до 100 г опасность поражения печени считается достаточно высокой. Психическая и физическая зависимость от этанола сопровождается глубокой перестройкой обменных процессов развитием соматических и неврологических нарушений. Чувствительность человека к токсическому воздействию алкоголя тем выше, чем он моложе. Так, для детей смертельная доза алкоголя около З на 1кг массы тела, для подростков 4-5 г. Подсчитано, что систематическое употребление алкоголя сокращает жизнь на 10 лет, а хронические алкоголики живут в среднем на 10-15 лет меньше людей, не злоупотребляющих спиртными напитками. С точки зрения экологии человека, воздействие алкоголя необходимо рассматривать не только в связи с опасностью развития заболеваний печени и нервной системы. Систематическое употребление алкоголя является фактором, который при любых дозах потребления этого химического вещества будет сказываться на здоровьи популяции. Неумеренное потребление алкогольных напитков приводит к алкоголизму — физической и психологической зависимости человека от винного спирта. По своему химическому механизму алкоголизм представляет собой частный случай наркотической зависимости, т. е. нарушения тех или иных звеньев обмена веществ. В малых дозах винный спирт постоянно присутствует в организме, но в этом нет ничего страшного, потому что ферментативные системы поддерживают равновесие между этанолом и продуктом его окисления — сильным ядом ацетальдегидом СН3СНО, который обезвреживается печенью. А вот если алкоголя выпито много, в организме образуется избыток ацетальдегида, и печень трудится без устали до тех пор, пока в конце концов не восстанавливается равновесие. Но такая нагрузка на печень очень часто приводит к серьёзным заболеваниям.
МНОГОАТОМНЫЕ СПИРТЫ - производные углеводородов, к молекулах которых 2 и более атомов водорода замещены на гидроксильные группы ОН.
Двухатомные спирты - производные углеводородов, к молекулах которых 2 атома водорода замещены на гидроксильные группы ОН. 2-е название диолы. Общая формула: СnН2n (OH)2 Двухатомные спирты называют гликоли – от греч. «glikos» - сладкий, а большинство представителей имеют сладковатый вкус. Гомологический ряд: С2Н4(ОН)2 – этандиол, этиленгликоль С3Н6(ОН)2 – пропандиол С4Н8(ОН)2 – бутандиол и т.д. Правила номенклатуры и изомерия те же, что и у одноатомных спиртов. Физические свойства (на примере этиленгликоля):
Способы получения: 1. Окисление алкенов: Реакция Вагнера КМ n О4
тен СН2ОН этиленгликоль (этандиол-1,2) уравнение: 3Н2С=СН2 + 2КМn О4 + 4Н2О → 3 СН2ОН + 2 Мn О2 + 2 КОН
СН2ОН этиленгликоль (этандиол-1,2) 2. Хлорирование алкенов с последующим окислением:
Н2С=СН2 → СН2Сl – CH2Cl → CH2OH – CH2OH Голландский химик Дейман обнаружил, что при действии хлора на этилен образуется маслянистая жидкость, названная впоследствии «маслом голландских алхимиков» CH2Cl—CH2Cl (1,2-дихлорэтан). Благодаря этой интересной особенности этилен долгое время именовали «маслородным газом» (лат. gas olefiant), а его гомологи (алкены) получили название олефины. Химические свойства:
CH2OH – CH2OH + 2Nа → CH2ONa – CH2ONa + H2 ↑ гликолят натрия
CH2OH – CH2OH + 2 С2Н5ОН → CH2OС2H5 – CH2OС2H5 + 2 Н2О диэтилгликолят
CH2OH – CH2OH + НСl → CH2Cl – CH2Cl + 2 Н2О дихлоргликолят
CH2OH – CH2OH + 2 NaOH → CH2ONa – CH2ONa + 2 H2O гликолят натрия
5. Взаимодействие с галогенами: C2H5OH + 4Сl2 → CCl3 – CОН + 5 НСl хлораль (трихлоруксусный) альдегид
2 СН2ОН
СН2ОН осадок голубого цвета прозрачный раствор тёмно-синего цвета гликолят меди
Трёхатомные спирты - производные углеводородов, к молекулах которых 3 атома водорода замещены на гидроксильные группы ОН. 2-е название триолы. Общая формула: СnН2n-1 (OH)3 Гомологический ряд: С3Н5(ОН)3 – пропантриол, глицерин С4Н7(ОН)3 – бутантриол и т.д. Правила номенклатуры и изомерия те же, что и у одноатомных спиртов. Физические свойства (на примере глицерина):
2. сладкий на вкус 3. неограниченно растворима в воде 4. нелетуч 5. tпл = 17°С 6. tкип = -290°С 7. ρ= 1,26 г/мл Способы получения: 1. омыление жиров 2. из пропилена [O] +Н2 Н2О2 СН2=СН – СН3 → СН2= СН – СОН → СН2=СН – СН2ОН → СН2ОН – СНОН – СН2ОН Химические свойства:
СН2 – ОН СН2 – О – NО2
СН – ОН + 3 НОNО2 → СН – О – NО2 + 3 Н2О
СН2 – ОН СН2 – О – NО2 глицерин тринитроглицерин t 3. СН2(ОН)СН(ОН)СН2ОН ® СН2=СНСНО+2Н2О. акролеин С акролеином СН2=СНСНО (пропеналь) знакомы все хозяйки, даже если они никогда не слышали этого слова. Акролеин образуется при термическом разложении глицерина — продукта распада жиров. Это и есть то самое вещество, которое своим резким удушливым запахом оповещает всех вокруг о том, что пища пригорела.
Применение:
Другие спирты: Аллиловый спирт СН2=СН – СН2 – ОН – жидкость с запахом розы, сочетает свойства непредельности со свойствами гидроксильной группы. Сложные эфиры аллилового спирта служат мономерами для производства высокомолекулярных материалов. β-фенилэтиловый спирт С6Н5СН2СН2ОН – жидкость с запахом розы. Является главной составной частью розового масла. Может быть получен и синтетически. Находит применение в парфюмерии. Ментол С10Н19ОН- твёрдое вещество с запахом мяты. Содержится в мятном масле. Ментол — кристаллическое вещество с запахом мяты и приятным холодящим вкусом. В качестве ароматизатора его добавляют в зубные пасты, жевательные резинки. Кроме того, это действующее начало некоторых лекарственных препаратов, например валидола — раствора ментола в ментиловом эфире изовалериановой кислоты. Это лекарство снимает приступы стенокардии, расширяя кровеносные сосуды.
СН ⁄ \ Н2С СН2
Н2С СНОН \ ⁄
СН ⁄ \ СН3 СН3 4-х атомные спирты называются эритритами. ۩ Интересно знать ЭТИЛЕН В ОВОЩЕХРАНИЛИЩЕ В незначительном количестве этилен содержится во многих тканях растений, но больше всего его в плодах, где он образуется в результате распада некоторых карбоновых кислот (линолевой кислоты) и аминокислот (метионина, аланина) под действием различных ферментов. Как оказалось, этилен способствует созреванию плодов и вызывает опадение листьев. Наиболее активно он вырабатывается в период созревания: так, 1 кг зелёных яблок выделяет около 130 мл этого газа, в то время как 1 кг спелых плодов — 110 мл, а перезрелых — всего 10 мл. Механизм физиологического действия этилена ещё до конца не изучен, однако предполагается, что он участвует в активации некоторых ферментов растений. Если ввести в атмосферу овощехранилища небольшое количество этилена, плоды будут созревать быстрее. И наоборот, чтобы сохранить спелые плоды в течение длительного времени, надо почаще проветривать овощехранилища, удаляя не только тепло, которое выделяют овощи и фрукты при хранении, но и образующийся этилен.
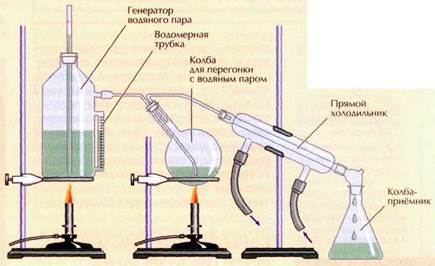
ОПОРНЫЙ КОНСПЕКТ НСООН – муравьиная кислота. В 1670 г. английский ботаник и зоолог Джон Рей (1627—1705) провёл необычный эксперимент. Он поместил в сосуд рыжих лесных муравьев, налил воды, нагрел её до кипения и пропустил через сосуд струю горячего пара. Такой процесс химики называют перегонкой с паром и широко используют для выделения и очистки многих органических соединений. После конденсации пара Рей получил водный раствор нового химического соединения. Оно проявляло типичные свойства кислот, поэтому и было названо муравьиной кислотой (современное наименование — метановая). Названия солей и эфиров метановой кислоты — формиатов — также связаны с муравьями (лат. formica — «муравей»). Впоследствии энтомологи — специалисты по насекомым (от греч. «энтомон» — «насекомое» и «логос» — «учение», «слово») определили, что у самок и рабочих муравьев в брюшках есть ядовитые железы, вырабатывающие кислоту. У лесного муравья её примерно 5 мг. Кислота служит насекомому оружием для зашиты и нападения. Вряд ли найдётся человек, который не испытал их укусов. Ощущение очень напоминает ожог крапивой, ведь муравьиная кислота содержится и в тончайших волосках этого растения. Вонзаясь в кожу, они обламываются, а их содержимое болезненно обжигает. Муравьиная кислота есть также в пчелином яде, сосновой хвое, гусеницах шелкопряда, в небольших количествах она найдена в различных фруктах, в органах, тканях, выделениях животных и человека. В XIX в. муравьиную кислоту (в виде натриевой соли) получили искусственно действием оксида углерода(II) на влажную щёлочь при повышенной температуре: NaOH + СО® HCOONa. И наоборот, под действием концентрированной серной кислоты муравьиная кислота распадается с выделением газа: НСООН® СО+Н2О. Эта реакция используется в лаборатории для получения чистого СО. При сильном нагревании натриевой соли муравьиной кислоты — формиата натрия — идёт совсем другая реакция: углеродные атомы двух молекул кислоты как бы сшиваются и образуется оксалат натрия — соль щавелевой кислоты: 2HCOONa® NaOOC—COONa + Н2. Важное отличие муравьиной кислоты от других карбоновых кислот в том, что она, как обладает одновременно свойствами и кислоты, и альдегида: в её молекуле с одной «стороны» можно увидеть кислотную (карбоксильную) группу —СО—ОН, а с другой — тот же атом углерода, входящий в состав альдегидной группы Н—СО— Поэтому муравьиная кислота восстанавливает серебро из его растворов — даёт реакцию «серебряного зеркала», которая характерна для альдегидов, но не свойственна кислотам. ۩ Интересно знать Муравьиная кислота — самая простая и при этом сильная карбоновая кислота, она в десять раз сильнее уксусной. Когда немецкий химик Юстус Либих впервые получил безводную муравьиную кислоту, оказалось, что это очень опасное соединение. При попадании на кожу оно не только жжёт, но и буквально растворяет её, оставляя трудно заживающие раны. Как вспоминал сотрудник Либиха Карл Фогт (1817—1895), у него на всю жизнь остался шрам на руке — результат «эксперимента», проведённого совместно с Либихом. И неудивительно — впоследствии обнаружилось, что безводная муравьиная кислота растворяет лаже капрон, найлон и прочие полимеры, которые не берут разбавленные растворы других кислот и щелочей. Неожиданное применение муравьиная кислота нашла при изготовлении так называемых тяжёлых жидкостей — водных растворов, в которых не тонут даже камни. Такие жидкости нужны геологам для разделения минералов по плотности. Муравьиная кислота обладает сильными бактерицидными свойствами. Поэтому её водные растворы используют как пищевой консервант, а парами дезинфицируют тару для продовольственных товаров (в том числе винные бочки), уничтожают пчелиных клешей. Слабый водно-спиртовой раствор муравьиной кислоты (муравьиный спирт) применяют в медицине для растираний. Для получения муравьиной кислоты используют специальный прибор:
Современный вид прибора для перегонки с водяным паром.
- бесцветная жидкость с острым запахом Физические свойства уксусной кислоты
В уксусе, который образуется при прокисании вина, содержится около 5% уксусной кислоты (столовым уксусом называют 3—15-процентный раствор). Перегонкой такого уксуса получают уксусную эссенцию — раствор с концентрацией уже 70—80%. А чистая (100-процентная) уксусная кислота выделяется в результате воздействия концентрированной серной кислоты на ацетаты: CH3COONa+H2SO4 (конц.) → CH3COOH+NaHSO4 Такая чистая уксусная кислота, не содержащая воды, при охлаждении до 16,8 °С превращается в прозрачные кристаллы, напоминающие лёд. Вот почему её иногда называют ледяной.
В течение многих столетии главным методом синтеза уксусной кислоты было брожение. Таким способом и сейчас производят пищевой уксус. А для производства сложных эфиров и искусственных волокон в качестве сырья используют кислоту, которая получается при каталитическом окислении углеводородов, например бутана:
СН3—СН2—СН2—СН3 + 2,5 О2 ® 2СН3—СООН + Н2О
Яблочный уксус: содержит 20 важнейших минеральных веществ и микроэлементов, а также уксусную, молочную, лимонную кислоты, ферменты, аминокислоты, поташ, пектин. Применяется для приготовления различных блюд и консервировании, прекрасно сочетается со всевозможными салатами, как из свежих овощей, так и мясными и рыбными. В нём можно мариновать мясо, огурцы, капусту, каперсы. Также применяется при повышенном кровяном давлении, мигренях, астме, голово-кружении, артрите, болезнях почек, высокой температуре, ожогах и т.д. Здоровым людям рекомендуется каждый день употреблять полезный и освежающий напиток: в стакане воды размешать ложку мёда и добавить столовую ложку яблочного уксуса. Желающим похудеть, рекомендуется каждый раз во время еды выпивать стакан воды с 2 ложками яблочного уксуса.
Виноградный уксус: в Словении его традиционно используют при приготовлении различных салатов, хорошо сочетается с различными рыбными салатами и блюдами из морских продуктов. При приготовлении шашлыков виноградный уксус просто незаменим.
Аспирин - уксусный эфир салициловой кислоты- ацетилсалициловая кислота.
О имеет запах груши, поэтому используется при производстве фруктовых вод и десертов.
Химические свойства: 1. Взаимодействие с галогенами: FeCl3 СООН + Вr 2 → COOH + HBr
3-бромбензойная кислота
2. Взаимодействие с минеральными кислотами: t, H2SO4 СООН + НNO3 → COOH + H2О
3-нитробензойная кислота
۩ Интересно знать Впервые образование блестящих шелковистых кристаллов наблюдал при сухой перегонке смол алхимик Андреас Либавий. Оказалось, что это бензойная кислота C6H5COOH — вещество, в холодной воде плохо растворимое, а в горячей — хорошо. Сама кислота и её сложные эфиры входят в состав многих эфирных масел (например, гвоздичного) и бальзамов. Содержащие бензойную кислоту ягоды брусники и клюквы могут долго храниться, поскольку почти не подвержены гниению. Дело в том, что бензойная кислота убивает болезнетворные бактерии, вызывающие гниение. Благодаря этому свойству, а также нетоксичности бензойную кислоту и её соли (например, бензоат натрия) активно используют в качестве консерванта в пищевой промышленности — добавляют во фруктовые соки, соусы, джемы, безалкагольные напитки.
При охлаждении горячего раствора бензойная кислота выделяется в виде игольчатых кристаллов. Бензойная кислота содержится в бензойной смоле, в эфирных маслах, особенно её много в клюкве и бруснике.
Как кислота, так и её соль – бензоат натрия является консервирующим вешеством, оказывает менее вредное действие на организм по сравнению с другими консервантами. Эти вещества оказывают сильное бактерицидное действие на дрожжи и другие виды микроорганизмов, подавляет жизнедеятельность бактерий масляного и уксуснокислого брожения, тем самым позволяет предотвратить микробиальную порчу продуктов питания в процессе их приготовления и хранения; увеличить срок хранения пищевых продуктов в несколько раз. Применяются для консервирования маргарина, плодово-ягодных полуфабрикатов, повидла, мармелада, кондитерских изделий, напитков, рыбных пресервов. Бензоат натрия (Е 211) используется в виде водного раствора, который добавляют к продукту и хорошо перемешивают. Стадия внесения консерванта в продукт определяется технологией его производства. Оксибензойная кислота- это салициловая кислота.
СООН + → СООН + СН3СООН
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 98; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.21.76.0 (0.195 с.) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 Например, СН2 – СН2 – этиленгликоль, этандиол-1,2
Например, СН2 – СН2 – этиленгликоль, этандиол-1,2
 2. вторичный: СН3 – СН2 – СН – СН3 – бутанол-2
2. вторичный: СН3 – СН2 – СН – СН3 – бутанол-2



 к-та, t
к-та, t 


 t
t схема: Н2С=СН2 + [O] + Н2О → СН2ОН
схема: Н2С=СН2 + [O] + Н2О → СН2ОН


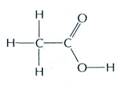 – уксусная кислота.
– уксусная кислота. Сходство не только внешнее: в кристаллах молекулы уксусной кислоты, подобно молекулам воды, образуют систему водородных связей. Межмолекулярное взаимодействие оказывается настолько прочным, что даже в парах уксусной кислоты содержатся не отдельные молекулы, а их агломераты. Жидкая при комнатной температуре ледяная уксусная кислота при охлаждении ниже 1 7 °С превращается в бесцветные кристаллы, действительно похожие на лёд.
Сходство не только внешнее: в кристаллах молекулы уксусной кислоты, подобно молекулам воды, образуют систему водородных связей. Межмолекулярное взаимодействие оказывается настолько прочным, что даже в парах уксусной кислоты содержатся не отдельные молекулы, а их агломераты. Жидкая при комнатной температуре ледяная уксусная кислота при охлаждении ниже 1 7 °С превращается в бесцветные кристаллы, действительно похожие на лёд.
 - Br
- Br 
 - NO2
- NO2 




