Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Получение и свойства непредельных углеводородовСтр 1 из 7Следующая ⇒ Определения температуры плавления органических соединений
1.ОПРЕДЕЛЕНИЕ ТЕМПЕРАТУРЫ ПЛАВЛЕНИЯ Реактивы: 1. Бензойная кислота. 2. β-нафтол. Ход работы. Вещество, температуру которого измеряют, хорошо высушивают и тонко измельчают. Небольшое количество вещества забирают открытым концом капилляра и затем осторожным простукиванием помещают в запаянный конец. Для уплотнения порошка можно применять оттянутую стеклянную палочку или чистую тонкую проволоку. Можно также уплотнить порошок постукиванием капилляра о стеклянную поверхность. Операцию повторяют до получения на дне капилляра столбика порошка высотой 3-5 мм. Капилляр с веществом укрепляют на термометре посредством колечка, отрезанного от резиновой трубки, или спирали из мягкой медной проволоки. Столбик вещества должен находиться на уровне середины ртутного резервуара термометра. Термометр с капилляром (одним или несколькими) укрепляют в чистой сухой пробирке с помощью пробки, имеющей вырез против его шкалы. Термометр не должен прикасаться к стенке пробирки, его резервуар должен находиться на 0,5-1 см выше дна пробирки. Пробирку с термометром укрепляют вертикально в лапке штатива и подводят под нее стаканчик или колбочку с вазелиновым маслом, установленный на кольце штатива. Уровень жидкости должен быть выше верха резервуара термометра в пробирке, а эта последняя должна находиться от дна стакана (колбы) не меньше, чем на 0,5 -1 см. Вместо того, чтобы закрепить пробирку с термометром в лапке штатива можно вставлять ее (на пробке с вырезом) непосредственно в горло колбочки с нагреваемой жидкостью. Удобно также применять пробирку с расширением или боковыми выступами, препятствующими ее полному погружению в горло колбочки. Если заранее известно, что температура плавления исследуемого вещества выше 100°С, то в качестве нагреваемой жидкости используют воду. Работу проводят при хорошем освещении. При работе с неизвестным веществом температуру повышают со скоростью 10-12°С в минуту и получают не вполне точные результаты. Опыт повторяют, предварительно охладив прибор, причем нагревание вначале можно вести быстрее, но за 10-12°С до охлаждаемой температуры следует резко замедлить нагревание до 2-3 °С в минуту. Наблюдая за веществом в капилляре, отмечают и записывают все изменения, происходящие с веществом - перемену окраски, разложение; спекание, намокание и т.п. Когда столбик вещества начинает заметно сжиматься и мокнуть, горелку удаляют. Началом плавления считают появление первой жидкости капли в капилляре, а окончание - исчезновение последних кристалликов. 2.ПРОВЕРКА ИДЕНТИЧНОСТИ ВЕЩЕСТВ ПО ТЕМПЕРАТУРЕ ПЛАВЛЕНИЯ СМЕШАННОЙ ПРОБЫ Реактивы: 1. Бензойная кислота. 2. β-нафтол. Ход работы. Взяв небольшие пробы двух веществ с разными номерами, подготавливают три капилляра и прибор для определения температуры плавления выше 100°С. В один капилляр помещают пробу первого вещества, а в другой - второго и определяют температуры их плавления, укрепив оба капилляра на термометре рядом и нагревая прибор до 110°С, быстро, затем медленно. Записав температуры плавления обеих проб (они должны быть почти одинаковыми), смешивают на часовом стекле шпателем небольшие, примерно равные количества обеих веществ и помещают эту «смешанную пробу» в третий капилляр. Прибор в это время охлаждается. Когда температура в нем снизится до 80-85°С, вынимают термометр, удаляют оба капилляра и вместо них укрепляют третий. Определяют температуру плавления смешанной пробы, нагревая прибор с самого начала (с 80°С) медленно. Внимательно следя за пробой, отмечают и записывают, какие изменения и при каких температурах наблюдается в этом случае. Когда проба полностью расплавиться, сопоставляют температуры плавления чистых веществ и их смеси и делают вывод - идентичны два взятых вещества или нет. Если смешанная проба не обнаруживает явного понижения температуры плавления, то вещества в подавляющем большинстве случаев следует считать идентичным.
Лабораторная работа №3 Очистка органических веществ. Возгонка.
1.ВОЗГОНКА Реактивы: 1. Возгоняемое вещество. Ход работы.
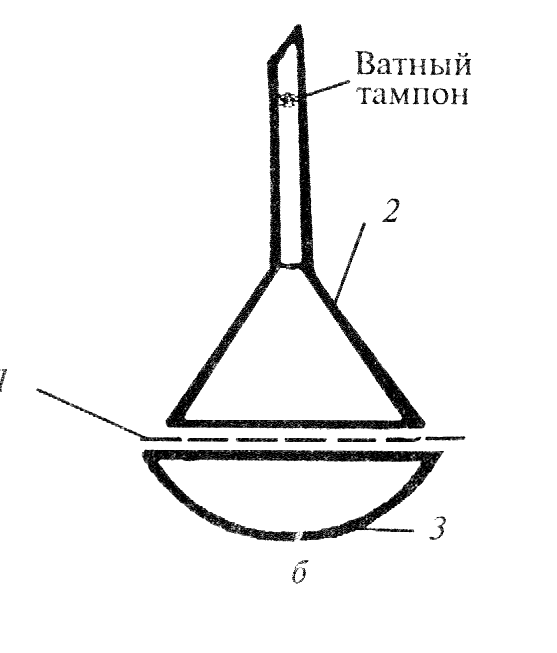
Возгонкой называется процесс испарения твердого вещества с последующей конденсацией его паров непосредственно в твердое вещество, минуя жидкую фазу. Возгонка возможна для веществ, давление паров которых над твердой фазой сравнительно велико. Этим свойством обладают вещества с молекулярной кристаллической решеткой, в которой действуют сравнительно слабые Ван-дер-Ваальсовы силы. Возгонку применяют для очистки тех органических веществ, кристаллизация которых затруднена. Для возгонки небольшого количества вещества при атмосферном давлении его помещают в фарфоровую чашку и накрывают кружочком фильтровальной бумаги с мелкими отверстиями, проделанными иглой. Сверху помещают опрокинутую стеклянную воронку, носик которой плотно закрывают ватным тампоном (рис.). Чашку осторожно нагревают. Пары возгоняющегося вещества проходят через отверстия в фильтре и конденсируются на внутренних стенках воронки. Перегородка из фильтровальной бумаги защищает кристаллы чистого вещества от падения в зону нагрева. Недостатком возгонки является относительно большая длительность и ограниченность применения. Однако данный метод очистки выгодно отличается от перегонки более низкой температурой ведения процесса, а от перекристаллизации - отсутствием контакта вещества с растворителем и высоким конечным выходом.
1. Фильтровальная бумага с мелкими отверстиями. 2. Стеклянная воронка. 3. Фарфоровая чашка.
Лабораторная работа №4 Получение и свойства предельных углеводородов
1. ПОЛУЧЕНИЕ И СВОЙСТВА МЕТАНА Реактивы: 1. Ацетат натрия (безводный). 2. Натронная известь (смесь NaOH и СаО в соотношении 1:2). 3. Разбавленный раствор брома. 4. Разбавленный раствор КМпО4. Ход работы. В пробирку поместить смесь ацетата натрия и натронной извести (в соотношении 1:2, высота слоя 4-6 мм), закрыть пробирку пробкой с газоотводной трубкой, закрепить ее горизонтально в лапке штатива и нагреть в пламени спиртовой горелки до вспенивания массы. В одну пробирку налить 1 мл бромной воды, в другую - 1 мл раствора КМп04. Опустить газоотводную трубку с выделяющимся метаном сначала в одну пробирку, затем в другую. Отметить измениться ли окраска растворов, т.е. происходят ли соответствующие реакции. Поджечь выделяющийся метан у конца газоотводной трубки. 2. ПРОИЗВОДНЫЕ МЕТАНА. СВОЙСТВА ХЛОРОФОРМА Реактивы: 1. Медная проволока. 2. Хлороформ. 7. Раствор резорцина. 8. 10%-ный раствор NaOH. Ход работы. а) Проба Бельштейна Медную проволоку, на конце свернутую в петлю, прокалить в пламени спиртовой горелки до исчезновения зеленоватого окрашивания пламени. После охлаждения нанести на проволоку каплю хлороформа и вновь нагреть в пламени спиртовки. б) Цветная реакция В пробирку налить 2 капли раствора резорцина, четыре капли NaOH, две капли хлороформа и нагреть. Отметить изменение окраски раствора.
Лабораторная работа №5 Синтез 2-метилбензимидазола Реактивы: 1. о-фенилендиамин-10.8 г. 2. Уксусная кислота-8.4 мл. 3. 10%-ный раствор NaOH. 4. Уголь активированный. Ход работы. В круглодонную колбу емкостью 100 мл, снабженную обратным холодильником и закрепленную на штативе, помещают 10.8 г о-фенилендиамина и добавляют 8.4 мл уксусной кислоты. Смесь нагревают на кипящей водяной бане в течении 2 часов. Содержимое колбы выливают в стакан на 100 мл для охлаждения до комнатной температуры. Затем в охлажденный раствор медленно приливают 10%-ный раствор едкого натра, пока смесь не станет чуть щелочной на лакмус. Колбу и продукт промывают ледяной водой около 15 мл и затем подвергают очистки без предварительной сушки. 2-метилбензимидазол растворяют в 100 мл кипящей воды в стакане ёмкостью 0,3 л. Далее жидкость охлаждают до 10-25 оС, 2-метилбензимидазол отфильтровывают на воронке Бюхнера и промывают 10 мл холодной воды. Бесцветный продукт (2-метилбензимидазол) сушат при 100 о С. Температура плавления:175-177 о С.
Лабораторная работа №7 Ароматические углеводороды.
ИЗУЧЕНИЕ И СВОИСТВА ТОЛУОЛА Реактивы: 1. Толуол. 2. Концентрированный раствор серной кислоты. 3. Концентрированный раствор азотной кислоты. 4. Этанол. 5. Диэтиловый эфир. 6. Дистиллированная вода. Ход работы А) Растворимость в различных растворителях. В три пробирки поместить по капле толуола. В одну пробирку добавить 3 мл спирта, в другую - 3 мл воды, в третью - 3 мл эфира. Содержимое в пробирках перемешать. Б) Горение. В фарфоровую чашку поместить 3 мл толуола и поджечь. Отметить характер пламени. В) Нитрование толуола. В пробирку поместить 2 мл концентрированной серной кислоты и 1 мл концентрированной азотной кислоты. Полученную нитрующую смесь охладить до комнатной температуры. Прилить к ней 1 мл толуола. Закройте пробкой и энергично встряхивайте в течение 5-6 минут. Затем вылейте смесь в стакан с холодной водой. Образовавшаяся смесь продуктов реакции собирается на дне стакана в виде желтоватых масляных капель. ОФОРМЛЕНИЕ РЕЗУЛЬТАТОВ ЭКСПЕРИМЕНТА 1. После проведения эксперимента заполните таблицу:
Лабораторная работа №8 Спирты и фенолы 1. ОБРАЗОВАНИЕ И ГИДРОЛИЗ АЛКОГОЛЯТА Реактивы: 1. Этанол. 2. Натрий металлический. 3. Дистиллированная вода. 4. Раствор фенолфталеина. Ход работы. В этиловый спирт осторожно погружают кусочек чистого, отжатого от керосина металлического натрия размером с горошину. Охлаждая пробирку в стакане с водой, предотвращая разогревание смеси и вскипание спирта. Когда газ станет выделяться спокойно, подносят пробирку отверстием к пламени горелки. Выделяющийся водород образует с воздухом смесь, вспыхивающую с характерным резким звуком. Жидкость постепенно густеет, натрий покрывается слоем твердого алкоголята, реакция замедляется, и смесь нужно подогреть (слегка). Если выделение водорода прекратится, а натрий еще не прореагировал, его удаляют проволочкой и помещают в банку для остатков натрия. Полученный раствор алкоголята при охлаждении закристаллизовывается. Добавляют в ту же пробирку 5-6 мл воды и испытывают фенолфталеином реакцию полученного раствора. Взаимодействие натрия со спиртом протекает по общему уравнению: 2 RОН +2Na→2 RОNa + Н2 2. ОКИСЛЕНИЕ ИЗОАМИЛОВОГО СПИРТА ХРОМОВОЙ СМЕСЬЮ Реактивы: 1. Изоамиловый спирт. 2. Концентрированный раствор серной кислоты. 3. Бихромат калия. 4. Дистиллированная вода. Ход работы. В смесь 6 капель концентрированной серной кислоты и 3 капель изоамилового спирта вносят около 0,5 г измельченного бихромата калия. Смесь встряхивают и добавляют 0,5 мл воды. При нагревании изменяется окраска смеси и ощущается сладковатый запах изовалерианового альдегида. При продолжении нагревания появляется неприятный запах изовалериановой кислоты (напоминающий запах испорченного сыра). 3. ДЕГИДРАТАЦИЯ ГЛИЦЕРИНА Реактивы: 1. Глицерин. 2.Бисульфит калия или натрия. Ход работы. !» * К нескольким каплям глицерина в сухой пробирке добавляют 1 г кислой сернокислой соли; встряхнув смесь, осторожно нагревают ее и обнаруживают образование акролеина по появлению характерного очень едкого запаха. 4. КОМПДЕКСООБРАЗОВАНИЕ МНОГОАТОМНЫХ СПИРТОВ Реактивы: 1. Глицерин. 2.Маннит. 3. Этиленгликоль. 4. Бура. 5. 5%-ный раствор сульфата меди. 6. 10%-ный раствор гидроксида натрия. 7. Дистиллированная вода. 8. Раствор фенолфталеина. Ход работы. А). В пробирке получают гидроокись меди, для чего в разбавленный раствор сульфата меди вводят раствор едкой щелочи в небольшом избытке. Отфильтровав большую часть жидкости, вносят стеклянной палочкой небольшое количество осадка в несколько пробирок. Затем в пробирки добавляют по 1 мл воды и по 3-5 капель жидкого спирта или 0,1 г маннита. Для сравнения в одну пробирку с гидроокисью меди и водой не добавляют спирт. Встряхнув все пробирки, дают их содержимому отстояться, после чего отмечают появление характерной окраски жидкости в нескольких пробирках. Затем добавляют к этим растворам избыток разбавленной соляной кислоты и наблюдают изменение окраски. Б). В пробирке встряхивают около 1 г кристаллической буры с 10-15 мл воды. Дав осесть не растворившейся буре, добавляют к полученному насыщенному раствору буры 1-2 капли фенолфталеина. В нескольких пробирках готовят при встряхивании растворы испытуемых спиртов (5-7 капель или 0,1-0,2 г на 2-3 мл воды). В каждую из пробирок добавляют по 1 капли фенолфталеина н по 1 капли разбавленного раствора щелочи. При этом содержимое пробирок окрашивается в малиновый цвет. Затем в каждую пробирку добавляют окрашенный раствор буры, исчезновение окраски в некоторых пробирках при смешивании двух щелочных растворов свидетельствует о том, что образуется жидкость с кислой реакцией. 5. ОБРАЗОВАНИЕ И РАЗЛОЖЕНИЕ ФЕНОЛЯТОВ Реактивы: 1. Фенол. 2. α- или β- нафтол. 3. 10%-ный раствор гидроксида натрия. 4. Разбавленный раствор серной кислоты. 5. Насыщенный водный раствор карбоната натрия. 6. Насыщенный водный раствор бикарбоната натрия. Ход работы. А) К 0,3-0,5 г исследуемого вещества добавляют 1 мл и разбавленный р-р щелочи до полного растворения. Из полученных прозрачных растворов при подкислении разбавленной серной кислотой выделяется в осадок исходное вещество. Б) В две пробирки помещают по 0,2-0,3 г фенола, добавляют при встряхивании в одну из пробирок 1-2 мл водного раствора карбоната натрия, а во вторую - такой же объем раствора бикарбоната натрия. Полное растворение фенола в результате образования фенолятов наблюдается лишь в растворе углекислой соли. 6. ДЕЙСТВИЕ БРОМА НА ФЕНОЛ В ВОДНОМ РАСТВОРЕ Реактивы: 1. Водный раствор фенола. 2. Бромная вода. 3. Насыщенный раствор йодистого калия. 4. Бензол. Ход работы. К I мл водного раствора фенола добавляют по каплям бромную воду, образуется сначала муть, которая при встряхивания исчезает. При дальнейшем прибавлении бромной воды (3-4 мл) выделяется обильный белый осадок трибромфенола с характерным запахом. Продолжают добавлять бромную воду при встряхивании до превращении белого осадка в светло-желтый. Полученную смесь нагревают до кипений и кипятят 1-2 минуты для удаления избытка свободного брома. Затем реакционную смесь охлаждают, при этом осадок, растворившийся при нагревании - снова выделяется. К охлажденной смеси добавляют несколько капель раствора йодистого калия, 1 мл бензола и сильно встряхивают. Осадок растворяется в бензоле, слой которого окрашивается в фиолетовый цвет выделившимся йодом. 7. ЦВЕТНАЯ РЕАКЦИЯ ФЕНОЛА С ХЛОРНЫМ ЖЕЛЕЗОМ Реактивы: 1. Водный раствор фенола. 2. 3%-ный раствор хлорного железа. Ход работы. Помещают в пробирку 3 капли водного раствора фенола и 1 каплю раствора хлорного железа. Появляется интенсивное красно-фиолетовое окрашивание, обусловленное образованием окрашенного иона С6Н5ОFе2+. Эта реакция служит для качественного обнаружения фенолятов. Лабораторная работа №9 Альдегиды и кетоны ОБРАЗОВАНИЕ АЦЕТАЛЬДЕГИДА ПРИ ОКИСЛЕНИИ СПИРТА. Реактивы: 1. Бихромат калия. 2. Этиловый спирт. 3. Разбавленный раствор серной кислоты. 4. Дистиллированная вода. Ход работы. В пробирку с отводной трубкой всыпают 0,5 г бихромата калия, а затем приливают 2 мл разбавленной серной кислоты и 2 мл спирта, смесь встряхивают. Наблюдается изменение окраски смеси. Закрепляют пробирку наклонно в лапке штатива и присоединяют отводную трубку, конец которой погружают почти до дна другой пробирки - приемника, содержащей 2 мл холодной воды. Приемник помещают в стаканчик с холодной водой, осторожно нагревают реакционную смесь в пламени горелки, регулируя равномерное кипение смеси, избегая переброса. В течение 2-3 минут объем жидкости в приемнике увеличивается почти вдвое, после чего прекращают нагревание и разбирают прибор. Отгон в приемнике имеет резкий запах ацетальдегида. Раствор используют для последующих опытов. ПОЛУЧЕНИЕ ОКСИМА АЦЕТОНА
Реактивы: 1. Гидроксиламин солянокислый. 2. Карбонат натрия. 3. Дистиллированная вода. 4. Раствор ацетона. Ход работы. В широкую пробирку наливают 7 мл воды и растворяют в ней 2 г солянокислого гидроксиламина и 1,5 г безводной соды, при этом выделяется много СО2. Полученный раствор хорошо охлаждают и при встряхивании добавляют к нему 1,5 мл ацетона. Наблюдается разогревшие смеси и снова обильно выделение пузырьков двуокиси углерода, одновременно из раствора выпадают легкие белью кристаллы оксима ацетона, имеющие слабый своеобразный запах. Смесь охлаждают еще несколько минут, после чего отсасывают и отжимают их 2-3 каплями холодного спирта и сушат между листами фильтровальной бумаги. 2NН2OН HCl + Na2CO3 →2 NH2OH +2NaCl+CO2+H2O (CH3)2CO+ Н2NOН→(CH3)2CNOH+ H2O Лабораторная работа №10 Альдегиды и кетоны 1. РЕАКЦИЯ ДИСМУТАЦИИ ВОДНЫХ РАСТВОРОВ ФОРМАЛЬДЕГИДА (РЕАКЦИЯ КАННИЦЦАРО)
Реактивы: 1. 40% -ный раствор формалина. 2. Метиловый красный. Ход работы. Поместите в пробирку 2-3 капли 40%-ного формалина. Добавьте 1 каплю индикатора метилрот — метилового красного. Убедитесь, что раствор покраснел, это указывает на кислую реакцию. ПОЛУЧЕНИЕ И ГИДРОЛИЗ ГЕКСАМЕТИЛЕНТЕТРАМИНА (УРОТРОПИНА)
Реактивы: 1.10%-ный спиртовой раствор фенолфталеина. 2. 2н раствор NH4OH. 3. 40%-ный раствор формалина. 4. 2н раствор соляной кислоты. 5. Фуксиносернистая кислота. Ход работы. Поместите в пробирку 1 каплю 10%-ного спиртового раствора фенолфталеина и 2 капли 2н раствора NH4OH. Жидкость окрасится в ярко-розовый цвет. Прибавьте к ней 1 каплю 40% -ного раствора формалина. Через несколько секунд жидкость обесцвечивается. Добавьте вновь 2 капли 2н. р-ра NH4OH – жидкость покраснеет, но снова быстро обесцветится, т.к. аммиак без всякого нагревания энергично вступает в реакцию с формальдегидом, образуя уротропин, или гексаметилентетрамин (CH2)6N4. Добавляйте по каплям р-р аммиака до тех пор, пока не получится неисчезающее розовое окрашивание, указывающее на то, что весь формальдегид уже связан аммиаком и в полученном р-ре уротропина имеется даже небольшой избыток аммиака. Налейте несколько капель розового р-ра на предметное стекло и осторожно выпаривайте р-р над пламенем горелки. Для ускорения испарения воды помешивайте капли концом запаянного капилляра. После испарения воды на стекле остаются кристаллы уротропина, они сладковатого вкуса, без запаха. К оставшемуся в пробирке р-ру уротропина добавьте 1 каплю 2н раствора соляной кислоты и прокипятите, встряхивая пробирку. Внесите по стенкам пробирки 2 капли бесцветного р-ра фуксиносернистой кислоты. Появление розового кольца укажет на наличие формальдегида.
ЙОДОФОРМНАЯ ПРОБА НА АЦЕТОН
Реактивы: 1. Раствор иода в растворе иодида калия. 2. 2 н раствор гидроксид натрия. 3. Водный раствор ацетона. 4. Этиловый спирт. Ход работы. А) Поместите в пробирку 1 каплю раствора иода в растворе иодида калия и добавляйте почти до обесцвечивания 2 н раствор NaOH. К обесцвеченному раствору добавьте пипеткой 1 каплю водного раствора ацетона. Немедленно без нагревания выпадает желтовато-белый осадок с характерным запахом иодоформа. Б) Поместите в пробирку 1 каплю этилового спирта, 3 капли раствора иода в растворе иодида калия и встряхивайте смесь с 1-2 каплями 2 н раствора NaOH почти до обесцвечивания раствора. Уже при слабом подогревании, даже от тепла руки, появится желтоватая муть с характерным очень стойким запахом иодоформа.
Синтез бензимидазола Реактивы: 1. о-фенилендиамин-5,4 г. 2. 90%-ная муравьиная кислота-3,2 мл. 3. 10%-ный раствор NaOH. 4. Уголь активированный. Ход работы. В круглодонную колбу емкостью 100 мл, снабженную обратным холодильником и закрепленную в штативе, помещают 5,4 г о-фенилендиамина и добавляют 3,2 мл муравьиной кислоты. Смесь нагревают на кипящей водяной бане в течении 2 часов. Содержимое колбы выливают в стакан на 100 мл для охлаждения до комнатной температуры. Затем в охлажденный раствор медленно приливают 10%-ный раствор едкого натра, пока смесь не станет чуть щелочной на лакмус. Колбу и продукт промывают ледяной водой около 15 мл и затем подвергают очистки без предварительной сушки. Бензимидазол растворяют в 100 мл кипящей воды в стакане ёмкостью 0,3 л. Далее жидкость охлаждают до 10-25 оС, бензимидазол отфильтровывают на воронке Бюхнера и промывают 10 мл холодной воды. Бесцветный продукт (бензимидазол) сушат при 100 оС. Температура плавления:170-172 оС.
Лабораторная работа № 12 Синтез п-нитрофенилацетата Реактивы: 1. п -нитрофенол.-7 г (0,05М). 2. Уксусный ангидрид-6,12 мл (0,06М). 3. Серная кислота- 2 капли. Ход работы. В двугорлую колбу емкостью 100 мл, снабженную обратным холодильником и термометром загружают указанное количество п -нитрофенола и уксусного ангидрида. Реакционную смесь медленно нагревают на воздушной бане до получения однородной жидкой массы. Температура при этом не должна превышать 60 0С. В реакционную смесь добавляют две капли концентрированной серной кислоты (температура при этом повышается) и продолжают нагревание поддерживая температуру в интервале 88-92 0С в течении 3,5 часов. Полученную смесь охлаждают до комнатной температуры, а затем вливают в ледяную воду (0,5 л) при интенсивном перемешивании с помощью стеклянной палочки. Спустя 2-5 минуты вливаемая жидкость превращается в тестообразную массу, затем затвердевает. Образовавшийся конгломерат измельчают стеклянной палочкой и отфильтровывают на воронке Бюхнера. Осадок на воронке промывают ледяной водой (150 мл), измельчают и высушивают на воронке и перекристаллизовывают из этилового спирта. Температура плавления:81-82 оС.
Лабораторная работа №16 Карбоновые кислоты 1. ПОЛУЧЕНИЕ УКСУСНОИЗОАМИЛОВОГО ЭФИРА Реактивы: 1. Натрий уксуснокислый обезвоженный. 2. Изоамиловый спирт. 3. Раствор концентрированной серной кислоты. 4. Дистиллированная вода. Ход работы. В сухую пробирку поместите немного (высота слоя около 2 мм) порошка обезвоженного уксуснокислого натрия СН3СООNа и 3 капли изоамилового спирта С5Н11ОН. Добавьте 2 капли концентрированной серной кислоты и нагрейте осторожно, все время, встряхивая пробирку, над пламенем микрогорелки. Через 1-2 мин жидкость буреет и появляется характерный запах уксусно-изоамилового эфира (амилацетата) - запах грушевой эссенции. Чтобы освободиться от посторонних примесей, маскирующих запах эфира, добавьте в пробирку около 10 капель воды, взболтайте и вылейте в небольшую (диаметр 5-6 см) фарфоровую чашку или стакан с водой. Примеси растворяются в воде, а эфир распределится на поверхности воды, и запах его будет различаться более отчетливо. 2. ОБРАЗОВАНИЕ И ГИДРОЛИЗ СЛОЖНЫХ ЭФИРОВ Реактивы: 1. Этиловый спирт. 2. Метиловый спирт. 3. п-Пропиловый спирт. 4. Изо-пропиловый спирт. 5. н-Бутиловый спирт. 6. Изо-бутиловый спирт 7. н-Амиловый спирт. 8. Изо-амиловый спирт. 9. Ледяная уксусная кислота. 10. Концентрированный раствор серной кислоты. 11. Дистиллированная вода. 12. Насыщенный раствор хлорида натрия. 13. Разбавленный раствор серной кислоты. 14. Концентрированный раствор щелочи. Ход работы. А) Смешивают в 2 пробирках по 2 мл спирта и по 2 мл ледяной уксусной кислоты. Во вторую пробирку добавляют 0,5 мл раствора концентрированной серной кислоты. Встряхнув пробирки помещают их на 10 мин. в горячую (60-70°С), но не кипящую водяную баню, следя за тем, чтобы жидкость в пробирках не кипела. Затем охлаждают обе пробирки в холодной воде и добавляют в каждую по 2 мл воды. Отмечают запах образовавшегося сложного эфира и разницу в объемах отслоившегося слоя эфира в первой и во второй пробирках. Поверхность слоев эфира и воды лучше заметна при осторожном покачивании пробирки. Затем добавляют по 3 мл насыщенного раствора хлорида натрия и наблюдают изменения объема эфирного слоя. Б) Сняв пипеткой часть отслоившегося алкилацетата помещают примерно равные его количества (по 6-8 капель) в 3 чистые пробирки. Приливают во все пробирки по 1 мл воды и добавляют во вторую пробирку 1 -2 капли раствора разбавленной серной кислоты, а в третью пробирку 1-2 капли концентрированного раствора щелочи. Нагревают при встряхивании одновременно все пробирки в горячей вод 60-70°С, отмечают различие в скорости исчезновения капель, а так же запах сложного эфира во всех 3-х пробирках.
Лабораторная работа № 17 Карбоновые кислоты 1.ОТКРЫТИЕ УКСУСНОЙ КИСЛОТЫ. ПОЛУЧЕНИЕ КОМПЛЕКСНОЙ ЖЕЛЕЗНОЙ СОЛИ
Реактивы: 1. Ацетат натрия. 2. Дистиллированная вода. 3. 0,1 н. раствор FeCl3. Ход работы. Поместите в пробирку несколько крупинок ацетата натрия CH3COONa. Убедитесь в том, что он не имеет запаха. Добавьте в пробирку 3 капли воды и 2 капли 0,1 н. FеС13. Появляется желто-красное окрашивание от образующейся железной соли уксусной кислоты.
2.СРАВНЕНИЕ РАСТВОРИМОСТИ ПОДСОЛНЕЧНОГО МАСЛА В РАЗЛИЧНЫХ РАСТВОРИТЕЛЯХ
Реактивы: 1. Подсолнечное масло. 2. Бензол. 3. Этиловый спирт. Ход работы. Заготовьте 2 кусочка фильтровальной бумаги (3,5×3,5 см). Центральную часть каждого кусочка смочите подсолнечным маслом так, чтобы образовалось небольшое масляное пятно диаметром 6-8 мм. К центру пятна на бумаге прикоснитесь стеклянным капилляром, наполненным бензолом. Капилляр держите перпендикулярно к бумаге. Добавляйте бензол до тех пор, пока пятно расплываясь, увеличится в диаметре до 18-20 мм. После испарения растворителя в центре окажется кружочек чистой, обезжиренной бумаги, а масло расположится на периферии расплывшегося пятна концентрическим кольцом. Это указывает на то, что бензол очень хорошо растворяет подсолнечное масло и способен экстрагировать его из бумаги. Проделайте тот же опыт экстракции масла этиловым спиртом. По испарении спирта центральное масляное пятно останется почти без изменения. Лабораторная работа №18 ПРИГОТОВЛЕНИЕ МЫЛА
1 ОМЫЛЕНИЕ ЖИРА ВОДНЫМ РАСТВОРОМ
Реактивы: 1. Касторовое масло или любое растительное масло. 2. 35% -й раствор гидроксида натрия. 3. Дистиллированная вода. Ход работы. В небольшую фарфоровую чашку диаметром 5—6 см поместите из бюретки точно 1 млкасторового масла и 0,2 мл(4 капли) 35%-ного раствора гидроксида натрия. Небольшой стеклянной палочкой размешайте щелочь с маслом до образования однородной эмульсии. Касторовое масло в отличие от подсолнечного начинает омыляться концентрированной щелочью уже на холоду, что заметно по загустению масла при смешении его со щелочью — происходит образование эмульсии. Затем поставьте чашку и нагревайте на пламени микрогорелки. Все время помешивайте смесь стеклянной палочкой, придерживая чашку рукой или пинцетом. Когда масса начнет загустевать, добавьте из пробирки 2—3 мл дистиллированной воды и снова нагревайте, все время помешивая, пока не получится однородная и прозрачная слегка желтоватая жидкость, так называемый мыльный клей. Продолжайте выпаривать воду, пока мыльный клей не начнет приставать к палочке все больше и больше и, наконец, не станет застывать в виде белых рыхлых пластинок после вынимания палочки из чашки. Снимите чашку с огня. Если варка шла нормально и мыло не подгорело, то получится небольшой кусочек твердого белого мыла.
2.РАСТВОРЕНИЕ МЫЛА В ВОДЕ Реактивы: 1. Натриевое мыло. 2. Дистиллированная вода. Ход работы. Из полученного натриевого мыла заготовьте водный раствор в таком количестве, чтобы его хватило для выполнения ряда описанных ниже реакций. Для этого кусочек полученного мыла (около 20— 30 мг) растворите в 2—3 млводы. Подогрейте пробирку на микрогорелке и убедитесь, что при нагревании мыло растворяется значительно быстрее. При встряхивании содержимого пробирки наблюдается обильное вспенивание. 3. ВЫДЕЛЕНИЕ СВОБОДНЫХ ЖИРНЫХ КИСЛОТ ИЗ МЫЛА
Реактивы: 1. Концентрированный раствор мыла. 2. 2 н. раствор серной кислоты. Ход работы. С помощью пипетки поместите в пробирку 5 капель приготовленного концентрированного раствора мыла и добавьте к нему 1 каплю 2 н. Н2S04. Немедленно выпадает белый хлопьевидный маслянистый осадок свободных жирных кислот, который сохраните для следующего опыта.
4. ДОКАЗАТЕЛЬСТВО НЕПРЕДЕЛЬНОСТИ ЖИРНЫХ КИСЛОТ Реактивы: 1. Жирные кислоты. 2. Бромная вода. Ход работы. В пробирку с выделенными жирными кислотами (см. оп. 5) добавьте 2—4 капли бромной воды. Немедленно происходит обесцвечивание бромной воды.
5. СПОСОБНОСТЬ МЫЛА ЭМУЛЬГИРОВАТЬ ЖИРЫ
Реактивы: 1. Подсолнечное масло. 2. Дистиллированная вода. 3. Раствор мыла. Ход работы. Поместите в пробирку 1 каплю подсолнечного масла, прибавьте 5 капель воды и энергично встряхните. Масло разделяется на мелкие капельки, образующие мутную жидкость — эмульсию. Однако эта эмульсия очень неустойчива, и уже через несколько секунд капельки масла начинают слипаться в более крупные капли, которые постепенно всплывают верх. К образовавшейся эмульсии добавьте с помощью пипетки 5 капель приготовленного ранее раствора мыла и снова энергично встряхните. Образуется молочно-белая эмульсия, которая уже не расслаивается так быстро, как раньше.
6. ВЫСАЛИВАНИЕ МЫЛА ХЛОРИДОМ НАТРИЯ
Реактивы: 1. Раствор мыла. 2. Хлорид натрия. Ход работы. С помощью пипетки поместите в пробирку 5 капель раствора мыла. Добавьте несколько лопаточек сухого хлорида натрия. Энергично встряхивайте. По мере растворения хлорида натрия раствор мыла начинает мутнеть, так как растворимость натриевого мыла постепенно понижается, оно как бы «свертывается» и в конце концов выделяется в виде белого творожистого осадка, всплывающего над прозрачной жидкостью. Этот процесс получил в технике название высаливания. Выделившийся наверху белый осадок мыла называют ядром т. е. чистым мылом. Отсюда название ядровое мыло.
7. ОБРАЗОВАНИЕ НЕРАСТВОРИМЫХ КАЛЬЦИЕВЫХ СОЛЕЙ ЖИРНЫХ КИСЛОТ
Реактивы: 1. Раствор мыла. 2. Хлорид кальция. Ход работы. С помощью пипетки поместите в пробирку 5 капель раствора мыла и добавьте 1 каплю раствора хлористого кальция. Энергично взболтайте. Немедленно выпадает белый осадок нерастворимых в воде кальциевых солей жирных кислот (кальциевое мыло). 8. образование нерастворимого в воде медного мыла
Реактивы: 1. Раствор мыла. 2. Сульфат меди концентрированный. Ход работы. С помощью пипетки поместите в пробирку 5 капель раствора мыла и прибавьте 1 каплю 0,1 н. CuSO4. Немедленно выпадает голубой не растворимый в воде осадок медных солей жирных кислот. 9. Гидролиз спиртового раствора мыла
Реактивы: 1. Мыло. 2. Спиртовой раствор фенолфталеина. 3.Дистиллированная вода. Ход работы. Поместите в пробирку крупинку сваренного мыла и добавьте 1 каплю спиртового раствора фенолфталеина. Покраснение не наблюдается. Это подтверждает то, что сваренное мыло является смесью солей высших жирных кислот и не содержит свободной щелочи. Прибавьте в пробирку 5-10 капель воды. Как изменился цвет раствора при прибавлении воды?
Лабораторная работа № 19 Синтез гиппуровой кислоты 1.ОТКРЫТИЕ УКСУСНОЙ КИСЛОТЫ. ПОЛУЧЕНИЕ КОМПЛЕКСНОЙ ЖЕЛЕЗНОЙ СОЛИ
Реактивы: 1. Глицин - 1,87 г 2. Гидроксид натрия - 2,6 г 3. Бензоилхлорид - 3,9 г 4. 10%-й раствор соляной кислоты Ход работы. Гиппуровую кислоту получают ацилированием аминогруппы глицина (аминоуксусной кислоты) бензоилхлоридом: C6Н 5СОCl + HN2CH2COOH C6Н5СONНCH2 COOH + HCl К насыщенному водному раствору 1,87 г глицина в воде прибавляют насыщенный водный раствор едкого натра и по каплям при перемешивании прибавляют 3,9 г хлористого бензоила. В конце прибавления хлористого бен- зоила следят за тем, чтобы реакционная среда была щелочной. После прибавления всего хлористого бензоила раствор подкисляют разбавленной соляной кислотой. Через два часа выпавшие кристаллы отфильтровывают, сушат на воздухе, промывают эфиром или ацетоном для удаления примеси бензойной кислоты. Гиппуровую кислоту перекристаллизовывают из горячей воды. Выход гиппуровой кислоты 3 г, т. пл. 187 °С.
Лабораторная работа №20 Азоторганические соединения 1. ПОЛУЧЕНИЕ НИТРОМЕТАНА. Реактивы: 1. Монохлоруксусная кислота. 2. Лед. 3. Дистиллированная вода. 4. Бикарбонат натрия. 5. Нитрит натрия. Ход работы. В небольшом стаканчике смешивают 5 г хлоруксусной кислоты и добавляют к ней 10 г льда. Ставят стаканчик в ледяную воду и понемногу всыпают в него 5 г порошка бикарбоната натрия, все время тщательно перемешивая вспенившуюся смесь стеклянной палочкой. По окончании выделения двуокиси углерода добавляют к смеси 10 г нитрита натрия в 6 мл воды и снова перемешивают. Переливают всю жидкость из стакана в большую пробирку или круглодонную колбу (жидкость должна занимать не более половины ее объема) и вносят кипятильный камешек. Укрепляют сосуд наклонно в держателе штатива, вставляют пробирку с отводной трубкой и присоединяют к ней длинный нисходящий воздушный холодильник. Приемником служит пробирка, охлаждаемая в воде. Нагревают реакционную смесь пламенем горелки, сначала осторожно, затем сильнее. Жидкость постепенно чернеет и сильно пениться от выделения двуокиси углерода, отгоняется вода и тяжелое бесцветное масло. Отгонку заканчивают, когда в приемник начинает переходить вода без масла. 2. РЕАКЦИЯ НИТРОМЕТАНА Реактивы: 1. Нитрометан. 2. Дистиллированная вода. 3. Раствор фенолфталеина. 4. 0,1 н раствор гидроксида натрия. 5. Концентрированный раствор гидроксида натрия. 6. Цинк. Ход работы. А) К нескольким каплям нитрометана добавляют воду по каплям при встряхивании до полного растворения продукта. Проверяют реакцию раствора лакмусовой бумажкой, добавляют к нему каплю раствора фенолфталеина и затем медленно, по каплям 0,1 Н раствор щелочи до появления устойчивой окраски. Б) Несколько капель нитрометана растворяют в 2 мл концентрированного раствора щелочи, вносят 2-3 кусочка цинка и нагревают смесь
|
|||||||||||||
|
Последнее изменение этой страницы: 2021-05-11; просмотров: 299; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.217.139.162 (0.005 с.) |