Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Метаболизм экзогенного этанола
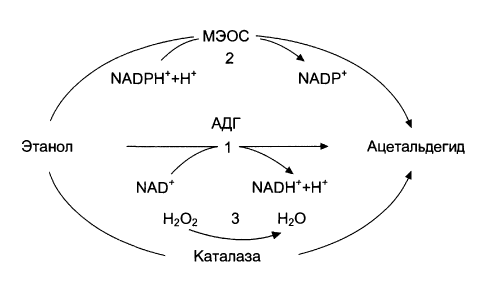
Всасывание этанола начинается в ротовой полости и пищеводе. Примерно 20% этанола всасывается в желудке и 80% - в двенадцатиперстной кишке. Из крови этанол путем пассивной диффузии быстро проникает во все органы и ткани, преимущественно концентрируясь в ткани головного мозга, где его концентрация всегда превышает содержание в крови, а также в секрете простаты, в яичках, сперме. Этанол может выводится в неизменном виде легкими, почками, молочными и потовыми железами, с калом, а также подвергается биотрансформации в организме. Метаболизм этанола осуществляется на 90% в печени и включает три механизма: - Окисление под действием алкогольдегидрогеназы (АДГ) АДГ метаболизирует примерно 12 г этанола за 1 ч. Окисление этанола под действием АДГ с образованием уксусного альдегида (ацетальдегида) осуществляется в цитозоле гепатоцитов. Коферментом реакции является НАД+: С2Н5ОН + НАД+ CH3CHO + НАДН + Н+ Этот путь окисления этанола играет ключевую роль у здоровых людей. Следует отметить, что этанол обладает высокой калорийностью. При окислении в организме 100 г этанола выделяется 710 ккал (2970,64 кДж) энергии. Однако, большое количество НАДН, образующееся при окислении этанола, подавляет работу ЦТК, в результате чего активируются другие пути использования ацетил-СоА, направленные на синтез холестерола, жирных кислот и кетоновых тел. Реакция, катализируемая АДГ обратима и является скорость-лимитирующей реакцией окисления этанола. Алкогольдегидрогеназа катализирует перенос гидрид-иона (Н-) от группы СН2ОН первичных спиртов различной структуры на никотинамидную часть кофермента НАД+:
Этот же фермент способен катализировать и обратную реакцию - восстановление альдегида до спирта. Существуют три изоформы АДГ, различающиеся по строению протомеров, локализации и активности: АДГ1, АДГ2 и АДГ3. Для европейцев характерно преобладание изоформ АДГ1 и АДГ3. У некоторых восточных народов преобладает изоформа АДГ2, характеризующаяся высокой активностью, что может быть причиной их повышенной чувствительности к алкоголю. АДГ печени состоит из двух одинаковых субъединиц, каждая из которых построена из одной полипептидной цепи, содержащей 374 аминокислотных остатка и образует 2 домена. Каталитический домен, в котором локализованы все компоненты активного центра фермента, в том числе и остатки, связывающие ион Zn2+, участвующий в катализе, объединяет N-концевой (остатки 1-175) и С-концевой (остатки 319-374) фрагменты полипептидной цепи. Кофермент(нуклеотид)связывающий домен, сформирован центральным фрагментом (остатки 176-318). По вторичной и третичной структуре, он очень сходен с нуклеотидсвязывающими доменами других НАД-зависимых дегидрогеназ. Считается, что характерная пространственная структура нуклеотидсвязывающего домена возникла на очень ранних этапах эволюции и многократно использовалась как готовый функциональный модуль, который мог объединяться с соответствующими каталитическими центрами, образуя различные НАД-содержащие ферменты.
Контакт между субъединицами определяется преимущественно взаимодействием нуклеотидсвязывающих доменов, которые образуют "ядро" димера. При этом, β-складчатый лист одной субъединицы "стыкуется" с такой же структурой другой субъединицы, образуя протяженный β-складчатый слой. Это взаимодействие дополняется развитой сетью гидрофобных контактов, в которых участвуют порядка 30 аминокислотных остатков, что затрудняет диссоциацию димера даже в 8 М мочевине. Аденозиндифосфатрибозный фрагмент НАД+ создает множество нековалентных контактов с ферментом. Остаток аденина располагается в гидрофобном кармане, 2ʹ-ОН группа аденозина образует водородную связь с карбоксильной группой Asp-223, пирофосфатная группа образует электростатическую связь с остатком гуанидина Arg-47, принадлежащего каталитическому домену. "Концевой" (т.е. ближайший к никотинамиду) остаток рибозы образует водородные связи с карбонильными группами Gly-293 и Ile-269. Множественность нековалентных связей обеспечивает точное размещение кофермента в активном центре алкогольдегидрогеназы. Зона связывания субстрата располагается в глубоком "кармане" канала между каталитическим и нуклеотидсвязывающим доменами одной из субъединиц, однако, в нее входят отдельные аминокислотные остатки и второй субъединицы. Этот канал "выстлан" гидрофобными боковыми радикалами, что позволяет установить гидрофобные контакты с R-радикалом спирта. Важно отметить, что формирование этого канала завершается после связывания НАД+ и вызванного этим изменения конформации фермента. АДГ печени может связывать различные спирты - от этанола до производных бензилового спирта (С6Н5СН2ОН), ω-оксикислот и даже стероидных спиртов. Наиболее важным условием является содержание гидрофобного фрагмента в структуре. Например, в связывании бензилового спирта принимают участие остатки Leu-116 и Leu-57, а также Phe-93 и Val-294. Сорбируясь, субстрат выталкивает из зоны связывания несколько молекул воды и в определенной мере стягивает прилегающую часть фермента в более компактную структуру. Это весьма небольшое изменение конформации, как полагают, играет существенную роль в катализе.
Рис. 8. Размещение субстрата в активном центре алкогольдегидрогеназы При связывании субстрата, его гидроксильная группа сближается с ионом Zn 2+ и утрачивает протон, превращаясь в алкоголят. В отщеплении протона и стабилизации алкоголята участвует система водородных связей с Ser -48 и His -51. Каталитический центр АДГ содержит ион Zn2+, который окружен четырьмя лигандами, расположенными в вершинах неправильного тетраэдра. Три из них принадлежат белку и образованы остатками Cys-46, Cys-174 и His-67. Четвертое координационное положение занимает кислород субстрата, а в его отсутствие - молекула воды (Рис. 8). Гидроксильная группа остатка Ser-48 способна образовывать водородную связь с кислородом лиганда - воды или спирта. Спирт, гидрофобная цепь которого связана в гидрофобном канале фермента, ориентируется так, что его кислород устанавливает непосредственную связь с ионом Zn2+, вытесняя из четвертого координационного положения, находившуюся там молекулу воды (Рис. 8). Это приводит к отщеплению протона гидроксильной группы, а связь с Zn2+ образует алкоголят-анион спирта R-CH2O-:
Алкоголят-анион далее стабилизируется путем смещения электронной плотности от атома кислорода алкоголята к связи С-О, которая в конечном счете превращается в двойную, а гидрид-ион от атома углерода переносится в положение 4 никотинамидного ядра НАД+:
При обратной реакции, перенос гидрид-иона происходит от НАДН к углероду альдегидной группы, двойная связь которой оказывается поляризованной за счет влияния связанного с ферментом иона Zn2+ на атом кислорода. Такая поляризация усиливает частичный положительный заряд на атоме углерода карбонильной группы, что благоприятствует присоединению гидрид-иона. - Микросомальное окисление Данный тип окисления этанола протекает в микросомах клеток печени при участии цитохром Р450-зависимой микросомальной этанолокисляющей системы (МЭОС): С2Н5ОН + НАДФН + Н+ + О2 CH3CHO + НАДФ+ + 2Н2О МЭОС локализована в мембранах гладкого эндоплазматического ретикулума (ЭР) гепатоцитов. Данная система обеспечивает у здоровых людей окисление порядка 10% поступившего в организм этанола. При злоупотреблении алкоголем, а также другими спиртами или же лекарственными препаратами типа барбитуратов, роль данной системы в метаболизме данных веществ существенно возрастает. Этот путь окисления этанола осуществляется с участием изофермента цитохрома Р450 - Р450 IIE1 (Cyp2E1). При хроническом алкоголизме, окисление этанола по данному пути ускоряется на 50-70%, за счет гипертрофии ЭР и индукции Р450 IIE1 (Cyp2E1). Побочными продуктами этой реакции являются активные формы кислорода (АФК), ответственные за окислительное повреждение клеточных структур.
Еще одним фактором, способствующим поражению гепатоцитов при хроническом злоупотреблении алкоголем, является употребление и пищей больших количеств полиненасыщенных жирных кислот (ПНЖК). Микросомы играют важную роль в метаболизма ПНЖК. При избытке ПНЖК в диете или при состояниях, характеризующихся высоким уровнем свободных жирных кислот (ЖК) в крови (ожирение, сахарный диабет II типа), повышается ДНК-связывающая активность микросомального пролиферативного α-рецептора (PPAR). Это индуцирует экспрессию генов микросомальных ферментов, Cyp4A1 и Cyp4A2, что приводит к еще более активной генерации АФК и окислительному повреждению клеточных структур. Кроме того, активируется ω-окисление длинноцепочечных ЖК, опосредованное Cyp4A, с образованием токсичных дикарбоновых кислот. Этанол также является субстратом для микросомальной каталазы. - Окисление с помощью каталазы, тканевых оксидаз и пероксидаз Данный механизм играет второстепенную роль в процессе окисления этанола. У здоровых людей он ответственен за окисление 2-3% экзогенного этанола. Окисление протекает согласно следующему уравнению: С2Н5ОН + Н2О2 CH3CHO + 2Н2О У людей, страдающих алкоголизмом роль этого механизма окисления этанола существенно возрастает. Суммарно, пути окисления этанола можно представить следующей схемой:
|
|||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 98; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.218.55.14 (0.008 с.) |