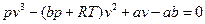Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Уравнение состояния реального газа
Уравнение состояния и явления переноса в реальных газах и жидкостях тесно связаны с силами, действующими между молекулами. При переходе от идеального к реальному газу необходимо учитывать объем, занимаемый молекулами. Для молекул реальных газов то свободное пространство, в котором они движутся, будет меньше объема сосуда на величину, зависящую от объема самих молекул. Кроме того, по сравнению с идеальным газом, давление на стенки сосуда реального газа меньше на величину, связанную с межмолекулярным взаимодействием. Поправка на объем молекул обозначается как b, поправка на межмолекулярное взаимодействие – как a / v 2. Таким образом, состояние реального газа описывается уравнением Ван-дер-Ваальса:
Или, раскрывая скобки относительно v, получаем:
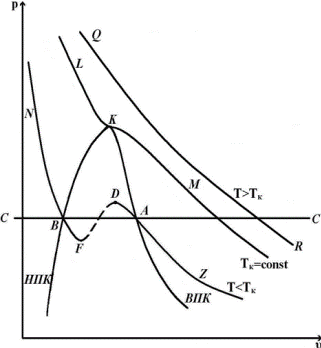
При решении этого уравнения могут быть три случая: 1) один корень действительный и два мнимые; 2) три корня действительные и равные между собой; 3) три корня действительные и различные по величине. При экспериментальной проверке этого уравнения (сжимая пар в изотермических процессах при различной температуре) можно получить зависимости, изображенные на рисунках … Наблюдения показали, что изотерма LKM имеет перегиб в точке К, причем при температурах T>Tк получаются гиперболы, а при температурах T<Tк на изотермах получаются горизонтальные участки, которые соответствуют превращению газа в жидкость. Соединив точки одинакового агрегатного состояния (А1, А2, А3 и В1, В2, В3), получаем т.н. «пограничные кривые»: верхнюю пограничную кривую (ВПК) КА и нижнюю пограничную кривую (НПК) КВ. Точка К, где горизонтальный участок отсутствует, называется критической точкой. Изотерма, проходящая через критическую точку, называется критической; давление, удельный объем и температура в точке К называются также критическими и обозначаются соответственно. Критическая изотерма не имеет горизонтального участка, а лишь точку перегиба. Анализируя рис., можно выделить следующие области: левее НПК и ниже критической изотермы – жидкость; ниже пограничных кривых НПК и ВПК – смесь жидкость + пар; правее и выше ВПК – газообразное состояние (перегретый пар, реальный газ). Переход из газообразного состояния в жидкое не всегда происходит по прямой – см. рис.. Можно создать такие условия, при которых начало конденсации будет запаздывать и дальнейшее сжатие будет сопровождаться повышением давления по кривой AD. В этих состояниях пар называется переохлажденным. Так же можно получить и перегретую жидкость (участок BF). Участки AD и BF малоустойчивы, однако могут быть реально получены. Участок DF совершенно неустойчив и физически неосуществим.
Следует учитывать, что хотя уравнение Ван-дер-Вальса по ряду причин представляет собой лишь грубое приближение, оно может быть использовано как уравнение состояния для многих газов в относительно небольших интервалах температур. Используются также следующие уравнения: - Бертло [] и Дитеричи [], относящиеся к тому же классу полуэмпирических уравнений с двумя постоянными; - уравнение состояния Битти-Бриджмена [] - уравнение состояния подобного реального газа Вукаловича-Новикова для перегретого водяного пара []. Кроме того, уравнение состояния реального газа может быть описано в очень широком интервале температуры и давления с помощью соотношения степенного ряда, которое называется вириальным уравнением состояния [].
P-v диаграмма водяного пара Пары различных веществ широко применяются во всех областях производства и энергетики. Наибольшее распространение получил водяной пар в связи с его низкой стоимостью, легкодоступностью и нетоксичностью. Водяной пар используется как рабочее тело в паровых турбинах, паровых машинах, как теплоноситель в различных теплообменниках и др. Парообразование – процесс превращения вещества из жидкого состояния в газообразное. Испарение – парообразование, которое происходит при любой температуре со свободной поверхности жидкости или твердого тела. Кипение – процесс парообразование как на свободной поверхности жидкости, так и по всему её объему. Конденсация – переход вещества из газообразного состояния в жидкое. Конденсат – жидкость, полученная при конденсации. Сублимация – процесс преобразования твердого вещества непосредственно в пар. Десублимация – обратный процесс. Насыщенный пар – пар, находящийся в равновесии с жидкостью. Т.е. пар в состоянии, когда число молекул покидающих жидкость равно числу молекул, возвращающихся в неё.
Сухой пар – пар, в котором отсутствуют частицы жидкости. Влажный пар – пар, в котором присутствуют частицы жидкости. Насыщенный пар – пар, параметры которого соответствуют параметром насыщения (давлению, температуре, плотности, при которых наступает равновесие твердой и газообразной фаз). Влажный насыщенный пар – пар при температуре и давлении насыщения, в котором содержатся мелкодисперсные взвешенные частицы жидкости. Перегретый пар – пар, находящийся при температуре, величина которой превышает температуру насыщения при данном давлении. Степень сухости – массовая доля сухого насыщенного пара во влажном. Степень влажности – массовая доля кипящей жидкости во влажном паре. Фазовая p-v диаграмма системы, состоящей из жидкости и пара, представляет собой график зависимости удельных объемов воды и пара от давления. Термодинамика потока
Термодинамическая теория течения и истечения газов и паров имеет большое прикладное значение в современной теплоэнергетике. Целый ряд технических расчетов основывается на закономерностях, которые вытекают из рассмотрения и исследования термодинамики процессов течения и истечения газов и паров. С этими закономерностями приходится сталкиваться при изучении процессов в тепловых двигателях, особенно в реактивных двигателях, газовых и паровых турбинах, рабочий процесс которых полностью основывается на закономерностях процессов течения и истечения газов и паров.
|
||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 114; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.16.29.209 (0.008 с.) |