
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Контрольная работа по теме «Металлы» ⇐ ПредыдущаяСтр 10 из 10
Вариант-1 Что собой представляет химическая коррозия? Приведите примеры. Осуществите химическое превращение и для реакции №1- составьте электронный баланс Cu à CuO à CuSO4 à Cu(OH)2 C какими из перечисленных веществ: O2, S, CO2, H2SO4, Mg, NaOH, Br2, FeCl3 вступает во взаимодействие калий? Запишите уравнения возможных реакций. К железу массой 2.6г прибавили серу массой 2,8г. Рассчитайте массу получившегося сульфида железа.
Вариант-2 Что собой представляет электрохимическая коррозия? Приведите примеры. Осуществите химическое превращение и для реакции №3 составьте ионное уравнение Al à Al2O3 à Al(OH)3 à Al2 (SO4)3 C какими из перечисленных веществ: O2, S, CO2, H2SO4, Ca, NaOH, Br2, FeCl3 вступает во взаимодействие магний? Запишите уравнения возможных реакций. К 50 см3 раствора с массовой долей хлороводорода 10% (р = 1,047 г/см3) прилили раствор гидроксида натрия. Какова масса полученной соли?
Вариант-3 Чем химическая коррозия отличается от электрохимической коррозии? Осуществите химическое превращение и для реакции №1- составьте электронный баланс Mg à MgCl2 à Mg(NO3)2à Mg(OH)2 C какими из перечисленных веществ: O2, S, CO2, H2SO4, Ca, NaOH, Br2, FeCl3 вступает во взаимодействие цинк? Запишите уравнения возможных реакций. При сжигании 20г технической серы, содержащей 5% примесей. образовался газ. Рассчитайте объём выделившегося газа. Вариант-4 Укажите меры защиты металлов от коррозии. Осуществите химическое превращение и для реакции №3 составьте ионное уравнение: K à K2O à KOH à K3 PO4 C какими из перечисленных веществ: O2, S, CO2, H2SO4, Mg, NaOH, Br2, FeCl3 вступает во взаимодействие алюминий? Запишите уравнения возможных реакций. В реакцию с медью вступило 45г кислорода. Какой оксид и сколько его образовалось?
Итоговый тест 1. К классификации методов качественного анализа не относится метод анализа а) катионов б) анионов в) растворение осадка 2. К аналитическим реакциям, проводимым «мокрым» путем нельзя отнести реакцию: а) осаждения б) окрашивания пламени в) изменения окраски индикатора 3. В качественном анализе преимущественно проводят реакции а) с растворами электролитов б) с неэлектролитами в) аппаратным методом 4. В макрометоде для проведения анализа используют сухое вещество в количестве
а) 5- 10 мг. б) 10 -50 мг. в) 100 мг. 5. Выпаривание растворов проводят с целью а) повышения концентрации раствора б) понижения концентрации раствора в) отделения катионов от анионов 6. Операцию центрифугирования проводят с целью а) отделения осадка от раствора б) отделения катионов от анионов в) разделения катионов на аналитические группы 7. Если осадок растворяется медленно, то необходимо а) добавить избыток растворителя б) нагреть осадок на водяной бане в) прокалить осадок в муфельной печи 8. Аморфные осадки солей серной кислоты имеют консистенцию а) творожистых б) студенистых в) молочных 9. К катионам I аналитической группы относятся катионы a) Sn2+; Sn4+; Ag+ б) К+; Na+; NH4+ в) Са2+Mg2+; As3+ 10. К катионам II аналитической группы относятся катионы а) Hg22+; Ag+; Pb2+ б) Cu2+; K+; Pb2+ в) Sn4+; Fe2+; Na+ 11. К катионам IIIаналитической группы относятся катионы а) Ni2+;К+; Fe2+ б) Fe3+; Mn2+; Zn2+ в) Cd2+; Sb5+; Nh4+ 12. К катионам IV аналитической группы относятся катионы а) Са2+; Ва2+; Sr2+ б) Bi3+; Fe2+; Sr2+ в) Cr2+; Са2+; Mg2+ 13. К катионам V аналитической группы относятся катионы а) Sn2+; Sn4+; Cu2+ б) Bi3+; Fe3+; As3+ в) В13+; Cd2+; Co2+ 14. К катионам VIаналитической группы относятся катионы а) Cu2+; Fe2+; Мп2+ б) Mg2+; Sr2+; Sb3+ b) As5+; Sb5+; Sn4+ 15. Групповым реактивом на катионы II аналитической группы является раствор а) серной кислоты б) соляной кислоты в) гидроксида натрия 16. Групповым реактивом на катионы III аналитической группы является раствор а) гидроксида натрия б) соляной кислоты в) серной кислоты 17. Групповым реактивом на катионы III аналитической группы является избыток раствора а) гидроксида аммония б) гидроксида натрия в) соляной кислоты 18. Групповым реактивом на катионы V аналитической группы является избыток а) 6Н раствора гидроксида натрия б) концентрированный раствор гидроксида аммония в) растворы гидроксида аммония и гидроксида натрия 19. Групповым реактивом на катионы VI аналитической группы является раствор а) гидроксида натрия б) серной кислоты в) концентрированный раствор гидроксида аммония 20. К анионам I аналитической группы относятся а) Сl¯; S042-; N03¯ б) S042-; СО32-; РO43-
в) N03¯; Сl¯; С032- 21. К анионам II аналитической группы относятсяанионы а) SO42-; S2-; NO3¯ б) S042-; NO3¯; S¯ в) S2-; Сl¯; J¯ 22. Групповым реактивом на анионы I аналитической группы является раствор а) нитрата серебра б) нитрата бария в) хлорида бария 23. Групповым реактивом на анионы II аналитической группы является раствор а) нитрата серебра б) хлорида бария в) нитрата бария 24. Анализ сухой соли необходимо начинать с: а) растворения соли б) подбора растворителя в) нагревания 25. Оценка качества природных вод включает пробы на присутствие ионов: а) натрия б) калия в) аммония 26. Содержание гидрокарбоната кальция в природных водах обуславливает жесткость: а) временную б) постоянную в) общую 27. Продукты детского и диетического питания подвергают обязательному исследованию на содержание солей: а) кальция б) натрия в) аммония 28. Гидроксиды железа (II) и марганца обладают свойствами: а) слабоосновными б) кислотными в) амфотерными 29. Гидроксиды катионов (III) аналитической группы а) хорошо растворимы в воде б) не растворимы в воде в) не растворимы в растворах кислот и щелочей 30. Сульфиды катионов III аналитической группы а) растворимы в воде б) не растворимы в воде в) не растворимы в воде, но растворимы в кислотах 31. Железо входит в состав: а) кислот б) гемоглобина в) жиров 32. Марганец, цинк и хром можно отнести к: а) микроэлементам б) макроэлементам в) элементам IV аналитической группы 33. Сульфиды катионов IV аналитической группы имеют окраску а) растворов черного цвета б) осадков черного цвета в) осадков кирпично-красного цвета 34. Раствор соли нитрата серебра применяют в: а) ортопедии б) офтальмологии в) урологии 35. В водных растворах соли катиона Со2+ имеют окраску а) голубую б) розовую в) зеленую 36. В водных растворах соли катиона Ni2+имеют окраску: а) зеленую б) розовую в) голубую 37. Гидроксиды катионов V аналитической группы As3+,As5+и Sn2+, Sn4+обладают свойствами: а) основными б) кислотными в) амфотерными 38. При отравлении мышьяком появляются симптомы: а) понижается кровяное давление б) повышается кровяное давление в) появляется сухость во рту 39. Большинство анионов I аналитической группы с групповым реактивом образуют соли: а) растворимые в воде б) не растворимые в воде в) не растворимые в кислотах 40. Соли метакремниевой кислоты вследствие гидролиза имеют среду: а) кислую б) щелочную в) нейтральную 41. Большинство солей, образованных анионами III аналитической группы а) плохо растворимы в воде б) имеют групповой реактив в) не имеют группового реактива 42. Более распространенным названием титриметрического метода анализа считается: а) объемный б) весовой в) гравиметрический 43. В основе протолитометрического метода анализа лежит метод а) комплексообразования б) кислотно-основной в) окислительно-восстановительный 44. К методам редоксиметрии не относится а) иодометрия б) аскорбинометрия в) ацидометрия 45. Раствор, концентрация вещества в котором известна с высокой точностью называют а) стандартным б) рабочим в) титрованным 46. К азоиндикаторам относят а) фенолфталеин б) метиловый оранжевый в) лакмус 47. Перманганатометрическим методом определяют содержание а) этилового спирта в продуктах питания
б) меди (II) в растворах инсктицидов в) железа (II) в гербицидах 48. В основе гравиметрического метода анализа лежит закон а) «Авогадро» б) объемных отношений в) сохранения массы веществ 49. Термовесы сконструированные Дювалем применяют в методе а) титремитрии б) гравиметрии в) кулонометрии 50. Трилон Б это а) четырехосновная кислота б) нитилтриуксусная кислота в) динатриевая соль этилендиаминтетрауксусной кислоты 51. Колориметрический метод анализа можно отнести к методам а) фотометрическим б) комплекснометрическим в) гравиметрическим 52. Хроматографический метод анализа был предложен а) М.С. Цветом б) JI.A. Чугаевым в) JI.B. Писаржевским 53. Какие объем анализируемого раствора и масса анализируемого вещества характерны для микрометода? а) V = 10 -100 мл; m = 1 -10 г, б) V = 1 -10 мл; m = 0,05 -0,5 г, в) V = 0,1 -10-4 мл; m = 10-3 10-6 г, 54. Какие объем анализируемого раствора и масса анализируемого вещества характерны для макрометода? а) V = 10 -100 мл; m = 1 -10 г, б) V = 1 -10 мл; m = 0,05 -0,5 г, в) V = 0,1 -10-4 мл; m = 10-3 10-6 г, 55. Предельная концентрация выражается в: а) миллилитрах (мл) б) микрограммах (мкг) в) граммах на миллилитр (г/мл) 56. Ионное произведение воды – это: а) отрицательный логарифм концентрации ионов водорода б) произведение концентраций ионов водорода и гидроксид-ионов в) отрицательный логарифм концентрации гидроксид-ионов 57. Чему равен фактор эквивалентности серной кислоты в реакции полной нейтрализации? а) 1/2 б) 1 в) 1/3 58. Чему равен фактор эквивалентности ортофосфорной кислоты в реакции полной нейтрализации? а) 1/2 б) 1 в) 1/3 59. В каком случае растворимость хлорида серебра будет наибольшей? а) в дистиллированной воде б) в растворе нитрата серебра в) в растворе нитрата натрия 60. В комплексном соединении [Ag(NH3)2]Cl лигандом является: а) Ag+ б) Cl- в) NH3 61. В комплексном соединении [Ag (NH3)2]Cl комплексообразователем является а) Ag+ б) Cl- в) NH3 62. Групповой реактив на катионы I группы по кислотно-основной классификации (Na+, K+, NН4): а) 2н. раствор щелочи б) 2н. раствор аммиака в избытке в) группового реактива нет 63. Групповой реактив на катионы III группы по кислотно-основной классификации (Ba2+, Ca2+, Sr2+): а) 2н. раствор серной кислоты б) 2н. раствор соляной кислоты в) 2н. раствор аммиака в избытке 64. Групповой реактив на катионы V группы по кислотно-основной классификации (Fe2+, Fe3+, Mn2+, Mg2+): а) 2н. раствор аммиака в избытке б) 2н. раствор щелочи в) 2н. раствор серной кислоты
65. Количественное определение значения кислотности почвы относится к методам а) к методам окислительно-восстановительного титрования б) к методам комплексонометрического титрования в) к методам кислотно-основного титрования 66. Количественное определение значения общей жесткости воды относится: а) к методам окислительно-восстановительного титрования б) к методам осадительного титрования в) к методам комплексонометрического титрования 67. Количественное определение содержания активного хлора в растворе относится: а) к методам окислительно-восстановительного титрования б) к методам осадительного титрования в) к методам комплексонометрического титрования 68. Количественное определение хлоридов в растворе титрованием раствором нитрата серебра относится: а) к методам окислительно-восстановительного титрования б) к методам осадительного титрования в) к методам комплексонометрического титрования 69. Количественное определение содержания растворенного кислорода в воде относится: а) к методам окислительно-восстановительного титрования б) к методам осадительного титрования в) к методам кислотно-основного титрования 70. Под какой буквой перечислены только сильные электролиты? а) H2O, H2SO4 б) Ca(OH)2, H Cl в) HClO4, C6H12O6 71. Под какой буквой перечислены только слабые электролиты? а) HNO2, H2SiO3 б) H2O, Ca(OH)2 в) H2SO4, FeCl3 72. Под какой буквой перечислены только не электролиты? а) C6H6, HCN б) Ag3(PO4)2, (CH3)2O в) C6H10O5, CaC2 73. Под какой буквой перечислены только соли, гидролизующиеся по катиону? а) FeCl3, KNO2 б) CoCl2, ZnSO4 в) KI, MgSO4 74. Под какой буквой перечислены только соли, гидролизующиеся по аниону? а) CH3COOK, Na2S б) CrCl3, Сa(NO3)2 в) NH4NO2, CoCl2, 75. Под какой буквой перечислены только соли, подвергающиеся полному гидролизу? а) Ag3(PO4)2, (Cu OH)2CO3, б) Zn S, Cu Cl в) CuCO3, Fe(CN)3 76. Метод анализа, рабочим раствором которого является Na2S2O3 а) иодометрия б) фотометрия в) спектрофотометрия 77. Какая из перечисленных операций производится при гравиметрическом анализе? а) добавление индикатора б) фильтрование в) подкисление раствора 78. К достоинствам гравиметрического метода анализа относят: а) точность метода б) быстрота метода в) простота метода 79. Для труднорастворимого соединения Ca3(PO4)2 произведение растворимости выражается как: а) ПР =[Са] ×[PO4] б) ПР = Р5 в) ПР = 0 80. Какие из перечисленных систем обладают буферными свойствами? а) ацетат натрия + уксусная кислота б) хлорид натрия + соляная кислота в) азотная кислота + нитрат аммония 81. В растворе комплексного соединения K3[Fe(CN)6] можно обнаружить в значительных количествах: а) K+ б) Fе3+ в) CN- 82. Какие из перечисленных терминов являются величинами, характеризующими количественный состав раствора: а) объемная доля б) молярная концентрация в) массовая доля 83. Метод кислотно-основного титрования, где рабочим раствором является кислота, называется а) ацидиметрия б) алкалиметрия в) иодометрия 84. Реакция обменного разложения соли, протекающая под действием воды, называется
а) окисление б) гидролиз в) нейтрализации 85. Отношение концентрации гидролизованных молей к общей концентрации вещества называется а) степень диссоциации б) степень растворимости в) степень гидролиза 86. Степень окисления калия в соединении К3[Fe (СN)6] а) -1 б) + 3 в) + 1 87. Буферным действием обладают растворы: а) Na Cl + Na OH б) NaCl + НС1 в) NaH2P04 + Na2HP04 88. Определить степень окисления хрома в соединении К2Cr2O7: а) + 6 б) + 3 в) + 9 89. Какой индикатор используется в методе нейтрализации: а) лакмус б) метилоранж в) фенолфталеин 90. Определить степень окисления марганца в соединении КМnО4 а) + 1 б) + 7 в) - 2 91. Какая концентрация называется эквивалентной молярной: а) нормальная б) процентная в) массовая 92. Аналитический сигнал -это: а) выпадение осадка б) появление характерного запаха в) образование окраски 93. Метод анализа, рабочим раствором которого является КМnО4 а) иодометрия б) перманганатометрия в) колориметрия 94. Специфическим реагентом на катион аммония является: а) реактив Несслера K2[HgJ4]+КОН б) гидротартрат натрия NaHC4H4О 6 в) гидроксид натрия NaOH 95. Нитритометрнческнй метод применяют для анализа: а) фенолов б) фенолокислот в) ароматических первичных аминов 96. Требования к реакциям в титриметрии: а) обратимость б) большая скорость реакции в) растворимый продукт реакции 97. Признаком фиксирования конечной точки титрования является: а) изменение окраски раствора б) выпадение осадка в) появление характерного запаха 98. Метод ионообменной хроматографии основан на: а) различии в распределении веществ между двумя фазами б) обмене ионами между веществом и сорбентом в) различной подвижности веществ на сорбенте 99. Химический анализ включает: а) качественный анализ б) элементный анализ в) функциональный анализ 100 Способы выражения концентрации титрованных растворов: а) массовая доля б) молярная концентрация эквивалента в) процентная концентрация Ответы на тесты
Дифференцированный зачет по учебной дисциплине «Химия»
Вариант 1 К каждому из заданий даны несколько вариантов ответов, из которых только один правильный, номер этого ответа запишите. 1. Число электронов, которые содержатся в атоме углерода равно: 1) 6; 2) 12; 3) 8 2. Распределение электронов в атоме элемента: 2, 8, 4 Химический знак этого элемента: 1) C; 2) O;3) Si 3. Радиусы атомов химических элементов в ряду: хлор, фосфор, алюминий, натрий: 1) увеличиваются; 2) уменьшаются; 3) не изменяются. 4. Химическая связь в молекуле воды: 1) ионная; 2) ковалентная полярная; 3) ковалентная неполярная. 5. Формулы кислотных оксидов: 1) CO2 и CaO; 2) CO2 и SO3; 3) K2O и Al2O3 6. Формула сеоводородной кислоты: 1) H2S;2) H2SO4;3) H2SO3 7. К реакциям обмена относится: 1) CaO + H2O= Ca(OH)2; 2) Сu (OH)2= CuO + H2O; 3) KOH + HNO3= KNO3 + H2O 8. Электролиты, при диссоциации которых образуются катионы металла, и анионы кислотного остатка называются: 1) кислотами; 2) солями; 3) основаниями. 9. Какая степень окисления хрома в К 2Сr 2О 7? 1) +6; 2) +3; 3) -3; 4) -6. 10. Присутствие в растворе кислоты можно доказать с помощью: 1) лакмуса; 2) фенолфталеина; 3) щелочи 11. Вещества с общей формулой CnH2n относятся к классу 1) алканов 2) алкенов 3) алкинов 4) аренов 12. Вещество, формула которого С2Н6 относится к классу 1) алканов 2) алкенов 3) алкинов 4) аренов 13. Вещество, формула которого СН3 – СН2 – СН2 – СН3 является 1) алканом 2) алкеном 3) алкином 4) ареном 14. Вещество, формула которого СН2 = СН – СН – СН3 называется ǀ СН3 1) 2-метилбутен-3 3) 3-метилбутен-1 2) 2-метилбутин-3 4) 3-метилбутин-1 15. Характерной химической реакцией для веществ, имеющих общую формулу СnH2n+2, является реакция 1) замещения 2) гидрирование 3) присоединение 4) гидратации 16.Укажите «лишнее» вещество в ряду: 1) бутаналь 2) пропанол; 3) метаналь; 4) ацетальдегид. 17. Функциональная группа – СОН характерна для: 1) альдегидов 2) сложных эфиров; 3) карбоновых кислот 4) спиртов. 18. Гомологом ацетилена является
1) С2Н6 2) С6Н6 3) С4Н6 4) СН4
Вариант 2 К каждому из заданий даны несколько вариантов ответов, из которых только один правильный, номер этого ответа запишите. 1. Число нейтронов, которые содержатся в атоме кислорода равно: 1) 6; 2) 12; 3) 8.
1) N2 O5; 2) P2 O5; 3) B2O3 . 3. Наиболее ярко выраженные неметаллические свойства проявляет: 1) фосфора 2) сера;3) кремний. 4. Формула вещества с ковалентной полярной связью: 1) H2O; 2) O2 ; 3) CaCl2 5. Формула основания и кислоты соответственно: 1) Ca (OH)2 и Be(OH)2 ; 2) NaOH и KHSO4; 3) Al(OH)3 и HNO3 6. Формула сульфита натрия: 1) Na2SO4 2) Na2SO3; 3) Na2S 7. К реакциям замещения относится: 1) Ca + H2SO4= CaSO4 + H2; 2) Сu (OH)2= CuO + H2O; 3) KOH + HNO3= KNO3 + H2O 8. Электролиты, при диссоциации которых образуются катионы металла и гидроксид-ионы называются: 1) солями;2) кислотами;3) основаниями. 9. В ПСХЭ в группе сверху вниз увеличивается: 1) металлические свойства 2) сила высших кислот; 3) электроотрицательность атома 4) неметаллические свойства 10.Назовите элемент, распределение электронов в атоме которого: 2, 8, 7. 1) фосфор; 2) сера 3) хлор;4) кислород. 11. Общая формула алканов: 1) CnH2n 2) CnH2n+2 3) CnH2n-2 4) CnH2n-6 12. К классу алкенов относится вещество с молекулярной формулой 1) С6Н10 2) С6Н6 3) С6Н12 4) С6Н14 13. Вещество, формула которого СН3 – С ≡ С – СН3 является 1) алканом 2) алкеном 3) алкином 4) ареном 14. Гомологом этана является 1) С2Н4 2) С2Н2 3) С3Н8 4) С3Н6 15. Укажите название соединения СН2 = СН – СН2 – СН2 – СН2 – СН3 1) 3-метилбутин-1 2) октен-1 3) пентин-1 4) гексен-1 16. Для алкенов характерна реакция 1) замещения 2) обмена 3) присоединения 4) дегидратации 17. Укажите «лишнее» вещество в ряду: 1) метанол2) этаналь3) пентанол;4) бутиловый спирт. 18. Функциональная группа – СООН характерна для 1) альдегидов 2) сложных эфиров;3) карбоновых кислот4) спиртов. КРИТЕРИИ ОЦЕНКИ ТЕСТА «5» – 16-18 правильных ответов «4» – 13-15 правильных ответов «3» – 10-12 правильных ответов «2» - 9 и менее правильных ответов КОДИФИКАТОР дифференцированного зачета по дисциплине: Химия
Вопросы к дифференцированному зачету по химии Тестовые задания
Часть 1 У атома серы число электронов на внешнем энергетическом уровне и заряд ядра равны соответственно
B главных подгруппах периодической системы восстановительная способность атомов химических элементов растет c
Соединениями с ковалентной полярной и ковалентной неполярной связью являются соответственно
Степень окисления азота в ионе NН4+ равна
Атомную кристаллическую решетку имеет каждое из двух веществ:
К основным оксидам относится
В ряду натрий – магний – алюминий элементы расположены в порядке увеличения
Какой из металлов не вытесняет водород из разбавленной серной кислоты?
Оксиды с общей формулой R2O3 и R2O5 образуют элементы подгруппы
Наиболее энергично реагирует с водой
Bодород проявляет свойства окислителя при взаимодействии с
При нагревании оксида железа (II) с оксидом углерода (II) образуются углекислый газ и
При нагревании гидроксида меди (II) образуются
Хлороводородная (соляная) кислота реагирует с
Соль и щелочь образуются при взаимодействии растворов
В схеме превращений Al OH)3 веществами «А» и «В» могут быть соответственно
Какой вид изомерии нехарактерен для спирта, формула которого C5H11OH?
К соединениям, имеющим общую формулу СnH2n, относится
B молекуле ацетилена имеются
Фенол взаимодействует с
Уксусный альдегид реагирует с каждым из двух веществ:
При взаимодействии карбоновых кислот и спиртов образуются
Реакция, уравнение которой Zn (OН)2 + H2SO4 = ZnSO4 + 2H2O, относится к реакциям
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-11; просмотров: 245; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.146.105.137 (0.421 с.) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
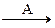 X
X 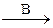 Al(OH)3
Al(OH)3


