Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Энергия активации - это разность между наименьшим избыточным значением энергии частиц необходимым для осуществления реакции и средним значением энергии исходных веществ.
Разность Е1-Е2 равна тепловому эффекту реакции ΔН. Не любое соударение частиц приводит к химической реакции с ними. Для того, чтобы столкновение было результативным частицы должны обладать некоторым значением энергии. Чем больше энергия активации, тем меньше скорость химической реакции. Энергия активации является постоянной величиной для данной химической реакции и не зависит от температуры, а скорость реакции зависит. Чем меньше температура, тем выше средняя энергия исходных веществ, тем больше скорость реакции. Константа скорости химической реакции связана с величиной энергии активации уравнением Аррениуса:
где ko – предэкспоненциальный множитель, зависящий от природы реагирующих веществ.
Для расчета энергии активации Е a применяют расчетный и графический методы. Расчетный способ: энергию активации химической реакции можно вычислить по значениям констант скоростей при двух различных температурах по уравнению:
Уравнение для расчета энергии активации имеет вид:
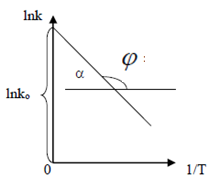
Графический: поэкспериментальным данным необходимо построить график в координатах lnk - 1/T. На графике (рис.) получается прямая линия, тангенс угла наклона которой равен: tg α = Еа / R. Тангенс угла наклона рассчитывают по отношению катетов треугольника.
Теории химической кинетики
1) Теория активных столкновений была разработана Аррениусом на базе молекулярно-кинетических представлений. Согласно этой теории, для того чтобы между веществами А и В произошла реакция, их молекулы должны столкнуться. Частота столкновений Z пропорциональна произведению концентраций [ А ]·[ В ]. Если бы каждое столкновение приводило к химическому взаимодействию, скорость равнялась бы частоте столкновений. Расчеты показывают, что скорости химических реакций были бы очень высоки.В действительности частота столкновений Z на много порядков больше реальных скоростей химических реакций. Аррениус предположил, что только активные столкновения молекул приводят к химическому взаимодействию. Под активными столкновениями понимают столкновения, в которых суммарная энергия поступательного движения по линии, соединяющей центры сталкивающихся молекул, больше либо равна некоторой минимальной энергии.
Минимальная энергия, которая необходима для того, чтобы между молекулами при их столкновении произошло химическое взаимодействие, получило название энергии активации. Соотношение между константой скорости реакции, частотой столкновений и долей активных столкновений описывает уравнение Аррениуса:
где k – константа скорости реакции; Z – частота столкновений (число столкновений в единице объема за единицу времени); Еа – энергия активации, Дж/моль; R - универсальная газовая постоянная; Т – абсолютная температура, К. Множитель Из уравнения Аррениуса видно, что доля активных столкновений, а значит и константа скорости тем больше, чем меньше энергия активации и чем выше температура. 2) Теория активированного комплекса. Эту теорию предложили Г. Эйринг и М. Поляни (1935). Основные положения: - при сближении реагирующих частиц наблюдается почти непрерывный переход из начального состояния в конечное, который протекает через образование переходного комплекса с максимальной потенциальной энергией; - переходный комплекс находится в равновесии с исходными веществами; -образованиe переходного комплекса является лимитирующей стадией процесса; -энергия активации представляет собой разность энергий активированного комплекса и средней энергии исходных веществ. Например, рассмотрим механизм реакции А + ВС → АВ + С Согласно теории активированного комплекса при сближении атома А с молекулой ВС ослабляется связь В – С и возникает связь А – В. Процесс завершается образованием молекулы АВ и атома С, для чего система должна пройти через активированный комплекс АВС*, когда атом В в одинаковой степени принадлежит молекулам ВС и АВ: А + ВС → АВС* → АВ + С.
Сложные реакции Многие реакции имеют дробный или изменяющийся во времени порядок, поскольку они протекают по определенному механизму, включающему более одной стадии. Сложные реакции – это несколько одновременно протекающих химических реакций с общими реагентами. Каждая из них идѐт независимо от других и подчиняется закону действующих масс.
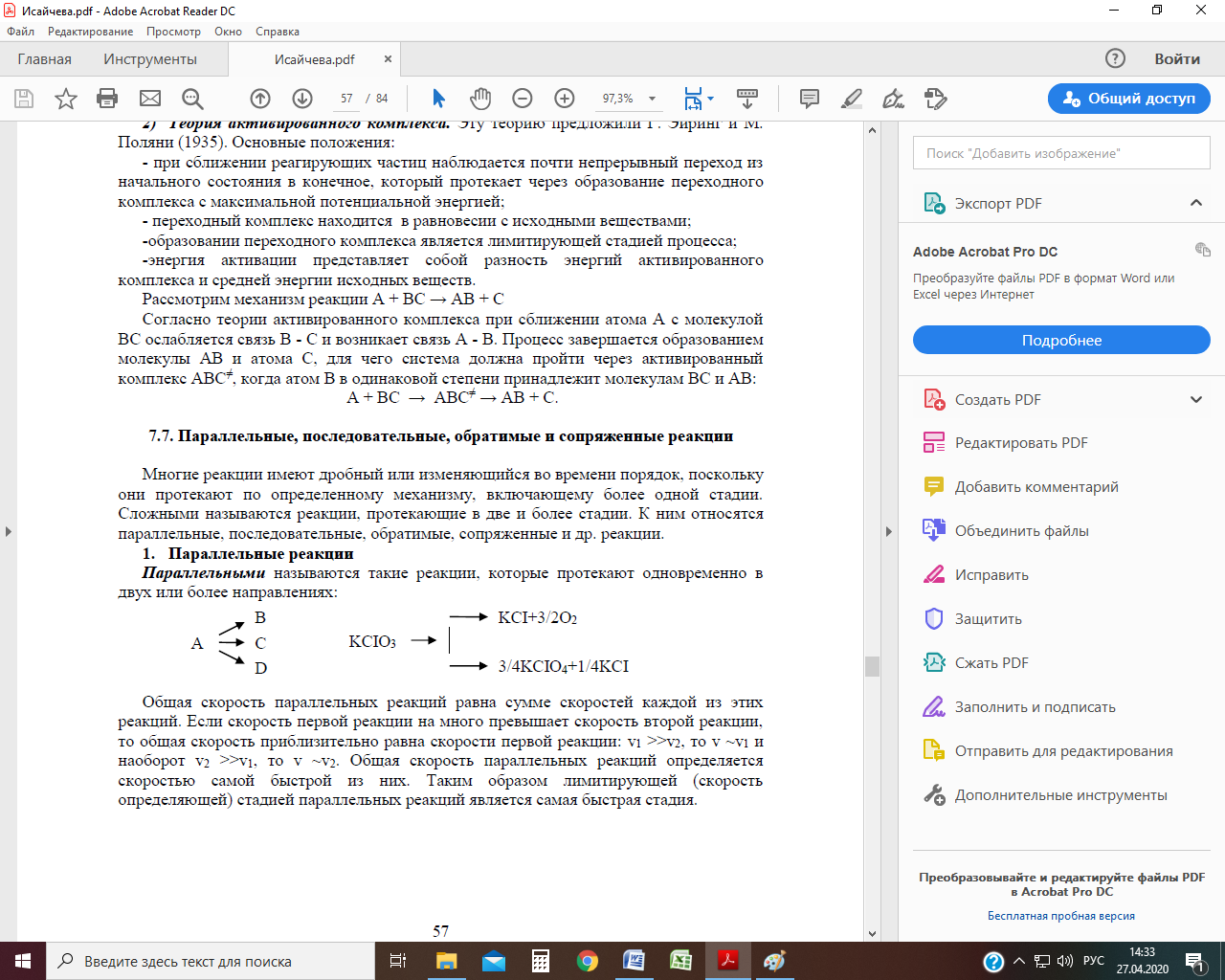
К ним относятся параллельные, последовательные, обратимые, сопряженные и др. реакции. Параллельные реакции К параллельным реакциям относятся такие химические превращения, в которых исходное вещество А одновременно превращается в два разных продукта В и D. Для параллельных реакций первого порядка схема превращений имеет вид:
где k 1 и k 2 – константы скоростей образования соответственно веществ В и D. Очевидно, что скорость исчезновения вещества А (w) равна сумме скоростей появления веществ В (w 1 ) и D (w 2 ): w = w 1 +w 2 = k 1 С + k 2 С, где С – мгновенная концентрация вещества А. Общая скорость параллельных реакций определяется скоростью самой быстрой из них. Таким образом, лимитирующей (скорость определяющей) стадией параллельных реакций является самая быстрая стадия. Кинетические кривые для случая двух параллельных реакций первого порядка:
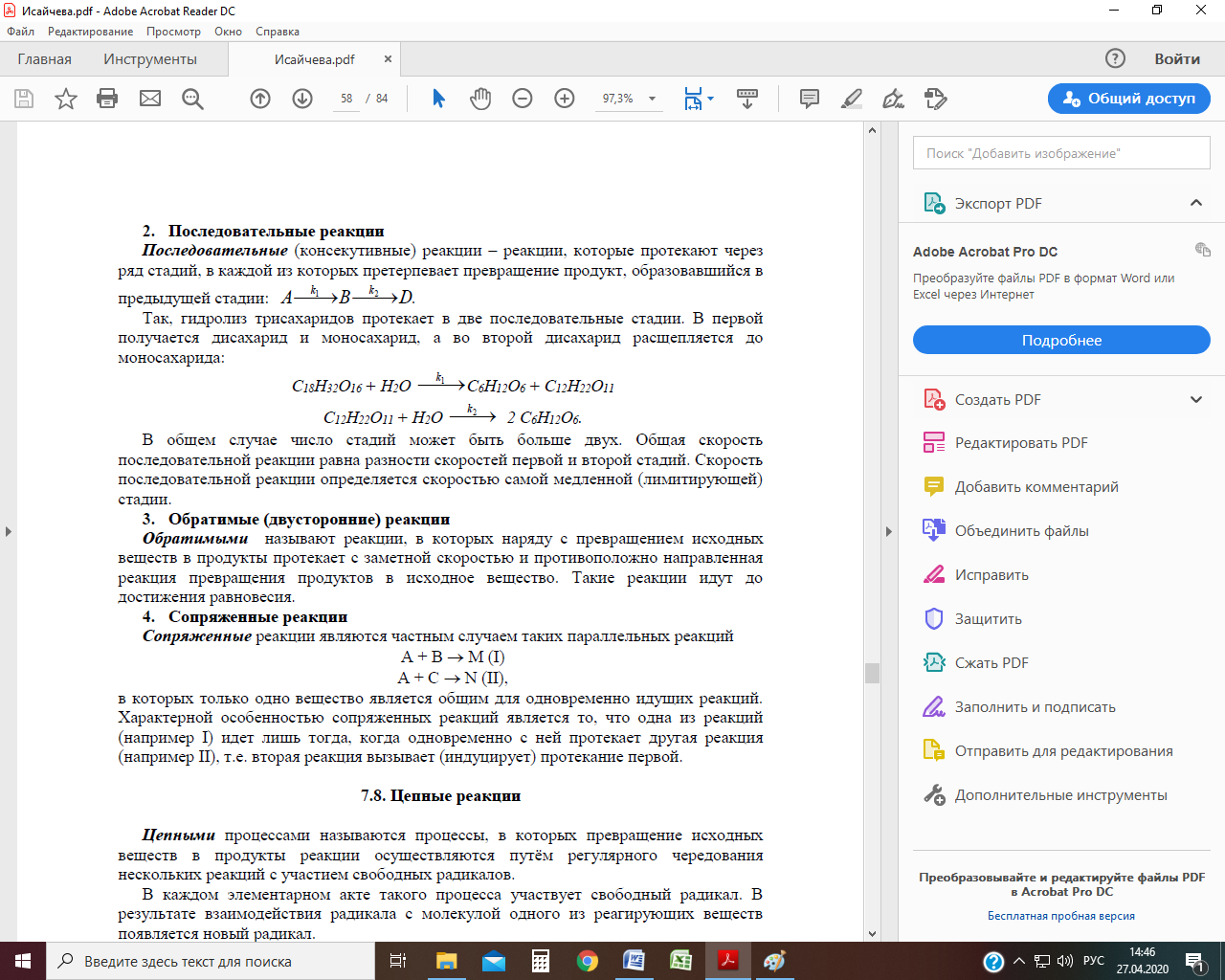
Рис. Зависимость концентрации реагента и продукта от времени для параллельных реакций первого порядка при k1 > k2 Последовательные реакции Последовательные реакции – реакции, которые протекают через ряд стадий, в каждой из которых претерпевает превращение продукт, образовавшийся в предыдущей стадии:
Согласно этой схеме вещество А превращается в В, из которого затем образуется D. Константа скорости первой реакции k 1, второй – k 2. Скорость исчезновения вещества А равна: w 1 =k 1 С 1, вещество В появляется со скоростью исчезновения А, которое одновременно превращается в D со скоростью: w 2 = k 2 С 2, соответственно, скорость изменения концентрации В составит: w В = w 1 – w 2 = k 1 С 1 – k 2 С 2. Вещество D появляется со скоростью исчезновения В. Общая скорость последовательной реакции равна разности скоростей первой и второй стадий. Скорость последовательной реакции определяется скоростью самой медленной (лимитирующей) стадии. Так, гидролиз трисахаридов протекает в две последовательные стадии. В первой получается дисахарид и моносахарид, а во второй дисахарид расщепляется до моносахарида:
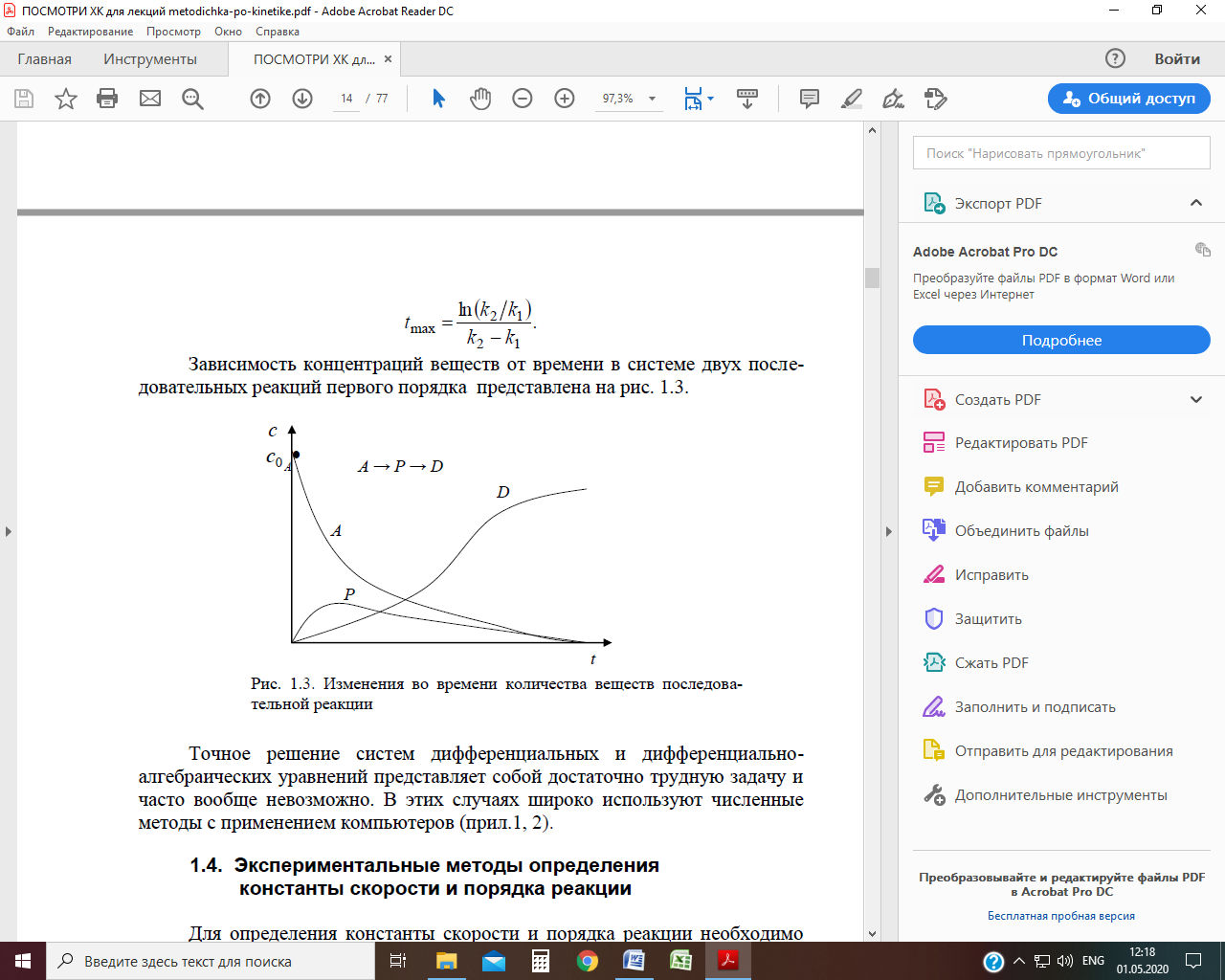
В общем случае число стадий может быть больше двух. Зависимость концентраций веществ от времени в системе двух последовательных реакций первого порядка представлена на рис.
Рис. Изменения во времени количества веществ последовательной реакции
|
||||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 159; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.218.168.16 (0.008 с.) |
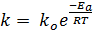


 называют экспоненциальным, он характеризует долю активных столкновений молекул от общего числа.
называют экспоненциальным, он характеризует долю активных столкновений молекул от общего числа.