Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кинетическая классификация реакций.Стр 1 из 5Следующая ⇒
ХИМИЧЕСКАЯ КИНЕТИКА Контрольные вопросы: 1. Основные понятия и постулаты химической кинетики. Скорость гомогенной реакции. Кинетическая кривая, кинетическое уравнение, молекулярность, порядок, константа скорости. Необратимые реакции нулевого, первого, второго и третьего порядков. Время полупревращения. Методы определения порядка реакции. 2. Влияние температуры на скорость химической реакции. Уравнение Аррениуса, энергия активации. 3. Теория столкновений. Частота столкновений, стерический фактор. Механизм мономолекулярной реакции в газовой фазе. Теория переходного состояния (теория активированного комплекса). 4. Сложные реакции первого порядка: обратимые, параллельные, последовательные, сопряженные. Лимитирующая стадия. Фотохимические реакции. Цепные реакции. 5. Определение катализа. Общие принципы катализа. Классификация каталитических реакций. гомогенный катализ. Кислотно-основной катализ. Гетерогенный катализ. Особенности гетерогенных каталитических процессов. Роль адсорбции в каталитическом акте. Активные центры, образование кластеров на поверхности катализаторов. промотирование и отравление катализаторов. Каталитическая активность и селективность катализаторов. Ферментативный катализ. Формальная кинетика Химическая кинетика представляет собой учение о скоростях химических реакций, о факторах, определяющих эти скорости (природы реагирующих веществ, концентрации, температуры, присутствия катализаторов и др.), а также о механизме химических реакций.
Зависимость скорости от концентрации реагирующих веществ Зависимость скорости реакции от концентрации реагирующих веществ определяет основной постулат химической кинетики: скорость химической реакции прямо пропорциональна произведению концентрации реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции при условиях постоянства всех остальных факторов (температуры, состава). Например, если реагируют вещества А и В, то
где k - константа скорости реакции; ni –порядок реакции по данному i -му реагенту.
Это аналитическое выражение закона, установленного в 1867 году норвежскими учеными К. М. Гульдбергом и П. Вааге. Он известен под названием закона действующих масс.
Коэффициент пропорциональности k называется константой скорости химической реакции. Константа скорости реакции k численно равна скорости реакции, если концентрации всех участников реакции равны единице. По физическому смыслу константа скорости – это удельная скорость реакции или стандартная скорость (при ci =1), поэтому еѐ величина зависит от всех факторов, которые влияют на скорость реакции, за исключением концентрации реагирующих веществ. Единицы ее измерения определяются видом кинетического уравнения. Порядок реакции
Порядок реакции определяется величиной показателя степени в кинетическом уравнении реакции. Каждый из показателей степени при концентрациях (n 1 и n 2) выражает частный порядок реакции по данному компоненту. Сумма показателей степени при концентрациях (n 1+ n 2) определяет полный порядок реакции. n = n1 + n2. Он может принимать целые, дробные, положительные, отрицательные, а также нулевые значения. Если стехиометрическое уравнение правильно отражает истинный механизм реакции, то n 1 =a и n 2 =b. Только для простых реакций уравнение скорости соответствует стехиометрическому уравнению. Порядок реакции понятие формальное, поскольку в большинстве случаев не отражает механизма реакции. Определяется порядок реакции экспериментально и отражает зависимость скорости реакции от концентрации вещества. Если скорость реакции не зависит от концентрации реагирующих веществ, то реакция имеет нулевой порядок. Если скорость реакции зависит от концентрации вещества в первой степени, то это реакция первого порядка; если во второй степени, то это реакция второго порядка и так далее. Молекулярность реакции Химический процесс протекает через ряд последовательных стадий, состоящих из множества одинаковых повторных превращений – элементарных актов. Число молекул (частиц), принимающих участие в элементарном акте химического превращения, называется молекулярностью реакции. Молекулярность реакции всегда целочисленна, положительна и не превышает трех. Различают следующие реакции:
-мономолекулярные, в которых только один вид молекул претерпевает превращение, причем стехиометрический коэффициент в уравнении равен единице, например: A → C или A → C + D; Примером монолекулярных реакций могут служить реакции изомеризации (внутримолекулярной перегруппировки), термического разложения: СНзNСНз → С2Н6 + N2 (разложение азометана); CH3OCH3 → CH4 + H2 + CO (разложение диметилового эфира). -бимолекулярные, в элементарном акте участвуют две молекулы, например: 2A → C; A + B → C; A + B → C + D; Примеры: H2 + J2 → 2HJ; CH3COOH + C2H5OH → CH3COOC2H5 + H2O. -тримолекулярные, в элементарном акте участвуют три молекулы, например: A + B + C → M; 3A → M; A + B + C → M + N. Вероятность одновременного столкновения сразу трех и большего числа молекул меньше, чем вероятность столкновения двух молекул. Поэтому тримолекулярные реакции менее вероятны, чем бимолекулярные. Тримолекулярных реакции: 2NO + H2 → N2O + H2O; 2NO + O2 → 2NO2.
Молекулярность - это теоретическое понятие. Она отражает механизм реакции, дает представление о том какие именно и через какие стадии идет образование продуктов. В простых (элементарных) реакциях, протекающих в одну стадию порядок реакции и молекулярность совпадают и имеют целое положительное значение. Для большинства реакций порядок реакции меньше молекулярности. Чаще всего молекулярность и порядок реакции различны из-за сложного механизма протекания реакций. Зачастую одна из стадий сложной реакции является более медленной, лимитирующей ее течение и определяющей скорость всего процесса в целом. Порядок реакции в таком случае равен молекулярности этой самой медленной стадии. Другой причиной расхождения между молекулярностью и порядком реакции может быть значительный избыток одного из реагентов в реакционной смеси. Тогда концентрация этого реагента остается практически постоянной в течение реакции, а порядок реакции будет меньше, чем определенный по стехиометрическому уравнению.
Случаи несовпадения порядка реакции и молекулярности: 1) Большой избыток одного из реагирующих веществ. 2) Для гетерогенных реакций учитывается концентрация только газообразных веществ. 3) Сложный механизм реакции.
Теории химической кинетики
1) Теория активных столкновений была разработана Аррениусом на базе молекулярно-кинетических представлений. Согласно этой теории, для того чтобы между веществами А и В произошла реакция, их молекулы должны столкнуться. Частота столкновений Z пропорциональна произведению концентраций [ А ]·[ В ]. Если бы каждое столкновение приводило к химическому взаимодействию, скорость равнялась бы частоте столкновений. Расчеты показывают, что скорости химических реакций были бы очень высоки.В действительности частота столкновений Z на много порядков больше реальных скоростей химических реакций. Аррениус предположил, что только активные столкновения молекул приводят к химическому взаимодействию. Под активными столкновениями понимают столкновения, в которых суммарная энергия поступательного движения по линии, соединяющей центры сталкивающихся молекул, больше либо равна некоторой минимальной энергии. Минимальная энергия, которая необходима для того, чтобы между молекулами при их столкновении произошло химическое взаимодействие, получило название энергии активации.
Соотношение между константой скорости реакции, частотой столкновений и долей активных столкновений описывает уравнение Аррениуса:
где k – константа скорости реакции; Z – частота столкновений (число столкновений в единице объема за единицу времени); Еа – энергия активации, Дж/моль; R - универсальная газовая постоянная; Т – абсолютная температура, К. Множитель Из уравнения Аррениуса видно, что доля активных столкновений, а значит и константа скорости тем больше, чем меньше энергия активации и чем выше температура. 2) Теория активированного комплекса. Эту теорию предложили Г. Эйринг и М. Поляни (1935). Основные положения: - при сближении реагирующих частиц наблюдается почти непрерывный переход из начального состояния в конечное, который протекает через образование переходного комплекса с максимальной потенциальной энергией; - переходный комплекс находится в равновесии с исходными веществами; -образованиe переходного комплекса является лимитирующей стадией процесса; -энергия активации представляет собой разность энергий активированного комплекса и средней энергии исходных веществ. Например, рассмотрим механизм реакции А + ВС → АВ + С Согласно теории активированного комплекса при сближении атома А с молекулой ВС ослабляется связь В – С и возникает связь А – В. Процесс завершается образованием молекулы АВ и атома С, для чего система должна пройти через активированный комплекс АВС*, когда атом В в одинаковой степени принадлежит молекулам ВС и АВ: А + ВС → АВС* → АВ + С.
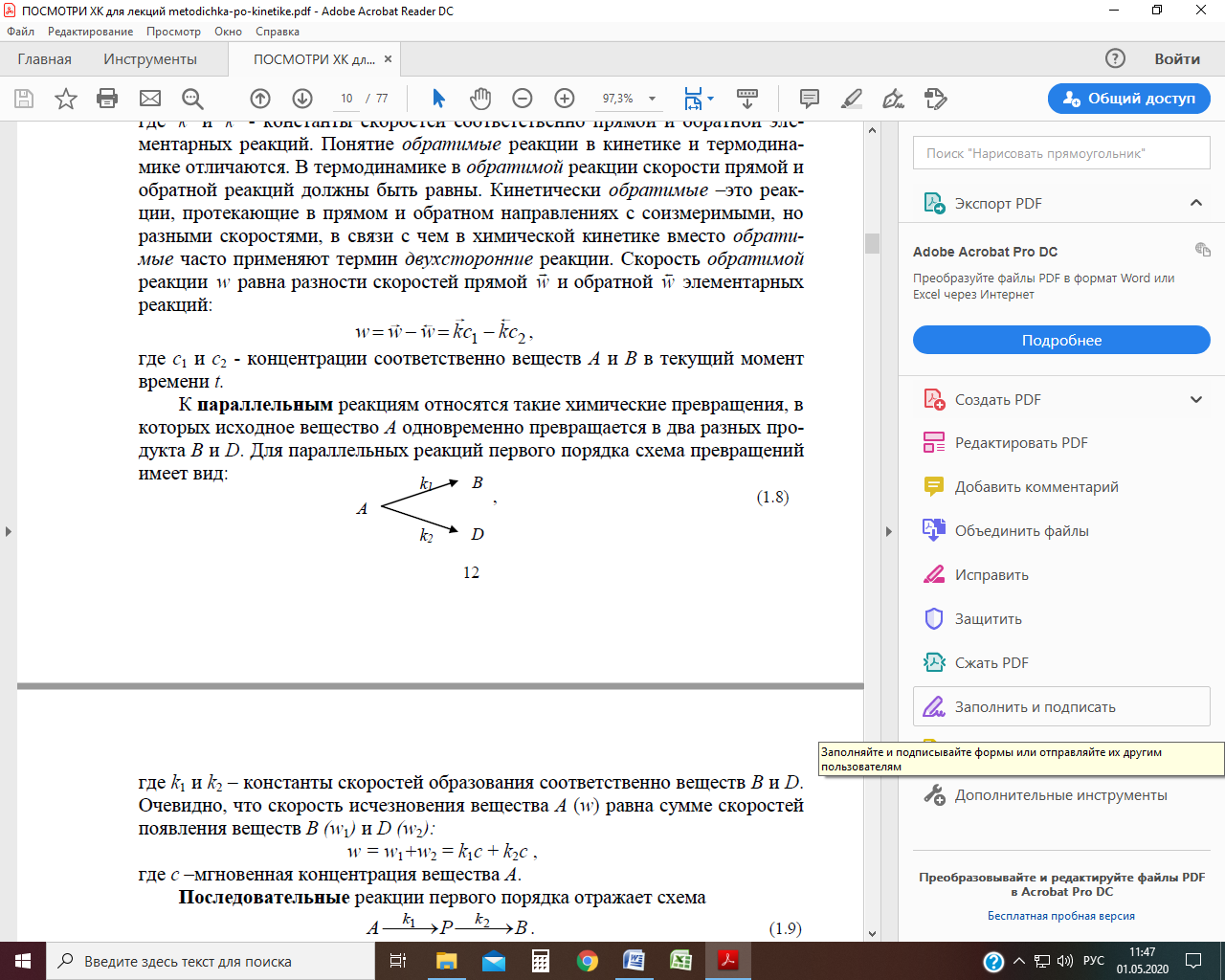
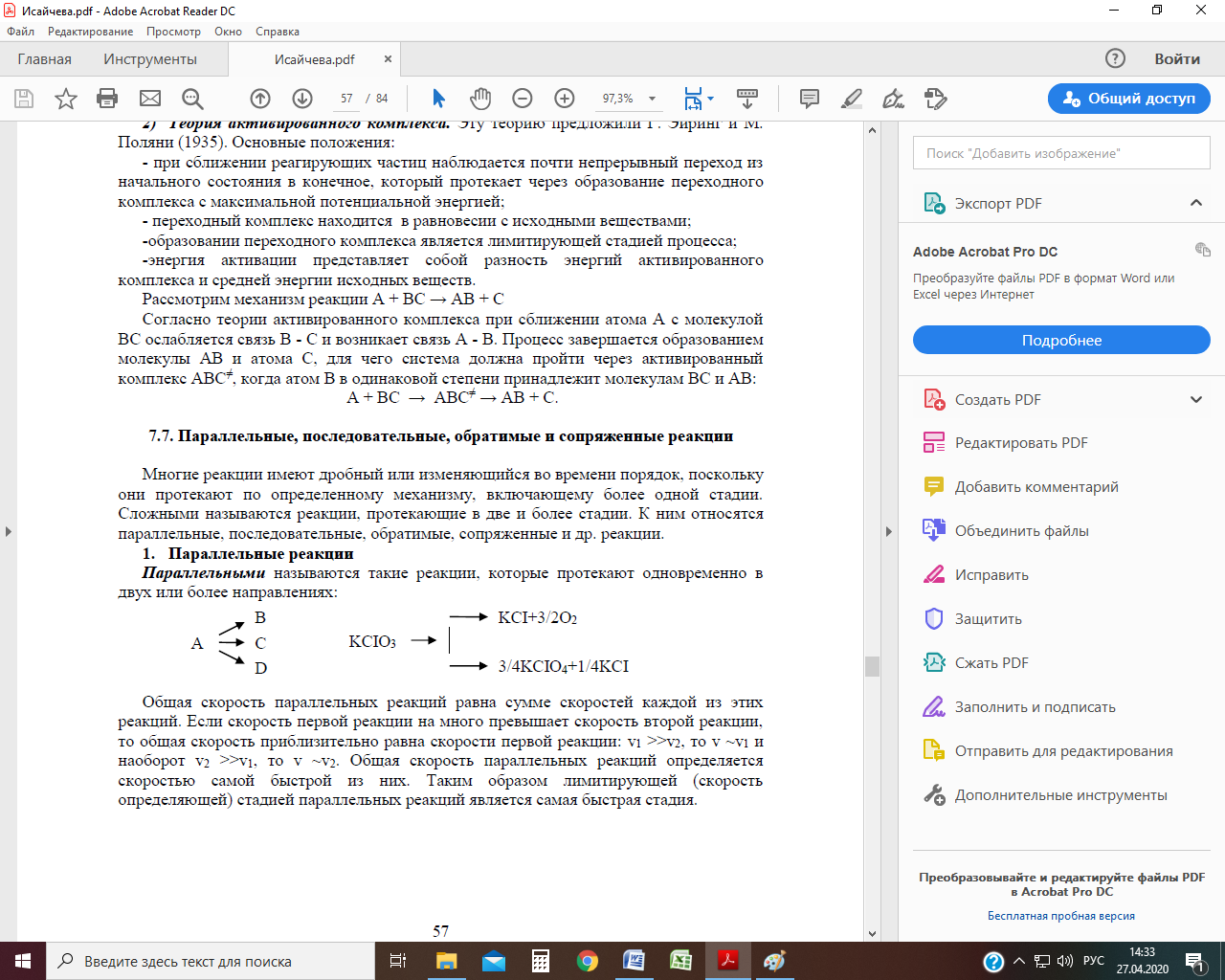
Сложные реакции Многие реакции имеют дробный или изменяющийся во времени порядок, поскольку они протекают по определенному механизму, включающему более одной стадии. Сложные реакции – это несколько одновременно протекающих химических реакций с общими реагентами. Каждая из них идѐт независимо от других и подчиняется закону действующих масс. К ним относятся параллельные, последовательные, обратимые, сопряженные и др. реакции. Параллельные реакции К параллельным реакциям относятся такие химические превращения, в которых исходное вещество А одновременно превращается в два разных продукта В и D. Для параллельных реакций первого порядка схема превращений имеет вид:
где k 1 и k 2 – константы скоростей образования соответственно веществ В и D. Очевидно, что скорость исчезновения вещества А (w) равна сумме скоростей появления веществ В (w 1 ) и D (w 2 ): w = w 1 +w 2 = k 1 С + k 2 С, где С – мгновенная концентрация вещества А. Общая скорость параллельных реакций определяется скоростью самой быстрой из них. Таким образом, лимитирующей (скорость определяющей) стадией параллельных реакций является самая быстрая стадия. Кинетические кривые для случая двух параллельных реакций первого порядка:
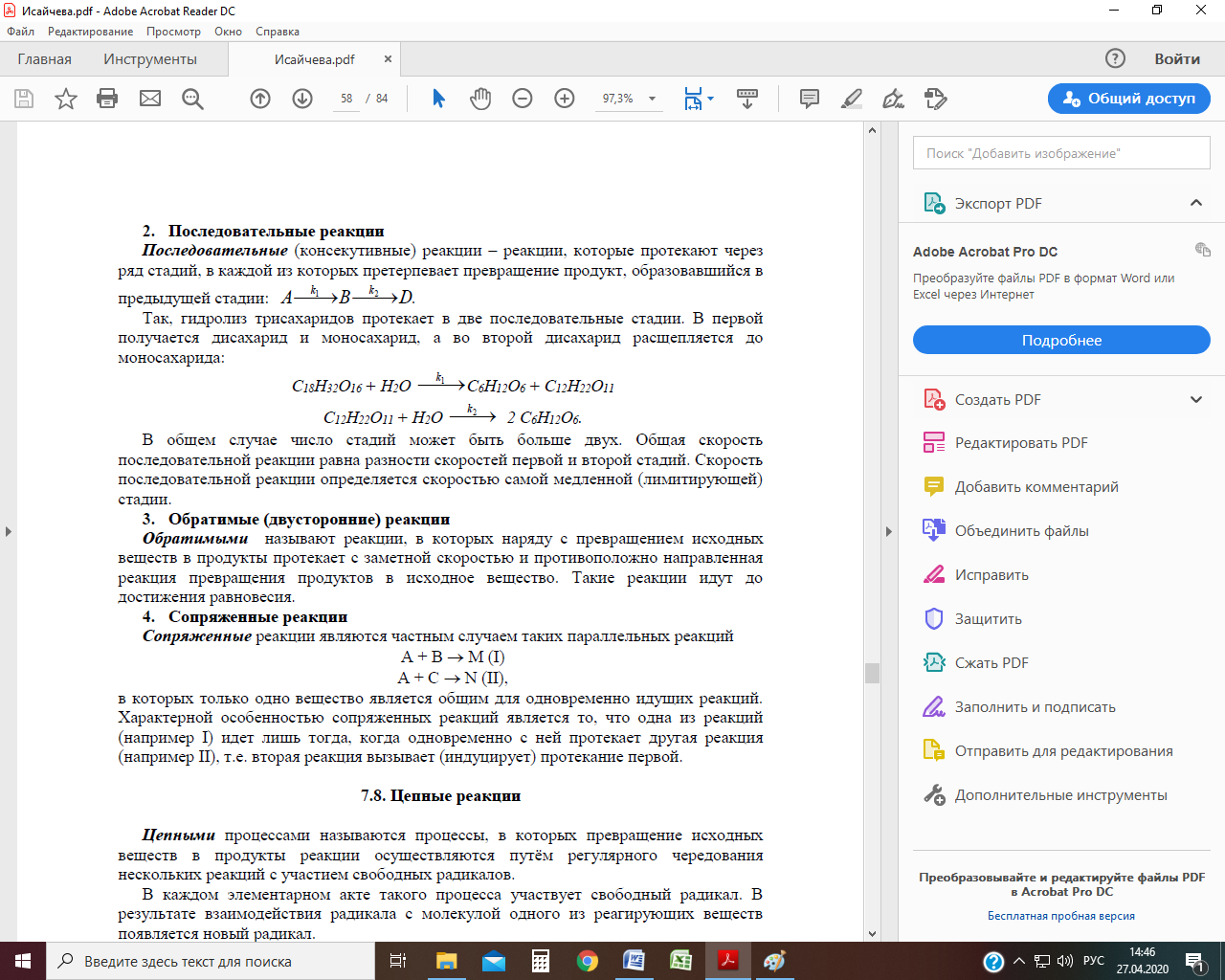
Рис. Зависимость концентрации реагента и продукта от времени для параллельных реакций первого порядка при k1 > k2 Последовательные реакции Последовательные реакции – реакции, которые протекают через ряд стадий, в каждой из которых претерпевает превращение продукт, образовавшийся в предыдущей стадии:
Согласно этой схеме вещество А превращается в В, из которого затем образуется D. Константа скорости первой реакции k 1, второй – k 2. Скорость исчезновения вещества А равна: w 1 =k 1 С 1, вещество В появляется со скоростью исчезновения А, которое одновременно превращается в D со скоростью: w 2 = k 2 С 2, соответственно, скорость изменения концентрации В составит: w В = w 1 – w 2 = k 1 С 1 – k 2 С 2. Вещество D появляется со скоростью исчезновения В. Общая скорость последовательной реакции равна разности скоростей первой и второй стадий. Скорость последовательной реакции определяется скоростью самой медленной (лимитирующей) стадии. Так, гидролиз трисахаридов протекает в две последовательные стадии. В первой получается дисахарид и моносахарид, а во второй дисахарид расщепляется до моносахарида:
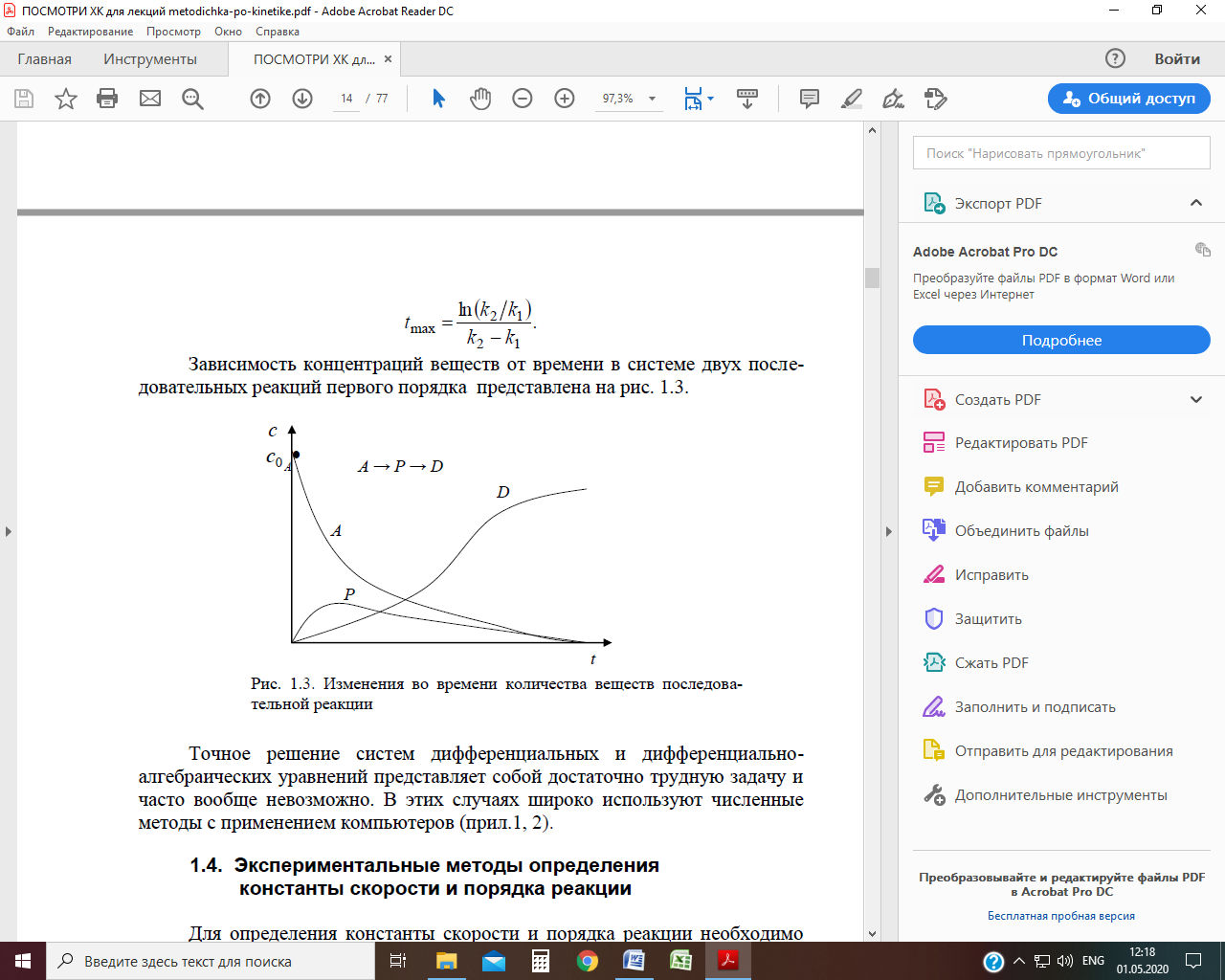
В общем случае число стадий может быть больше двух. Зависимость концентраций веществ от времени в системе двух последовательных реакций первого порядка представлена на рис.
Рис. Изменения во времени количества веществ последовательной реакции Сопряженные реакции Сопряженные реакции являются частным случаем таких параллельных реакций А + В → М (I) А + С → N (II), в которых только одно вещество является общим для одновременно идущих реакций. Характерной особенностью сопряженных реакций является то, что одна из реакций (например I) идет лишь тогда, когда одновременно с ней протекает другая реакция (например II), т.е. вторая реакция вызывает (индуцирует) протекание первой. Вещество А общее для обеих реакций носит название актор, В – индуктор, вещество С, взаимодействующее с А только при наличии 1-й реакции – акцептор.
Цепные реакции
Цепными процессами называются процессы, в которых превращение исходных веществ в продукты реакции осуществляются путём регулярного чередования нескольких реакций с участием свободных радикалов. В каждом элементарном акте такого процесса участвует свободный радикал. В результате взаимодействия радикала с молекулой одного из реагирующих веществ появляется новый радикал.
Свободным радикалом называется нестойкая частица, образующиеся из молекулы в результате разрыва одной или нескольких связи. В частности, радикалом может быть атом. Характерной особенностью радикалов является наличие неспаренных электронов, что обусловливает их высокую активность. Примером цепной реакции может служить взаимодействие брома с водором: Br2 + H2 → 2НBr Можно выделить три стадии цепного процесса: Обрыв цепи. Это стадия, приводящая к исчезновению свободных радикалов.
Реакция обрыва – следствие рекомбинации свободных радикалов с участием третьей частицы (М), которая поглощает избыточную энергию, выделяющуюся при столкновении.
По цепному механизму протекает ряд важных классов химических реакций: горение топлива, хлорирование и бромирование многих соединений, термический распад (крекинг), полимеризация и др.
Фотохимические реакции Фотохимическими называются реакции, протекающие под действием света, а так же невидимых лучей близких по длине волны к видимому свету. Выделяют первичные и вторичные фотохимические процессы. 1) Первичные фотохимические процессы Первичными называются реакции (процессы), непосредственно вызываемые действием света, к ним относятся: · возбуждение молекул или атомов, в результате чего образуются менее устойчивые частицы способные к дальнейшим превращениям: М + hν = М*, hν – световой квант, а М* - возбужденная молекула. · диссоциация молекул на атомы или радикалы (фотолиз): АВ + hν → А + В, · ионизация молекул и атомов с выделением электрона (фотоэффект): М + hν → М+ + е 2) Вторичные фотохимические процессы Вторичными называются реакции, не требующие освещения для своего протекания и называемые, поэтому темновыми. Активные частицы, образованные в первичных реакциях, могут вызывать дальнейшее протекание следующих вторичных процессов: - простые или разветвленные цепные реакции, - обычные стехиометрические реакции с образованием неактивных продуктов, - потеря энергии за счет излучения без химической реакции (например, передача энергии молекулам растворителя), - рекомбинация, возникших при фотодиссоциации атомов и молекул, причем рекомбинация облегчается молекулами растворителя.
Сенсибилизированными называются такие реакции, в которых активные частицы могут передавать свою энергию молекуле другого вещества, а та затем вступать в химическую реакцию. Вещества, которые сами не участвуют в фотохимической реакции, но поглощают кванты света и передают их реагентам, называются сенсибилизаторами. Важнейшим фотохимическим процессом является фотосинтез – образование углеводов в растениях, происходящее под действием солнечного света.
Суммарное уравнение реакции механизма не отражает. Действительный механизм фотосинтеза чрезвычайно сложен. Протекает процесс только в присутствии хлорофилла, который поглощает красные, синие и в меньшей степени зеленые лучи. Активированный таким образом хлорофилл содействует образованию из диоксида углерода и воды углеводов, необходимых для роста растений и кислорода. Хлорофилл переводит лучистую энергию в химическую, т.е. является фотосенсибилизатором. Основные понятия катализа
Каталитические реакции чрезвычайно распространены в природе. Большинство биологических процессов катализируется и регулируется особыми веществами – ферментами. Более 90% всей продукции на химических предприятиях основаны на катализе. Это полимеризация, крекинг нефти и многие другие процессы. Катализом называется явление изменения скорости термодинамически возможной химической реакции под влиянием веществ, которые участвуют в реакции, но остаются в неизменном количестве и составе после ее окончания. Такие вещества называются катализаторами. Реакции, идущие с участием катализаторов, называют каталитическими. Влияние катализаторов на скорость химической реакции в основном заключается в осуществлении процесса, энергия активации которого ниже, чем энергия активации некаталитического процесса. Катализаторами могут быть самые разнообразные вещества в любом из трех агрегатных состояний: кислоты, соли, основания, оксиды, металлы, различные органические и органоминеральные соединения, газообразные вещества. В ряде случаев каталитическое действие оказывают всевозможные примеси (например, пыль), поверхность стенок сосуда, а также продукты реакций. Катализатором может быть и продукт данной реакции. Это явление называют автокатализом, а реакцию автокаталитической. Катализ может быть положительный (увеличивает скорость реакции) и отрицательный (уменьшает скорость реакции - ингибирование). Вещество, в присутствии которого скорость уменьшается, называется ингибитором. Особенности каталитических реакций следующие: · количество катализатора и его химический состав не изменяются в ходе реакции; · катализатор не изменяет термодинамически возможное положение химического равновесия (следовательно, константу равновесия), он ускоряет его достижение, что возможно в случае протекания реакции по другому более энергетически выгодному пути (меньше энергия активации); · катализаторы ускоряют только определенный тип каталитических реакций, то есть действие катализаторов специфично; · способность катализатора ускорять лишь одну из термодинамически возможных реакций образования конкретного целевого продукта называется селективностью катализатора; · катализаторы чувствительны к присутствию примесей, которые могут как усиливать действие катализатора (промотировать), так и ослаблять его (ингибировать). В зависимости от агрегатного состояния веществ, участвующих в реакции, катализ делят на гомогенный и гетерогенный. -При гомогенном катализе все взаимодействующие вещества и катализатор находятся в одной фазе. Он наиболее распространен среди реакций в жидкой фазе. -При гетерогенном катализе каталитическая реакция протекает на поверхности раздела фаз: т – г; т – ж; ж – г. Катализаторами в таких случаях могут быть твердые вещества (металлы, оксиды и т.д), то есть реагенты и катализатор находятся в разных контактирующих фазах. В качестве примера можно назвать реакции окисления аммиака (газообразная фаза) в присутствии платины (твердая фаза) или разложение пероксида водорода (жидкая фаза) в присутствии угля или диоксида марганца (твердая фаза).
Процесс гетерогенного катализа можно представить как последовательность нескольких стадий: - диффузия (подвод) реагентов к поверхности катализатора; - адсорбция реагентов на поверхности катализатора А + В + К → АВК; - каталитическая реакция – химическое превращение исходных молекул в продукты АВК → СДК; - десорбция продуктов реакции с поверхности катализатора СДК →С + Д + К; - диффузия (отвод) продуктов реакции из реакционной зоны.
При гетерогенном катализе снижается энергия активации реагирующей системы за счет энергии адсорбции и повышается концентрация реагирующего вещества (или обоих веществ) на границе раздела. В результате скорость химической реакции возрастает. Поверхность катализатора неоднородна (впадины, выступы на поверхности). На ней имеются так называемые активные центры, на которых главным образом и протекают каталитические реакции. Промежуточное положение занимает ультрамикрогетерогенный катализ, то есть катализ коллоидными частицами. К нему относят мицеллярный и ферментативный катализ. Мицеллярный катализ – это ускорение химических реакций в результате увеличения концентрации реагентов в мицеллах поверхностно-активнывеществ (ПАВ) или в результате изменения степени диссоциации реагентов в присутствии мицелл ПАВ. Ферментативный катализ обусловлен специфическим действием белковых веществ - ферментов. Данный вид катализа проявляется во множестве процессов, протекающих в живых организмах. Каталитическая активность катализаторов определяется изменением скорости реакции в присутствии катализатора. Общим для каталитических процессов является то, что катализатор не влияет на положение термодинамического равновесия, т. е. на величину константы равновесия K = k1 / k2. Он одинаково ускоряет прямую и обратную реакцию. Катализатор уменьшает время достижения равновесия. Поэтому можно добиться значительной скорости экзотермических обратимых реакций при невысоких температурах (такие реакции протекают тем полнее, чем ниже температура, но без катализатора недостаточно быстро). Изменение скорости химической реакции под влиянием положительного катализатора объясняется уменьшением энергии активации, т.е. снижением потенциального барьера. При этом образуется активированный комплекс с более низким уровнем энергии и реакция существенно возрастает. Катализаторы со временем теряют свою активность. Это происходит, если в результате побочных химических процессов каталитически активный центр блокируется, и выводится из сферы реакции. Иногда активность катализатора резко уменьшается в присутствии незначительных количеств некоторых веществ. Это явление называют отравлением катализаторов, а вещества, резко снижающих активность катализатора, каталитическими ядами.
Исходя из химической природы катализатора и реагентов, различают автокатализ; кислотно-основной катализ; окислительно-восстановительный катализ; катализ комплексами, металлами и оксидами металлов и др. Автокатализ. В этом случае катализатором может быть один из продуктов реакции. Примеры автокаталитической реакции: 1) восстановление окиси железа водородом FeO + H2=Fe + H2O катализируется Fe. 2) омыление уксусноэтилового эфира в нейтральном растворе:
CH3COOC2H5 + H2O → CH3COOH + C2H5OH Катализатором является уксусная кислота, точнее ионы водорода H+.
По мере взаимодействия участвует все большее количество катализатора, поэтому скорость постоянно возрастает. Для автокаталитической реакции А → В скорость образования продукта запишется в виде:
так как скорость каталитической реакции пропорциональна количеству катализатора. Характерные особенности автокаталитической реакции: - реакция идет при переменно возрастающей концентрации катализатора; - автокаталитическая реакция возможна, если наряду с ней протекает некаталитическая реакция или если к начальному веществу добавить некоторое количество продукта реакции (затравка реакции).
Кислотно-основной катализ. При кислотно-основном катализе возникновение активного комплекса связано либо с переходом от катализатора протона к реагенту, либо с отдачей реагентом протона катализатору. Механизм кислотно-основного катализа заключается в предварительном взаимодействии реагентов с кислотой или основанием (перенос протона), в результате чего образуется более реакционно-способное соединение по сравнению с исходным. Окислительно-восстановительный катализ. При реакциях окислительно- восстановительного катализа образование активного комплекса связано с электронными переходами между катализатором и реагентом. Металлокомплексный катализ. При металлокомплексном катализе в качестве катализатора используют комплексные соединения. Комплексные соединения катализируют реакции окисления (пирагаллола, аскорбиновой кислоты и др.), гидролиза, гидрирования, полимеризации и др. Комплексы могут вызывать цепные реакции окисления, в которых они являются инициаторами цепей. Ферментативный катализ В процессе жизнедеятельности в любом живом организме совершаются сложнейшие и многообразные превращения химических веществ различной природы. Большинство из них протекают с участием биологических катализаторов белковой природы – ферментов. Ферменты ускоряют реакции в миллиарды и триллионы раз при комнатной температуре. При повышении температуры они теряют свою активность. Т.к. происходит денатурация белков. Ферментативный катализ имеет характерные особенности: · высокая активность. По активности биологические катализаторы в миллионы раз превосходят активность химических катализаторов. · высокая специфичность. Каждый из них действует лишь на строго определенную реакцию или группу реакций. Например, амилаза катализирует процесс расщепления крахмала, состоящего из одинаковых глюкозных звеньев. Но не катализирует гидролиз сахарозы, молекула которой составлена из глюкозного и фруктозного фрагментов. · высокая чувствительность активности ферментов к внешним условиям – рН среды и температуре. Ферменты активны лишь в узком интервале рН и Т, причем для ферментов характерно наличие в этом интервале максимума активности при некотором оптимальном значении рН и Т; по обе стороны от этого значения активность ферментов быстро снижается. · В процессе каталитической реакции фермент постепенно разрушается и утрачивает свою активность. Это явление получило название инактивация. В последние годы интенсивно развиваются исследования свойств иммобилизованных ферментов, т.е. ферментов, закрепленных на твердых носителях, что дает возможность легко отделять катализатор от продуктов реакции и использовать его многократно.
где k 2 / k 1 - величина обратная обычной константе равновесия и называется константой Михаэлиса КМ. Тогда
Максимальная скорость достигается тогда, когда концентрация субстрата безгранично растет: v max = k 3 · CE и тогда
При КМ – константа диссоциации в реакции образования комплекса фермент – субстрат, и КМ равна концентрации субстрата, при которой скорость реакции составляет половину максимальной. КМ служит мерой сродства между ферментом и субстратом. Чем меньше КМ, тем больше способность к образованию комплекса ES. Величина константы Михаэлиса для различных систем изменяется от 1 до 10-8. Помимо природы субстрата она зависит от величины рН, температуры и других факторов. Поэтому ее значение приводят для характеристики конкретных фермент-субстратных систем в определенных условиях. Катализ имеет огромное значение в технике и природе. Подбирая соответствующим образом катализаторы, можно осуществлять процессы в желаемом направлении и с нужной скоростью. Область применения каталитических реакций в химической промышленности в настоящее время совершенно необозрима. Такие важные процессы, как производство серной кислоты, синтез аммиака, окисление аммиака до азотной кислоты, переработка нефти, синтез каучука и полимерных материалов и многие другие являются каталитическими. ХИМИЧЕСКАЯ КИНЕТИКА Контрольные вопросы: 1. Основные понятия и постулаты химической кинетики. Скорость гомогенной реакции. Кинетическая кривая, кинетическое уравнение, молекулярность, порядок, константа скорости. Необратимые реакции нулевого, первого, второго и третьего порядков. Время полупревращения. Методы определения порядка реакции. 2. Влияние температуры на скорость химической реакции. Уравнение Аррениуса, энергия активации. 3. Теория столкновений. Частота столкновений, стерический фактор. Механизм мономолекулярной реакции в газовой фазе. Теория переходного состояния (теория активированного комплекса). 4. Сложные реакции первого порядка: обратимые, параллельные, последовательные, сопряженные. Лимитирующая стадия. Фотохимические реакции. Цепные реакции. 5. Определение катализа. Общие принципы катализа. Классификация каталитических реакций. гомогенный катализ. Кислотно-основной катализ. Гетерогенный катализ. Особенности гетерогенных каталитических процессов. Роль адсорбции в каталитическом акте. Активные центры, образование кластеров на поверхности катализаторов. промотирование и отравление катализаторов. Каталитическая активность и селективность катализаторов. Ферментативный катализ. Формальная кинетика Химическая кинетика представляет собой учение о скоростях химических реакций, о факторах, определяющих эти скорости (природы реагирующих веществ, концентрации, температуры, присутствия катализаторов и др.), а также о механизме химических реакций.
Кинетическая классификация реакций. В зависимости от того, что взято за основу классификации, химические реакции можно разделить по следующим признакам: 1. По агрегатному состоянию среды: - в газовой фазе; - в растворах; - в твердых средах.
2. По фазовому состоянию исходных и образующихся веществ: - гомогенные реакции, протекающие в пределах одной фазы: в смеси газов, в жидком растворе или в твердой фазе; - гетерогенные реакции, протекающие на границе раздела фаз: двух твердых, твердой и жидкой, твердой и газообразной, двух жидких, жидкой и газообразной. - гомогенно-гетерогенные реакции, являющиеся сложными химическими реакциями, в которых одни стадии являются гомогенными, а другие - гетерогенными; - гомофазные реакции, в которых исходные вещества, промежуточные вещества и продукты реакции находятся в одной фазе; - гетерофазные реакции, в которых исходные вещества, промежуточные вещества и продукты реакции образуют более чем одну фазу. 3. По природе частиц, участвующих в элементарном акте: - молекулярные, в которых участвуют молекулы; - цепные, с участием атомов или свободных радикалов; - ионные, с участием ионов; - фотохимические; - радиохимические; - электрохимические. 4. По степени сложности: - простые, протекающие в одну стадию; - сложные, протекающие в несколько стадий и по разным направлениям. 5. По кинетической обратимости: - необратимые или односторонние. Общая скорость этих реакций определяется только скоростью прямой реакции; - обратимые или двусторонние. В них скорость прямой и обратной реакции соизмеримы. Скоростью химической реакции называется изменение концентрации одного из реагирующих веществ за единицу времени.
Предположим, что имеется реакция, описываемая следующимуравнением: a A + b B = d D + eE, где А и В – исходные вещества; D и E – продукты реакции; a, b, d и e –стехиометрические коэффициенты. О скорости этой реакции можно судить по скорости уменьшения концентрации исходного вещества А или В; а также по скорости увеличения (накопления) концентрации продуктов D или E. Графически изменение концентрации веществ А и D во времени отображаются зависимостями, представленными на рис. 1 (кривые CA и CD соответственно).
Различают среднюю и истинную скорости: Средней скоростьюw ср химической реакции называют изменение концентрации ΔС реагирующего вещества, отнесенное к конечному интервалу времени Δt, в течение которого это изменение произошло. Для рассматриваемой реакции выражение для средней скорости реакции за интервал времени Δτ по веществу А:
или по компоненту D:
Скорость реакции принято считать положительной величиной. Отношение же ΔC/Δτ
|
|||||||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 251; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.14.6.59 (0.213 с.) |
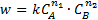

 называют экспоненциальным, он характеризует долю активных столкновений молекул от общего числа.
называют экспоненциальным, он характеризует долю активных столкновений молекул от общего числа.