
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кинетические уравнения и порядок реакции
В зависимости от вида кинетического уравнения, связывающего скорость реакции с концентрацией реагирующих веществ, различают реакции нулевого, первого, второго и третьего порядка. Рассмотрим кинетические уравнения односторонних реакций, порядок которых дается целым числом. Для характеристики скорости реакции наряду с константой скорости часто используют время полупревращения (τ 1/2) или период полупревращения.
Период полупревращения – это промежуток времени, в течение которого прореагирует половина начального количества вещества (С = С0 /2) (Со – исходная (начальная) концентрация; C – текущая концентрации).
Реакции нулевого порядка. Такой порядок реакции означает, что еѐ скорость не зависит от концентрации реагирующих веществ. Это возможно при поддержании концентрации исходных веществ постоянными. Например, реакция протекает в насыщенном растворе, находящемся в контакте с избытком нерастворенного реагирующего вещества. Этот порядок встречается главным образом среди гетерогенных реакций. Если реакция протекает по нулевому порядку, то для нее
Для них константа скорости определяется выражением:
и имеет размерность [ С / время ]. За время полупревращения τ = τ 1/2 исходная концентрация реагирующего вещества уменьшается наполовину С = С0 /2.
Следовательно, для реакции нулевого порядка время полупревращения пропорционально начальной концентрации исходного вещества.
Реакции первого порядка – это реакции изомеризации, термического разложения веществ, радиоактивного распада атомных ядер, многие бимолекулярные реакции, если концентрация одного из реагирующих веществ постоянна. Схематично такие реакции можно записать: A → продукты
Скорость таких реакций w прямо пропорциональна концентрации реагирующего вещества C в данный момент времени τ:
Решение уравнения дает выражение для константы скорости реакции:
где С0 - начальная концентрация реагирующего вещества; c - концентрация ко времени τ; Со – x – убыль вещества ко времени τ. Размерность константы скорости k = [ τ –1 ]. Время реакции может измеряться как в часах, так и в долях секунды, в веках и др. Время полупревращения для реакций первого порядка рассчитывается по уравнению:
Для реакций первого порядка период полупревращения не зависит от начальной концентрации исходного вещества, константа скорости обратно пропорциональна периоду полупревращения.
Реакции второго порядка встречаются наиболее часто. К ним относятся реакции термического образования и разложения, процессы димеризации, омыление сложных эфиров, этерификация и др. В общем виде реакцию второго порядка можно представить схемой: А + В → продукты. При равных начальных концентрациях реагирующих веществ (СоА = СоВ = Со) или в случае, когда оба реагирующих вещества одинаковы, скорость реакции выражается следующим образом:
Константа скорости реакции второго порядка равна:
При СоА ≠ СоВ уравнение скорости реакции второго порядка
где СоА и СоВ - начальные концентрации веществ А и В; х - уменьшение концентрации веществ А или В к моменту времени t, то есть С x. Размерность k второго порядка [ С -1 τ -1] Время полупревращения
Реакции третьего порядка очень редки. В простейшем случае для реакции A + B + D → продукты при равенстве начальных концентраций СоА = СоВ = Со D = Со
Размерность константы скорости реакции третьего порядка - [ С 2 τ –1]. Период полупревращения реакций третьего порядка, определяется выражением:
Дробный порядок указывает на одновременное протекание реакции в несколько этапов, которые мало отличаются друг от друга по скоростям, или на протекание обратимых реакций.
|
|||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 40; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.139.79.59 (0.007 с.) |
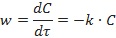
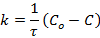
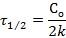

 или
или 

 или
или 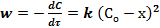
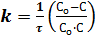 или
или 


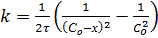 ,
,



