
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химическая связь и строение молекул
Химическая связь – это связь между химическими частицами (атомами, ионами, молекулами), объединяющая их в более сложные образования (например, молекулы). Образование устойчивой химической связи всегда сопровождается выделением энергии (энергия связанной системы меньше, чем суммарная энергия её несвязанных компонентов). Таким образом, выигрыш энергии является движущей силой образования химической связи. Химическая связь обусловлена, как правило, взаимодействием внешних электронов реагирующих частиц. Различают следующие типы химической связи: ковалентная, ионная, металлическая и водородная. К химической связи также относят силы межмолекулярного взаимодействия (силы Ван-дер-Ва-альса). Ковалентная связь образуется в результате обобществления электронов с противоположными спинами внешнего (валентного) энергетического уровня атомов при их взаимодействии (связь за счет общей пары электронов). Этот метод описания ковалентной связи носит название метода валентных связей (МВС). Если электронная пара находится посредине между взаимодействующими атомами, то такая связь называется неполярной ковалентной связью. Например, молекула водорода – Н:Н. Если же электронная пара смещена к одному из атомов, то образуется полярная ковалентная связь. Например, молекула H+:Cl−, где электронная пара смещена к атому хлора и он приобретает избыточный отрицательный заряд.
 где где  − дипольный момент, Кл∙м; q – заряд на одном из атомов, Кл; l – длина диполя, расстояние между центрами положительного и отрицательного зарядов, м. − дипольный момент, Кл∙м; q – заряд на одном из атомов, Кл; l – длина диполя, расстояние между центрами положительного и отрицательного зарядов, м.
Дипольный момент является векторной величиной. Векторная сумма дипольных моментов всех поляр- Чем больше дипольный момент, тем более полярной является молекула. Для оценки полярности связи используют понятие электроотрицательности (ЭО). Она характеризует способность атома «оттягивать» на себя общую электронную пару при образовании химической связи. Наибольшую электроотрицательность имеет атом фтора.
Ковалентная связь может образовываться по двум механизмам – обменному и донорно-акцепторному. По обменному механизму общая электронная пара образуется за счет двух неспаренных электронов с противоположными спинам разных атомов:
Н • + • Н ⟶Н
По донорно-акцепторному механизму связь образуется за счет неподеленной электронной пары одного элемента (B - донора) и свободной орбитали другого атома (акцептора):
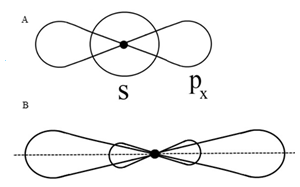
Ковалентная связь имеет следующие характеристики: энергия, длина, кратность, насыщаемость и направленность, полярность. Энергия связи – мера прочности связи. Это та энергия, кото- Длина связи – расстояние между ядрами в нм (нм–нанометр), Кратность связи определяется числом электронных пар, связывающих два атома. Под насыщаемостью понимают способность атомов образовывать ограниченное число ковалентных связей. Атомы образуют молекулу в таком стехиометрическом соотношении, что все неспарен- Гибридизация – это процесс смешения АО, приводящий к их полной энергетической и геометрической равноценности. Число образующихся гибридных атомных орбиталей (ГАО) равно суммарному числу исходных АО, а их название показывает, какие орбитали и в каком количестве подверглись гибридизации. На рис. 2 приведен пример sp-гибридизации. В образовании гибридных орбиталей участвуют по одному s и р электрону s и p х АО соответственно (рис. 2, а). Угол между двумя sр -гибридными атомными орбиталями равен 180° (рис. 2, б).
Метод молекулярных орбиталей. Параллельно с методом валентных связей (МВС) для описания ковалентной химической связи был разработан метод молекулярных орбиталей (ММО), который базируется на следующих положениях: 1. Каждый электрон в молекуле движется в результирующем поле всех ядер и остальных электронов. Молекула рассматривается как единая частица − ядерный каркас и общие для частицы электроны, расположенные на так называемых молекулярных орбиталях. (В методе валентных связей электрон находится в эффективном поле своего ядра, а молекула описывается как система взаимодействующих атомов.) 2. Состояние электрона в молекуле описывается волновыми функциями, которым соответствуют молекулярные орбитали (МО), подобно атомным. Волновая функция молекулярных орбиталей может быть получена сложением или вычитанием волновых функций атомных орбиталей (линейная комбинация АО). Из двух АО образуются две МО: одна из них ниже по энергии исходных АО (связывающая МО), другая выше (разрыхляющая МО). 3. Заполнение электронами молекулярных орбиталей осуществляется на основе тех же принципов, что и при заполнении атомных орбиталей (принцип минимума энергии, принцип Паули, правило Хунда). Совокупность молекулярных орбиталей называется электронной конфигурацией молекулы. Ионная связь возникает между элементами, резко различающимися по электроотрицательности (разность ЭО больше 2,3). Типичными соединениями с ионной связью являются галогениды щелочных металлов (KCl, NaJ и т.д.), основные оксиды, гидроксиды, все виды солей, бинарные соединения из металлов и неметаллов. При образовании ионной связи происходит полное смещение общей электронной пары в сторону наиболее электроотрицательного элемента. При этом образуются катионы (+) и анионы (–), которые электростатически притягиваются:
Ионная связь характеризуется ненаправленностью в пространстве: каждый ион взаимодействует с противоионом в любом направлении. Вторая характеристика – ненасыщаемость (притяжение иона к противоиону не компенсирует силового поля иона по другому направлению). Вещества с ионным типом связи имеют высокие температуры плавления и кипения, а в растворах и в расплавах диссоциируют на ионы и проводят электрический ток. Металлическая связь. Металлы образуют простые вещества за счет связи, называемой металлической. Между ковалентной и металлической связью имеется большое сходство: оба типа химической связи основаны на обобществлении валентных электронов. Но в металлах обобществленные электроны принадлежат всему кристаллу, т.е. полностью делокализованы, а в случае ковалентной связи электронная пара или пары локализованы в пространстве между ядрами взаимодействующих атомов. Этим объясняется отсутствие пространственной направленности металлической связи, т.е. металлическая связь не проявляет свойств насыщаемости, столь характерных для ковалентной связи. Водородная связь возникает между ионом H+ и каким-либо элементом с большим значением электроотрицательности (F, O, Cl, N). Водородная связь подразделяется на межмолекулярную и внутримолекулярную. Водородная связь между молекулами воды (а) или молекулами H − F (б) называется межмолекулярной:
Если водородная связь образуется атомами одной молекулы, то она называется внутримолекулярной. В заключение рассмотрим изменение потенциальной энергии при образовании молекулы водорода в зависимости от расстояния между атомами водорода (рис. 3).
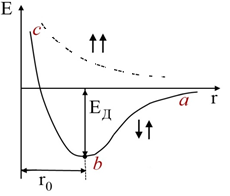 На рис. 3 изменение потенциальной энергии при образовании молекулы водорода представлено сплошной кривой. Она состоит из двух ветвей: силы притяжения атомов описывает кривая аb, а силы отталкивания − bc. В точке минимума b сила притяжения уравновешивается силой отталкивания. Равновесное расстояние r 0, т.е. расстояние от минимальной точки b до оси ординат, представляет собой длину химической связи, а отрезок от точки минимума кривой до оси абсцисс характеризует энергию связи. При образовании молекулы водорода спины электронов антипараллельны, а отсутствие химического взаимодействия (пунктирная кривая отталкивания) характеризуется параллельными спинами электронов. На рис. 3 изменение потенциальной энергии при образовании молекулы водорода представлено сплошной кривой. Она состоит из двух ветвей: силы притяжения атомов описывает кривая аb, а силы отталкивания − bc. В точке минимума b сила притяжения уравновешивается силой отталкивания. Равновесное расстояние r 0, т.е. расстояние от минимальной точки b до оси ординат, представляет собой длину химической связи, а отрезок от точки минимума кривой до оси абсцисс характеризует энергию связи. При образовании молекулы водорода спины электронов антипараллельны, а отсутствие химического взаимодействия (пунктирная кривая отталкивания) характеризуется параллельными спинами электронов.
Примеры решения типовых задач
Пример 1. Распределить электроны в атоме азота N по энергетическим уровням согласно правилу Хунда (Гунда). Решение приведено на рис. 4.
Рис. 4
Правило Хунда гласит: заселение орбиталей, относящихся к одному и тому же энергетическому подуровню, начинается одиночными электронами с параллельными (одинаковыми по знаку) спинами, и лишь после того, как одиночные электроны займут все орбитали, может происходить окончательное заселение орбиталей парами электронов с противоположными спинами. В результате суммарный спин (и сумма спиновых квантовых чисел) всех электронов в атоме будет максимальным. Пример 2. Показать электронную конфигурацию атома Решение. Энергетическая диаграмма распределения электронов в атоме Са представлена на рис. 5.
Рис. 5
Согласно правилу Клечковского сначала заполняется орбиталь 4 s, а затем 3 d. Распределение соответствует электронной конфигурации – 1 s 22 s 22 p 63 s 23 p 6 4 s 2. Пример 3. Определить геометрическое строение (конфигурацию) молекулы метана СН4.
Решение. Запишем валентные электронные конфигурации атомов водорода и углерода: H − 1 s 1; C − …. 2 s 22 p 2. Атом углерода образует четыре связи с атомами водорода. Следовательно, он должен иметь четыре неспаренных электрона. Для объяснения этого факта следует предположить, что в результате поглощения энергии этим атомом углерода один из 2 s -электронов переходит на свободную 2 р -орбиталь и атом углерода переходит в так называемое «возбужденное» состояние: C* −…. 2 s 12 p 3, s - и р -электроны у атома углерода энергетически не равноценны, а опытные данные говорят, что все четыре связи в молекуле метана энергетически равноценны, т.е. можно предположить гибридизацию АО. Гибридизация, в которой участвуют атомные орбитали одного
Рис. 6
В молекуле метана угол между осями четырех гибридных орбиталей составляет 109°28'. Молекула метана имеет форму тетраэдра (рис. 7). Пример 4. На основе метода валентных связей (МВС) предположить пространственное строение молекулы СО2 и определить, является ли молекула диполем. Значения электроотрицательностей c элементов представлены в табл. 2. Т а б л и ц а 2
|
||||||||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 110; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.175.182 (0.026 с.) |

 Н
Н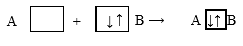
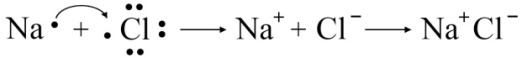


 .
.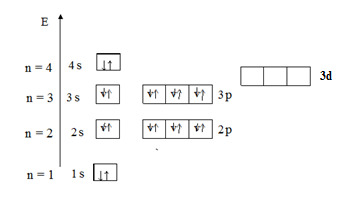

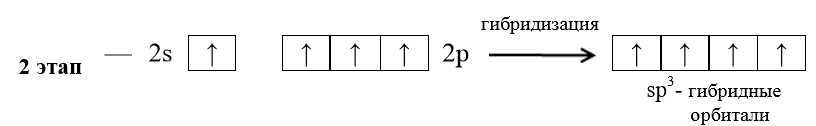
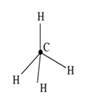 Рис. 7. sр 3-гибридиза-
ция в молекуле СН4
Рис. 7. sр 3-гибридиза-
ция в молекуле СН4



