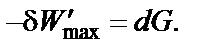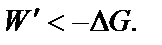Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
А.А. Барунин, Д.С. МаслобоевСтр 1 из 7Следующая ⇒ А.А. Барунин, Д.С. Маслобоев
Химия ДЛЯ СТУДЕНТОВ ЗАОЧНОЙ ФОРМЫ ОБУЧЕНИЯ
Министерство образования и науки Российской Федерации Балтийский государственный технический университет «Военмех» Кафедра технологии конструкционных материалов и производства ракетно-космической техники
А.А. Барунин, Д.С. Маслобоев
химия ДЛЯ СТУДЕНТОВ ЗАОЧНОЙ ФОРМЫ ОБУЧЕНИЯ
Учебное пособие
Санкт-Петербург 2018 УДК 54(075.8)
УДК 54(075.8)
Р е ц е н з е н т канд. хим. наук, нач. отдела физико-химических методов исследования АО «ЦНИИМ» В.Е. Разуваев
Утверждено редакционно-издательским советом университета
ã БГТУ, 2018 ã Авторы, 2018
Введение. Рекомендации по выполнению контрольных заданий
Самостоятельная работа студента над курсом химии предусматривает изучение программного теоретического материала по лекциям, учебникам и учебным пособиям [1−4], выполнение трех индивидуальных контрольных заданий, подготовку к зачету. К выполнению контрольных заданий следует приступать только после изучения и усвоения материала, приведенного в данном пособии. Решение типовых задач приведено в конце каждого раздела. Для выполнения контрольного задания по курсу «Химия» студент-заочник получает индивидуальное задание в соответствии со своим порядковым номером в списке группы и соответствующим номером билета в контрольном задании: 1-й порядковый номер в группе – выполняется 1-й порядковый номер билета в индивидуальном контрольном задании № 1, 2 и 3.
Строение атома
Атом состоит из положительно заряженного ядра, в котором сосредоточена его основная масса, и движущихся вокруг ядра отрицательно заряженных электронов. Ядро образовано нейтронами (не имеют заряда) и протонами (относительный заряд +1), т.е. заряд ядра равен числу протонов. Заряд ядра и электронная структура атома определяет природу химического элемента. Электрон как микрочастица обладает одновременно свойствами частицы и волны (корпускулярно-волновой дуализм). Поэтому можно говорить лишь о «вероятности нахождения» электрона в пределах определенной области пространства. Область с максимальной вероятностью нахождения электрона (более 90%) называют атомной орбиталью. Энергии атомных орбиталей (как практически все в микромире) квантованы, т.е. могут принимать только конкретные дискретные значения. Состояние электрона в атоме (энергетическое, пространственное) описывается набором квантовых чисел(n, l, m l, m s). Главное квантовое число n характеризует энергию электрона в зависимости от расстояния от ядра и может принимать значения от 1 до ∞ через 1. С увеличением n энергия электрона возрастает. Состояние электрона, отвечающее определенному значению n, называют энергетическим уровнем или квантовым слоем. Орбитальное или побочное квантовое число l определяет форму атомной орбитали (АО). Энергия орбиталей, которые находятся на одном энергетическом уровне, но имеют различную форму, неодинакова, поэтому энергетические уровни состоят из энергетических подуровней. АО одного подуровня различаются направлением (ориентацией) в пространстве. Кроме формы орбиталей, значение l характеризует энергию подуровня. Число l принимает значения от 0 до (n – 1) через 1. Общее число подуровней в квантовом слое (энергетическом уровне) равно значению n. Если n = 2, то число подуровней также равно 2 (2 s и 2 р). Соответствующие значения l обозначают строчными буквами латинского алфавита: l = 0, s -подуровень;
l = 1, р -подуровень;
l = 2, d -подуровень;
l = 3, f -подуровень.
s -подуровень имеет форму шара, р -подуровень – форму гантели, d и Магнитное квантовое число m l определяет возможные ориента-ции орбиталей в пространстве (или общее количество АО одного вида в квантовом слое). Квантовое число m l принимает целые численные значения от – l до + l, включая ноль. Для l = 0 m l имеет только одно значение − 0, т.е. s -орбиталь (подуровень) ориентирована в пространстве относительно ядра единственным способом. Если l = 1, то m l принимает три значения (–1, 0, +1), что указывает на три различные ориентации р -орбиталей (рx, py, рz вдоль осей x, y, z). Количество орбиталей данной формы можно определить по формуле (2 l + 1), от – l через ноль до + l. Спиновое квантовое число ms определяет собственный магнитный момент, возникающий при вращении электрона вокруг своей оси. Спиновое квантовое число может принимать лишь два возможных значения: +1/2 и −1/2. Изложенный выше материал представим в табл. 1.
Т а б л и ц а 1 Значения квантовых чисел
Графически АО (атомные орбитали) изображают в виде квантовой ячейки − □. Примеры решения типовых задач
Пример 1. Распределить электроны в атоме азота N по энергетическим уровням согласно правилу Хунда (Гунда). Решение приведено на рис. 4.
Рис. 4
Правило Хунда гласит: заселение орбиталей, относящихся к одному и тому же энергетическому подуровню, начинается одиночными электронами с параллельными (одинаковыми по знаку) спинами, и лишь после того, как одиночные электроны займут все орбитали, может происходить окончательное заселение орбиталей парами электронов с противоположными спинами. В результате суммарный спин (и сумма спиновых квантовых чисел) всех электронов в атоме будет максимальным. Пример 2. Показать электронную конфигурацию атома Решение. Энергетическая диаграмма распределения электронов в атоме Са представлена на рис. 5.
Рис. 5
Согласно правилу Клечковского сначала заполняется орбиталь 4 s, а затем 3 d. Распределение соответствует электронной конфигурации – 1 s 22 s 22 p 63 s 23 p 6 4 s 2. Пример 3. Определить геометрическое строение (конфигурацию) молекулы метана СН4. Решение. Запишем валентные электронные конфигурации атомов водорода и углерода: H − 1 s 1; C − …. 2 s 22 p 2. Атом углерода образует четыре связи с атомами водорода. Следовательно, он должен иметь четыре неспаренных электрона. Для объяснения этого факта следует предположить, что в результате поглощения энергии этим атомом углерода один из 2 s -электронов переходит на свободную 2 р -орбиталь и атом углерода переходит в так называемое «возбужденное» состояние: C* −…. 2 s 12 p 3, s - и р -электроны у атома углерода энергетически не равноценны, а опытные данные говорят, что все четыре связи в молекуле метана энергетически равноценны, т.е. можно предположить гибридизацию АО. Гибридизация, в которой участвуют атомные орбитали одного
Рис. 6
В молекуле метана угол между осями четырех гибридных орбиталей составляет 109°28'. Молекула метана имеет форму тетраэдра (рис. 7). Пример 4. На основе метода валентных связей (МВС) предположить пространственное строение молекулы СО2 и определить, является ли молекула диполем. Значения электроотрицательностей c элементов представлены в табл. 2. Т а б л и ц а 2 Примеры решения типовых задач
Пример 1. Определить валентность N – в NH3, Н – в Н2О, Решение. Строение валентного (внешнего) электронного уровня азота − …2 s 2 2 p 3, фтора − …2 s 2 2 p 5, водорода – 1 s 1. У водорода на электронном уровне электрон, значит, валентность его в Н2О равна 1; у азота на внешнем слое три неспаренных электрона, следовательно, валентность азота в NH3 равна 3; у фтора на внешнем слое один неспаренный электрон, значит, валентность фтора в HF равна 1. Пример 2. Определить степени окисления атомов в следующих соединениях: a) H2SO4, б) Al2O3, в) K3PO4. Решение. В H2SO4 определим степень окисления серы. Так как водород имеет степень окисления (+1),кислород (−2), а сумма степеней окисления равна нулю, то, решая простейшее уравнение, где х – степень окисления серы в H2SO4, получаем 2.(+1)+ х + 4. (−2) = 0, x = +6.
В Al2O3 определим степень окисления Al, она равна (+3). В K3PO4 определим степень окисления фосфора 3. (+1) + х + Пример 3. Составить уравнение реакции с помощью метода электронного баланса: P0+O20 → P2+5O5−2. восст. окислит. Решение. а) P0 – 5е → P+5– реакция окисления O2+ 4е → 2O−2 – реакция восстановления б) P0 – 5е → P+5 х4 O2+ 4 е → 2O-2 х5 4P + 5O2 = 2P2O5 – уравнение составлено.
Пример 4. Составить уравнение электронного баланса:
KMn+7O4 + HCl−1 → KCl+Mn+2Cl2+Cl20+H2O окислит. восст. Решение. Mn+7+5е → Mn+2– реакция восстановления, 2Cl−1 − 2е → Cl20 – реакция окисления. Уравняем число отданных и принятых электронов:
Mn+7+5е → Mn+2 х2 2Cl−1 − 2е → Cl20 х5 2Mn+7+10Cl− → 2Mn+2+5Cl2 2KMnO4 + 10HCl → 2KCl+2MnCl2+3Cl2+5H2O – уравнение составлено.
Пример 5. Сколько граммов КОН необходимо взять для приготовления его 12% раствора? Решение. 12 % раствор КОН содержит, например, 12 г КОН в 100 г раствора, и для его приготовления следует взять 12 г КОН и 88 г растворителя (например, воды). Пример 6. Определить процентную концентрацию раствора хлорида калия – KCl, содержащего53 г KCl в 0,5 л раствора. Плотность раствора ρ = 1,063 г/см3. Решение. 1. Определяем массу 0,5 л раствора: m р = V р ρ р = 500 мл .1,063 г/мл = 531,5 г раствора (1 мл = 1 см3).
2. Определяем процентную концентрацию раствора KCl по формуле (1): w = 53 .100/53,5 = 9,98 ≈ 10%.
Пример 7. Какова масса гидроксида натрия NaOH, содержащегося в 200 см3 раствора, если молярная концентрация раствора равна Решение. 1. Молярная масса NaOH составляет М = 23 + 16 + 1 = = 40 г/моль 2. n = CV. В 1000 см3 0,2 М раствора содержится 0,2 моль NaOH, n = (200 0,2) /1000 = 0,04 моль NaOH в 200 см3 раствора. 3. Масса NaOH, содержащаяся в 200 см3 раствора, составит:
m = nM = 0,04 моль . 40 г/моль = 1,6 г.
6. Основные понятия. Термохимия. Закон Гесса.
Основные задачи химической термодинамики: · определение тепловых (энергетических) эффектов химических реакций и фазовых переходов; · установление принципиальной возможности и направления самопроизвольного (без затрат энергии извне) протекания процессов в заданных условиях; · определение условий химического равновесия. Теоретическая база химической термодинамики – три начала (закона) термодинамики и их следствия [1−2]. Основные понятия химической термодинамики. Система – совокупность веществ (компонентов) в указанном фазовом состоянии, находящихся во взаимодействии и отделенных от окружающей среды условной или реальной граничной поверхностью. Гомогенной называется физически однородная система, внутри которой нет поверхностей раздела между частями системы с различными свойствами. Гомогенными системами являются, например, физически однородные жидкие или твердые растворы, чистый сухой воздух. Гетерогенные системы физически неоднородны, имеют поверхности раздела между частями с различными свойствами и состоят из двух или более фаз. Фаза – совокупность всех гомогенных частей системы, одинаковых по химическому составу, структуре, физическим и химическим свойствам и отделенных от других частей системы поверхностью раздела. В химической термодинамике рассматриваются только макроскопические системы, состоящие из очень большого числа частиц, поскольку только к этим системам применимы такие понятия, как температура, давление, теплота и некоторые другие. Взаимодействие системы с окружающей средой может происходить путем обмена энергией и веществом. Система, которая при взаимодействии с окружающей средой обменивается с ней веществом и энергией, называется открытой (незамкнутой). Если имеет место только обмен энергией, то система называется закрытой (замкнутой). В том случае, когда не осуществляется ни один из перечисленных видов взаимодействий, она называется изолированной. Состояние системы характеризуется совокупностью всех ее физических и химических свойств, таких как масса, объем, давление, температура, химический состав и др. Параметрами состояния называются те свойства системы, которых оказывается достаточно для однозначной характеристики ее состояния, например: P, V, T. Иногда возможные состояния системы удается описать с помощью уравнений состояния, в которых параметры состояния выступают в роли независимых переменных. Термодинамические свойства системы, изменение которых при переходе из одного состояния системы в другое, зависят от пути (способа) перехода, называются функциями процесса. Термодинамические свойства системы, изменение которых при переходе из одного состояния системы в другое зависит только от начального и конечного состояния и не зависит от пути (способа) перехода, называются термодинамическими функциями состояния (U, H, S, G). Внутренняя энергия (U) представляет собой функцию состояния, которая характеризует общий запас энергии системы и включает в себя все виды энергий движения и взаимодействия всех частиц, составляющих систему, но в нее не входят кинетическая энергия системы в целом и потенциальная энергия, определяемая ее положением в поле внешних сил. Работа и теплота – две возможные формы передачи энергии от одной системы к другой. Работа (W) – макроскопическая форма передачи энергии − характеризует обмен энергией в форме кинетической энергии направленного (упорядоченного) движения частиц и является мерой энергии, передаваемой от одного тела к другому за счет перемещения масс под действием каких-либо сил. В химической термодинамике обычно рассматривают полезную работу, в том числе работу расширения или сжатия газа:
W = р ∙Δ V, (dW = р ∙ dV),
где р – давление, Па; Δ V – изменение объема газа, м3. Теплота (Q) является формой передачи энергии от одной системы к другой за счет столкновений молекул соприкасающихся тел, т.е. путем теплообмена. Теплота − микроскопическая, неупорядоченная, форма передачи энергии хаотически двигающимися частицами. Направление передачи теплоты определяется температурой. Теплота является функцией процесса. Понятия теплоты и работы применимы только к процессам, но не к состоянию системы. Тепловой эффект химической реакции – количество тепла, которое выделяется или поглощается при необратимом проведении реакции в условиях, когда температуры исходных веществ и продуктов реакции одинаковы, давление или объем постоянны (p = const или Термодинамические процессы. Всякое изменение параметров состояния называется процессом. Все процессы условно подразделяют на самопроизвольные (спонтанные) и несамопроизвольные. Самопроизвольно протекающий процесс в конечном итоге приводит систему в состояние равновесия. Если процесс осуществляется при неизменной температуре (T = const), его называют изотермическим. Процесс, протекающий при постоянном давлении (p = const), называется изобарным, а если V = const – изохорным. Когда одновременно поддерживаются неизменными либо давление и температура (p = const и T = const), либо объем и температура (V = const и T = const), такой процесс называют соответственно изобарно-изотермическим или изохорно-изотермическим, если неизменной остается энтропия – изоэнтропийным, и т.д. Процесс, протекающий без теплообмена с окружающей средой, называется адиабатическим. Равновесным (или квазистатическим) называется процесс, в котором система непрерывно проходит последовательный ряд равновесных состояний. Если процессы в системе и окружающей среде протекают равновесно и имеется возможность возвращения системы из промежуточного или конечного состояния в исходное таким образом, чтобы в окружающей среде не осталось никаких изменений, то равновесный процесс в системе называется обратимым. Равновес-ные и обратимые процессы могут протекать только бесконечно медленно. Принципиальной их особенностью является то, что работа, совершаемая системой в ходе обратимого процесса (при переходе из начального состояния в конечное), максимальна, а работа, затрачиваемая на обратный перевод системы в исходное состояние, минимальна. Первое начало термодинамики. Энергия не творится из ничего и не исчезает бесследно, а только превращается из одной формы в другую в эквивалентных количествах. Для бесконечно малого процесса его можно представить в виде
где Q – теплота процесса; U – внутренняя энергия системы; W – работа, совершаемая системой или над системой в термодинамическом процессе. Теплота и работа являются функциями процесса, их изменение зависит от пути его протекания. Поэтому бесконечно малые величины теплоты и работы не обладают свойствами дифференциала, и для их обозначения используют греческую букву δ. Внутренняя энергия, напротив, является функцией состояния, поэтому для обозначения её бесконечно малого изменения используется знак дифференциала d. В любом процессе изменение внутренней энергии (Δ U) закрытой системы равно разности между количеством подведенной теплоты (Q) и количеством совершенной работы (W):
Δ U = Q – W.
Согласно первому началу термодинамики теплота, подведенная к закрытой системе, расходуется на увеличение ее внутренней энергии и совершение работы против внешнего давления. Положительной считают теплоту, подведенную к системе, а отрицательной – отведенную от нее. Основная задача термодинамики заключается в прямом или косвенном определении (путем измерений или вычислений) тепловых эффектов химических реакций и фазовых превращений. Закон Гесса. Тепловой эффект процесса не зависит от пути его протекания (числа промежуточных стадий), а зависит лишь от начального и конечного состояний системы при условии, что давление и температура или объем системы и температура в ходе всего процесса остаются постоянными, а единственной формой работы является работа против внешнего давления. Закон Гесса позволяет рассчитывать неизвестные тепловые эффекты химических реакций исходя из известных величин тепловых эффектов небольшого числа реакций. При таких расчетах используются справочные данные по энтальпиям (теплотам) образования и сгорания веществ. Энтальпия Δ Нf (кДж) − количество энергии, которая доступна для преобразования в теплоту. В термохимических расчетах удобно использовать термохимические уравнения, в которых у химической формулы каждого вещества кратко указывается его состояние (агрегатное, фазовое, в растворе) и в конце уравнений записывается соответствующее изменение Δ r Н (кДж). Теплотой образования сложного вещества (химического соединения) называется тепловой эффект образования одного моля этого соединения из простых веществ, взятых в наиболее устойчивых при данных условиях модификациях. В стандартных условиях теплоту (стандартную энтальпию) образования принято обозначать следующей комбинацией символов: Δ H of,298, где подстрочный символ f – образование (сокращение от англ. formation – образование), а другие значки указывают: энтальпии образования веществ и энтальпии реакций отнесены к стандартным условиям (р = 101,325 кПа) и взяты для температуры T = 298 K. Энтальпии образования веществ при стандартных условиях являются их основными энергетическими характеристиками. Для простого вещества (состоящего из одного химического элемента) Δ H of,298 = 0. Теплота сгорания вещества – тепловой эффект сгорания одного моля данного вещества в избытке окислителя (кислорода или фтора) до конечных продуктов окисления. Энтальпия сгорания условно обозначается как Δ H oc,298, где подстрочный символ «c» – сгорание (от англ. combustion – горение). Три важных следствия из закона Гесса: 1. Тепловой эффект химической реакции (количество теплоты, выделившейся или поглощённой при протекании реакции до конца) равен разности сумм теплот (энтальпий) образования продуктов реакции и исходных веществ (с учетом стехиометрических коэффици-ентов). Так, для реакции a А + b В ↔ сС + dD при стандартных усло-виях Δ r H o298=[ c Δ H o f ,298, C + d Δ H o f ,298, D ] – [ a Δ H o f ,298, A + b Δ H o f ,298, B ]. (2)
2. Тепловой эффект химической реакции равен разности сумм теплот сгорания исходных веществ и продуктов реакции, умноженных на стехиометрические коэффициенты:
Δ r H 0298 = [ а Δ H o с ,298, А + b Δ H o с ,298, B ] – [ c Δ H o с ,298, C + d Δ H o с ,298, D ].
3. Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции (закон Лавуазье–Лапласа). Зависимость теплового эффекта реакции от температуры. Энтальпия является функцией температуры, непрерывной в области изменения последней. Зависимость изменения энтальпии (теплового эффекта) химической реакции от температуры выражается уравнениями
где cp – теплоемкость при постоянном давлении (изобарная теплоемкость). Теплоемкость системы − отношение количества сообщенной системе теплоты к наблюдаемому при этом повышению температуры. Это количество энергии, которое в форме теплоты необходимо подвести к системе или отвести от нее для изменения температуры на 1 К. Для не слишком широких интервалов температур можно считать, что теплоемкость не зависит от температуры (ср = const). Значения молярных изобарных теплоемкостей ср 298 веществ приведены в справочниках. Чтобы найти изменения внутренней энергии или энтальпии вещества при изменении температуры системы от Т 1 до Т 2, необходимо интегрировать соответствующее уравнение. С практической точки зрения большее значение имеют химические процессы, протекающие в изобарных условиях, тепловой эффект которых рассчитывают через изменение энтальпии. Если в интервале от 298 К до температуры Т К нет фазовых переходов, то изменение энтальпии образования вещества составит:
Если в температурном интервале имеются фазовые переходы, то при расчете необходимо учитывать изменение энтальпии вещества при фазовом переходе. Например, изменение энтальпии одного моля воды при изобарном нагревании от Т 1 < 0 °С, до Т 2 > 100 °С можно представить в виде
где D m Н 0 [кДж/моль] – энтальпия плавления (melting – плавление); D v Н 0 [кДж/моль] – энтальпия испарения (vaporization – испарение);
7. Направление протекания химических реакций.
В 1867 г. Бертло сформулировал принцип, согласно которому самопроизвольно протекают лишь такие процессы, которые сопровождаются выделением теплоты (экзотермические реакции). Однако в дальнейшем стало известно, что тепловые эффекты реакций не могут быть единственной движущей силой химической реакции. Движущая сила химической реакции определяется изменением свободной энергии системы, т.е. той части общего запаса энергии реакционной системы, которая может быть использована для совершения максимальной работы. При постоянных давлении (р = const) и температуре Второе начало термодинами ки. Направление протекания самопроизвольного процесса можно определить на основе второго закона, или начала, термодинамики, сформулированного, например, в виде постулата Клаузиуса: теплота сама собой не может переходить от холодного тела к горячему, т.е. невозможен такой процесс, единственным результатом которого был бы переход теплоты от тела с более низкой температурой к телу с более высокой температурой. Клаузиусом была введена функция состояния S, названная энтропией, изменение которой равно теплоте обратимого процесса, отнесенной к температуре:
где S – энтропия, Дж/моль·К; Q обр − теплота обратимого процесса; Т – температура, К. Для любого процесса
Энтропия (S) характеризует тенденцию к росту беспорядка реакционной системы на молекулярном уровне. Энтропию относят к одному молю вещества, обозначают символом S, а в стандартных условиях − S °. Поскольку энтропия есть функция состояния, то её изменение ∆ S, сопровождающее химическую реакцию, можно рассчитать аналогично изменению энтальпии. Для химической реакции в стандартных условиях ∆ S 0298(реакции) = ∑(n ' S 0298)прод.− ∑(n '' S 0298)исх.,
где n ', n '' – соответствующие стехиометрические коэффициенты в уравнении реакции. Энтропия является возрастающей функцией температуры, причем особенно резко, скачкообразно она изменяется при температурах фазовых переходов. Изменение энтропии (∆ Si) при фазовых превращениях (плавление↔кристаллизация – D m H; испарение↔конденсация – D v H; полиморфные превращения кристаллов) можно рассчитать:
где D i H и Ti – соответственно энтальпия и температура фазового перехода. Вообще для любого обратимого процесса при постоянных р, T, когда известна величина ∆ H, изменение энтропии
Температура является характеристикой (мерой) теплового движения молекул и атомов. Поэтому с ростом температуры растет интенсивность движения частиц и соответственно уменьшается упорядоченность системы, следовательно, возрастает энтропия:
При нагревании в изобарных условиях (р = const) изменение энтропии (если есть фазовые переходы)
где Т 1 и Т 2 – температурный интервал, Т фп – температура фазового перехода, D H фп – энтальпия фазового перехода, (ср) i – изобарная теплоемкость соответствующей фазы. В соответствии с первым и вторым началами термодинамики для обратимого процесса
где Если продифференцировать это выражение и обозначить (H – TS) как G, то получим
Максимальная полезная работа в изобарно-изотермических условиях равна изменению термодинамической функции, которая получила название свободная энергия Гиббса (изобарно-изотермический потенциал) и условно обозначается буквой G. Изменение энергии Гиббса представляет собой ту часть полной энергии системы, которую, в принципе, можно превратить в максимальную полезную работу и которая является суммарной движущей силой процесса в изобарно-изотермических условиях. Для конечного процесса
В общем случае (для любой температуры)
Δ G 0 Т = Δ Н 0 Т – Т Δ S 0Т, кДж (Дж) (3)
Выражение (3)является математическим выражением второго начала термодинамики. Из него следует, что теплота процесса (Δ H) может быть лишь частично превращена в работу, которую характеризует свободная энергия Гиббса (Δ G). Функция T Δ S – тепло, которое не может быть превращено в работу и называется связанной энергией. Стандартные энергии Гиббса Δ G 0298, энтальпии образования Δ H 0 f ,298 и Δ S 0298 приводятся в справочниках физико-химических величин. В этих таблицах Δ H 0 f ,298 и Δ G 0 f ,298 простых веществ в стандартном состоянии условно принимаются равными нулю. Движущей силой химической реакции является изменение энергии Гиббса. Изменение энергии Гиббса и Гельмгольца служит критерием направления самопроизвольного процесса в закрытых системах. В табл. 3 приведено влияние температуры на самопроизвольное протекание реакции.
Т а б л и ц а 3 Влияние изменения Δ H и Δ S при Т на протекание реакции
Окончание табл. 3
В закрытых системах самопроизвольные процессы могут протекать только в направлении уменьшения энергии Гиббса (при Примеры решения типовых задач
Пример 1. Определить тепловой эффект процесса термического разложения хлорида аммония и составить термохимическое уравнение реакции. Решение. Реакция выражается уравнением NH4Cl(к)→NH3(г) + + HCl (г). Согласно следствию из закона Гесса (2)
∆ H 0298 (реакции) = ∑(n '∆ fH 0298)прод− ∑(n ''∆ fH 0298)исх =
= ∆ H 0298(NH3) (г) + ∆ H 0298(HCl) (г) − ∆ H 0298(NH4Cl) (к).
Используя справочные данные значений ∆ H 0298 веществ, получаем ∆ H 0298(реакции) = (−46,2 – 92,2) – (−314,2) = + 175 кДж.
Таким образом, термическое разложение NH4Cl является эндотермической реакцией. Термохимическое уравнение имеет вид
NH4Cl(к)→NH3 (г) + HCl (г) – 175 кДж.
Пример 2. Возможен ли процесс получения металлического железа из оксида Fe2O3 действием водорода при стандартных условиях Fe2O3(к) + 3H2(г) = 2Fe(к) + 3H2O(ж)? Как скажется повышение температуры на вероятности протекания этой реакции? Решение. Для ответа на первый вопрос задачи необходимо рассчитать изменение свобод
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 155; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.129.210.17 (0.005 с.) |

 .
.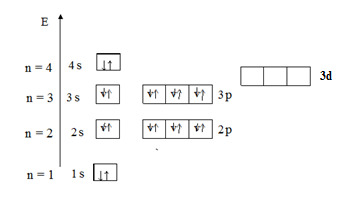

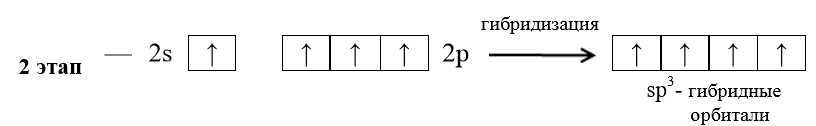
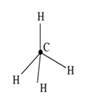 Рис. 7. sр 3-гибридиза-
ция в молекуле СН4
Рис. 7. sр 3-гибридиза-
ция в молекуле СН4
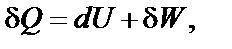
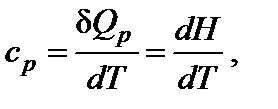
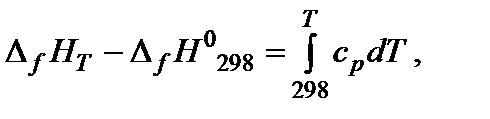
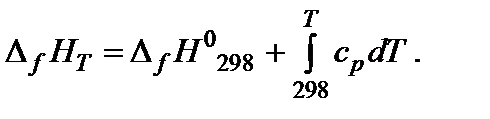
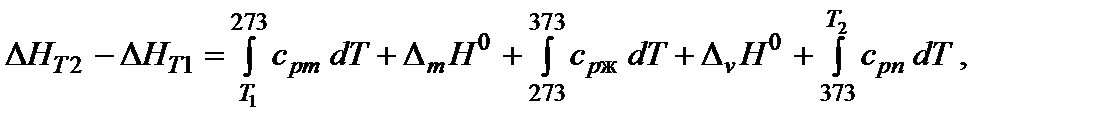
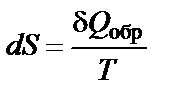 ,
,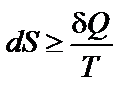 .
.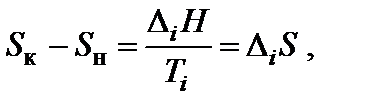
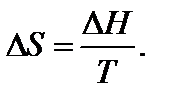
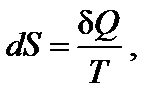
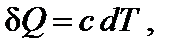
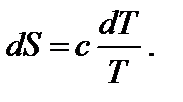
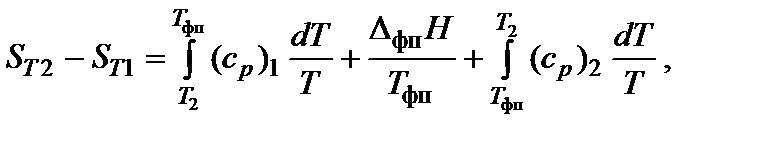
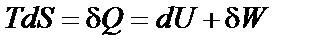 max,
max,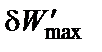 − максимальная полезная работа обратимого процесса, которая включает все виды работ, кроме работы расширения газа.
− максимальная полезная работа обратимого процесса, которая включает все виды работ, кроме работы расширения газа.