Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химические свойства простых эфиров
Простые эфиры значительно менее реакционноспособны, чем спирты. Только в жестких условиях они разлагаются, например
СН3–СН2–О–СН2–СН3 + HI ® СН3–СН2–ОН + СН3–СН2–I конц.
СН3–СН2–О–СН2–СН3 + 2Na натрийорганическое соед.
В отличие от сложных эфиров, простые эфиры не гидролизуются. При хранении на воздухе простые эфиры окисляются до органических пероксидов – соединений состава R–O–O–R', например
Органические пероксиды взрывоопасны. Эти соединения сами по себе не рассматриваются в школьной программе, но нужно отметить, что органические пероксиды изменяют механизм гидрогалогенирования непредельных соединений: в их присутствии присоединение НГ идет против правила Марковникова, например:
Это известный способ, такие задания встречаются на химических олимпиадах.
Применение простых эфиров
Все простые эфиры – отличные растворители. Самый популярный эфир – диэтиловый (или серный, это старое его название), также применяется в медицине как наркоз.
Сложные эфиры
Сложные эфиры это соединения вида
Их можно рассматривать как производное кислоты, в которой группа –ОН заменена на остаток спирта –OR. Название сложных эфиров начинается с названия спирта с окончанием «-ил» и названия кислотного остатка, т. е. в рассмотренной общей формуле R2-ил R1-ат, причем названия радикалов кислотных остатков допускается и по международной и по рациональной номенклатуре, например:
метиловый эфир муравьиной кислоты
изопропиловый эфир уксусной кислоты
Если эфир образован одноосновной предельной кислотой и предельным одноосновным спиртом, то общая формула эфира С n H2 n O2
такие эфиры изомерны предельным одноосновным карбоновым кислотам, например:
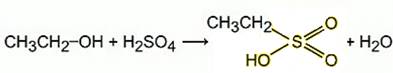
Сложные эфиры могут быть у неорганических кислот: азотной, серной, борной. Например, при температуре около 100 °С этиловый спирт образует с серной кислоты кислый сложный эфир – этилсульфат или т.н. этилсерную кислоту:
Образование сложный эфир ортоборной кислоты и этанола (триэтилбората) см. здесь https://youtu.be/IhBa01vfwrk?list=PLnbQh4j9gZkKZDdTU1xVdJZ8FQIvkJCWF
Образование сложного эфира азотной кислоты и глицерина – нитроглицерина см. в свойствах спиртов.
Перечислим основные способы получения сложных эфиров (подробнее см. свойства спиртов и карбоновых кислот): 1. Реакция этерификации (т.е. эфирообразования), эфир = эстер = этер – слово происходит от греческого αἰθήρ. 2. Взаимодействие ангидридов и галогенангидридов со спиртами. 3. Взаимодействие солей карбоновых кислот и галогеналканов – очень много реакций в ЕГЭ.
|
|||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 98; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.224.197 (0.006 с.) |
 СН3–СН2–ОNa + СН3–СН2–Na
СН3–СН2–ОNa + СН3–СН2–Na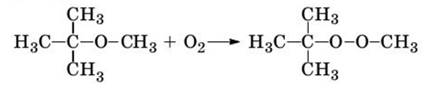


 метилформиат (метилметаноат)
метилформиат (метилметаноат)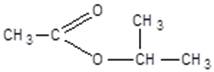 изопропилацетат (изопропилэтаноат)
изопропилацетат (изопропилэтаноат)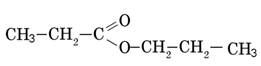 пропилпропионат изомерен капроновой кислоте
пропилпропионат изомерен капроновой кислоте