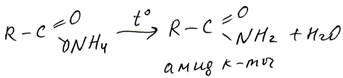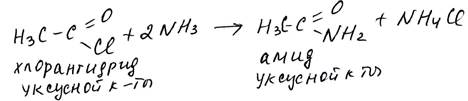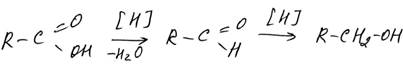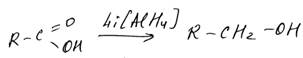Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химические свойства карбоновых кислот
1. Карбоновые кислоты проявляют обычные свойства кислот: это связано с подвижностью атома Н в карбоксильной группе:
Так как метильные радикалы обладают положительным индуктивным эффектом и уменьшают отрицательный заряд на анионе
поэтому с увеличением углеводородного радикала сила кислот уменьшается.
Карбоновые кислоты относятся к слабым электролитам, и проявляют свойства кислот: – диссоциируют в растворе с отщеплением Н+, их растворы имеют кислую среду; см. опыты https://www.youtube.com/watch?v=Kj5uQzqExkg&list=PLnbQh4j9gZkKZDdTU1xVdJZ8FQIvkJCWF&index=92&t=0s https://www.youtube.com/watch?v=ezhjyC4YrZs&list=PLnbQh4j9gZkKZDdTU1xVdJZ8FQIvkJCWF&index=44&t=0s
– реагируют с металлами (с видимой скоростью реакция идет с активными металлами), например
2СН3СООН + Са = Са(СН3СОО)2 + Н2 ацетат кальция см. опыт https://youtu.be/cVQcBWVcuiI?list=PLnbQh4j9gZkKZDdTU1xVdJZ8FQIvkJCWF – реагируют с оксидами и гидроксидами металлов, например
СН3СООН + КОН = КСН3СОО + Н2О
см. опыт https://youtu.be/9li-nxrYpkY?list=PLnbQh4j9gZkKZDdTU1xVdJZ8FQIvkJCWF – солями еще более слабой кислоты – карбонатами и гидрокарбонатами:
СН3СООН + NaHCO3 = NaСН3СОО + Н2О + СО2
https://youtu.be/NMAxOpsB7vI – с аммиаком: СН3СООН + NH3 = NH4СН3СОО
2. Особые свойства муравьиной кислоты. В отличие от всех остальных кислот, муравьиная кислота имеет кроме карбоксильной и карбонильную группу:
а значит, проявляет и свойства кислот, и некоторые свойства альдегидов. В частности, муравьиная кислота может окисляться (с образованием СО2 или карбонатов). В ЕГЭ есть задание: установите соответствие между исходными веществами и продуктами: Исходные вещества: Продукты:
Имеется в виду, что без нагревания слабый окислитель Cu(OH)2 не может окислить муравьиную кислоту, идет обычное взаимодействие основание и кислоты, образуется соль формиат меди (II):
А при нагревании идет ОВР, муравьиная кислота окисляется до угольной (СО2 + Н2О), медь восстанавливается до Cu2O:
Муравьиная кислота вступает в реакцию серебряного зеркала, запишем эту реакцию «в формате ЕГЭ» – образующийся углекислый газ переходит в карбонат аммония:
Муравьиная кислота окисляется до СО2 и другими окислителями: бромной водой, азотной кислотой, хлором и др. Взаимодействие муравьиной кислоты с перманганатом калия см. здесь:
https://youtu.be/yUrQ_c11bX0?list=PLnbQh4j9gZkKZDdTU1xVdJZ8FQIvkJCWF
Другой особенностью муравьиной кислоты является отсутствие достаточно прочных связей С–С: эта кислота легко разрушается под действием концентрированной серной кислоты:
см. опыт https://youtu.be/1aigiEjbTT0?list=PLnbQh4j9gZkKZDdTU1xVdJZ8FQIvkJCWF
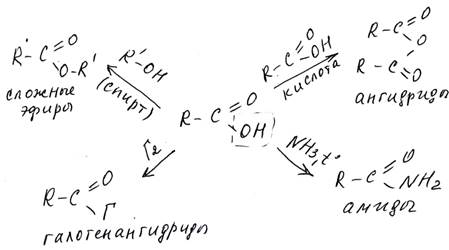
В пункте 1 рассматривались «обычные» свойства карбоновых кислот, связанные с замещением подвижного Н+ в карбоксильной группе. Но карбоновые кислоты способны вступать в реакции замещения всей группы ОН (реакции нуклеофильного замещения), при этом образуются так называемые функциональные производные карбоновых кислот:
Рассмотрим подробно их образование. 3. Взаимодействие со спиртами с образованием простых эфиров – реакция этерификации – подробно рассмотрена в теме спирты. 4. Образование галогенангидридов кислот – соединений, в которых группа ОН в кислоте замещена на галоген. Известные неорганические соединения SOCl2 и SO2Cl2 также можно рассматривать как ангидриды сернистой и серной кислот соответственно:
Галогенангидриды карбоновых кислот можно получить действием галогенидов фосфора (РГ3, РГ5) или SOCl2:
5. Образование ангидридов кислот. Можно провести межмолекулярную дегидратацию – под действием водоотнимающего агента (обычно Р2О5) от двух молекул карбоновой кислоты отнять одну молекулу воды. Приведем пример с уксусной кислотой:
Ангидриды кислот, как и галогенангидриды, более реакционноспособные соединения, чем сами карбоновые кислоты. Их часто используют в органических синтезах, когда нужно получить другие производные кислоты, например:
6. Образование амидов кислот. Амиды кислот получают в две стадии: сначала кислота реагирует с аммиаком с образованием соли аммония:
При нагревании этой соли образуется амид кислоты – соединение, в котором группа ОН кислоты заменена на группу NH2:
Удобнее получать амиды из галогенангидридов.
7. Окисление (горение) кислот. Кроме муравьиной, карбоновые кислоты не окисляются обычными окислителями, но могут гореть: см. видео.
https://youtu.be/SmB8C4_y7hg
СН3СООН + 2О2 = 2H2О + 2СО2
8. Восстановление кислот. Карбоновые кислоты могут быть восстановлены до альдегидов и далее до спиртов по схеме
Но обычное каталитическое гидрирование для восстановления не подходит: предельные карбоновые кислоты практически не реагируют с Н2. Но кислоты можно восстановить очень сильным восстановителем Li[AlH4]:
или можно восстановить Н2 хлорангидрид кислоты:
9. Галогенирование карбоновых кислот – реакции замещения водорода в углеводородном радикале. Водородные атомы в углеводородной цепи карбоновой кислоты подобны по реакционной способности таковым у алканов, за исключением водорода при углероде в a-положении – т.е. при первом, не считая функциональную группу:
Из-за сильного влияния карбоксильной группы, водород при a-углероде может относительно легко замещаться на галоген. Реакция проходит в присутствии фосфора или его галогенидов. В ЕГЭ пишут: Г2 (Р), Г2 (РГ3), например:
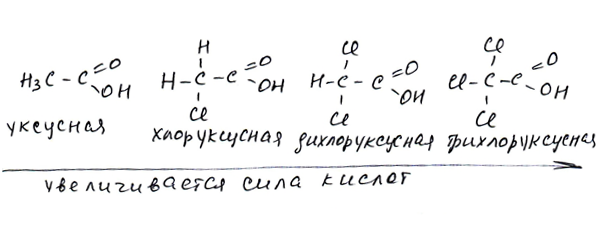
Таким образом получают a-галогенкарбоновые кислоты. Очень популярны хлоруксусные кислоты.
Появление галогена в цепочке увеличивает силу кислоты: трихлоуксусная кислота не уступает сильным неорганическим кислотам.
|
||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 72; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.149.26.246 (0.011 с.) |




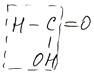

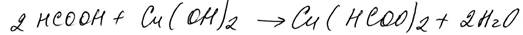


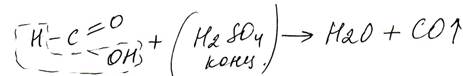
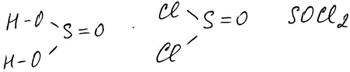
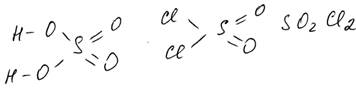



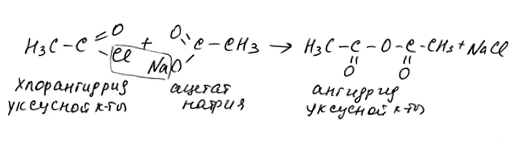

 + R2–ОН ®
+ R2–ОН ® 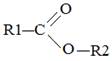 + НГ
+ НГ