
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Регуляция активности ферментов: неспецифическая, аллостерическая, регуляция на уровне индукции и репрессии, гормональная регуляция.
1)неспецифические (усиливающие активность целой группы ферментов) б) температура – закон о повышении скорости реакции в 2-4 раза при повышении темп-ры на 10°С справедлив и для ферментативны реакций, но только в пределах до 55-60°С, т.е до температур денатурации белков. Наряду с этим, как исключения, есть ферменты микроорганизмов, существующих в воде горячих источников и гейзеров. При понижении темп-ры активность понижается, но не исчезает совсем (например, температура тела у животных впадающих в спячку (ежи, суслики) понижается до 3-5°С) в) концентрации субстрата и фермента: 1) при увеличении концентрации субстрата скорость реакции сначала возрастает соответственно подключению к реакции новых молекул фермента, затем наблюдается эффект насыщения, когда все молекулы фермента взаимодействуют с молекулами субстрата. При дальнейшем увеличении концентрации субстрата между его молекулами возникает конкуренция за активный центр фермента, и скорость реакции снижается; 2) при увеличении количества молекул фермента скорость реакции возрастает непрерывно и прямо пропорционально количеству фермента, т.к. большее количество молекул фермента производит большее число молекул продукта 2) Аллостерические ферменты состоят из 2 или более субъединиц: одни содержат каталитический центр, другие имеют аллостерический центр и являются регуляторными. Присоединение эффектора (клеточные метаболиты именно того пути, регуляцию кот-го они осуществляют) к аллостерической (регуляторной) субъединице изменяет конформацию белка и соотвественно активность каталитической субъединицы. Аллостерические ферменты обычно стоят в начале метаболического пути и от их активности зависит течение многих последующих реакций, поэтому их называют ключевыми ферментами. 3)Регуляция на уровне индукции и репрессии: индукция является одной из форм негативной регуляции, называется так, потому что транскрипция может идти лишь после удаления репрессора. Еще одной разновидностью негативной регуляции явл-ся катаболит-ая репрессия. Репрессия происходит тогда, когда репрессор связыв-ся с оператором не иначе как в комплексе с низкомолекулярным кофактором. Таким корепрессором часто бывает конечный продукт белкового синтеза, кодируемый опероном. Тогда если конец этого продукта становится слишком высок, он свзявается с репрессором и дальнейшем его синтез прекращается. Примером – триптофановый оперон.
4)Гормональная регуляция – поскольку активность ферментов в клетке зависит от факторов внутренней среды, то виляние на количество и соотношение этих факторов является дополнительной возможностью гормональной регуляции. Пример – действие альдостерона на обмен электролитов и воды в организме, а так же контроль паратгормоном и тиерокальцитонином обмена Са и Р. Согласно Международной классификации, ферментыделят на шесть главных классов (по типу катализируемой реакции), в каждом из которых несколько подклассов(по природе атакуемой хим. группы): 1) оксидоредуктазы; 2) трансферазы; 3)гидролазы; 4) лиазы; 5) изомеразы; 6) лигазы (синтетазы) КФ 1.2.3.4 Где КФ – классификация фермента, 1 – класс 2 - подкласс 3 – подподкласс (по характеру атакуемой связи или по природе акцептора) 4 - порядковый номер Оксидоредуктазы. К классу оксидоредуктаз относят ферменты, катализирующие с участием двух субстратов окислительно-восстановительные реакции, лежащие в основе биологического окисления. Различают следующие основные оксидоредуктазы: -аэробные дегидрогеназы или оксидазы, катализирующие перенос протонов (электронов) непосредственно на кислород; -анаэробные дегидрогеназы, ускоряющие перенос протонов (электронов) на промежуточный субстрат, но не на кислород; -цитохромы, катализирующие перенос только электронов. К этому классу относят также гемсодержащие ферменты каталазу и пероксидазу, катализирующие реакции с участием перекиси водорода. Коферменты: НАД, НАДФ, ФАД, ФМН, убихинон, глутатион
Фермент - алкогольдегидрогеназа
Трансферазы. К классу трансфераз относят ферменты, катализирующие реакции межмолекулярного переноса различных атомов, групп атомов и радикалов (кроме водорода). Различают трансферазы, катализирующие перенос одноуглеродных остатков, ацильных, гликозильных, альдегидных или кетонных, нуклеотидных остатков, азотистых групп, остатков фосфорной и серной кислот и др. Например: метил- и формилтрансферазы, ацетилтрансферазы, амино-трансферазы, фосфотрансферазы и др. Коферменты: пиридоксальфосфат, коэнзим А, метилкобаламин, тетрагидрофолиевая ксилота
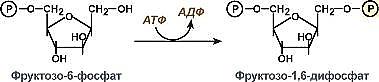
Фермент- фосфофруктокиназа Гидролазы. В класс гидролаз входит большая группа ферментов, катализирующих расщепление внутримолекулярных связей органических веществ при участии молекулы воды. К ним относятся: эстеразы – ферменты, катализирующие реакции гидролиза и синтеза сложных эфиров; гликозидазы, ускоряющие разрыв гликозидных связей; фосфатазы и пептидгидролазы, катализирующие гидролиз фосфоангидридных и пептидных связей; амидазы, ускоряющие разрыв амидных связей, отличных от пептидных, и др. Коферменты отсутствуют
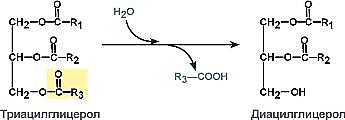
фермент – ТАГ-липаза Лиазы. К классу лиаз относят ферменты, катализирующие разрыв связей С—О, С—С, С—N и других, а также обратимые реакции отщепления различных групп от субстратов не гидролитическим путем. Эти реакциисопровождаются образованием двойной связи или присоединением групп к месту разрыва двойной связи. Ферментыобозначают термином «субстрат-лиазы». Например, фумарат-гидратаза (систематическое название «L-малат-гидролаза») катализирует обратимое отщепление молекулы воды от яблочной кислоты с образованием фумаровойкислоты. В эту же группу входят декарбоксилазы (карбокси-лиазы), амидин-лиазы и др. Коферменты: пиридоксальфосфат, тиаминдифосфат, магний, кобальт
Изомеразы. К классу изомераз относят ферменты, катализирующие взаимопревращения оптических и геометрических изомеров в пределах одной молекулы Если изомеризация включает внутримолекулярный перенос группы, фермент получает название «мутаза». К этому же классу относят рацемазы и эпимеразы, действующие на амино- и оксикислоты, углеводы и их производные; внутримолекулярные оксидоредуктазы, катализирующие взаимопревращения альдоз и кетоз; внутримолекулярные трансферазы, переносящие ацильные, фосфорильные и другие группы, и т.д. Коферменты: пиридоксальфосфат, дезоксиаденозилкобаламин, глутатион, фосфаты моносахаридов
Лигазы (синтетазы). К классу лигаз относят ферменты, катализирующие синтез органических веществ из двух исходных молекул с использованием энергии распада АТФ (или другого нуклеозидтрифосфата). В качестве примера можно назвать L-глутамат: аммиак лигазу (рекомендуемое сокращенное название «глутаминсинтета-за»), при участии которой из глутаминовой кислоты и аммиака в присутствии АТФ синтезируется глутамин. Коферменты: нуклеотидный (УТФ), витамин Н, фолиевый
21. Структура и функции водорастворимых витаминов. Превращение в коферменты (синтез НАД из никотиновой кислоты)….. Большинство водораствор.витаминов не накапливаются в организме, поэтому должны поступать ежедневно. Вит С-Аскорбиновая к-та- белое крисстал. В-во кислого вкуса, без запаха, легко окисляется и растворяется в H2O. В кислой среде витамин С сохраняется лучше. Повышает устойчивость организма к инфекциям,укрепляет стенки сосудов, участвует в реакциях гидроксилирования, необходим для синтеза кортикостероидов и для образования нейромедиаторов. (черная смородина, шиповник, картофель, грецкий орех, цитрусовые). Вит.В1 - Тиамин- в чист.виде-бесцвет кристаллы с запахом дрожжей, хорошо растворимы в H2O.Отвечает за углевод.
обмен, регулирует ф-и эндокрин,централ, периферич. систем. Необходим для передачи нерв. Импульса. (дрожжи, хлеб грубого помола, кукуруза, фасоль). Вит В2 - рибофлавин- в чистом виде оранжево-желтый порошок горького вкуса,трудно растворим в H2O, окисляет восстановленную форму НАД•Н, окисляет жирные к-ты. (сыр,молоч продукты) Вит В3- Пантотеновая кислота- в чист. Виде- жидкость желтого цвета,хорошо растворима в H2O. Отвечает за энергетич.обмен,ф-и нерв. Сист и перестатику кишечника, осабляет побочное дейстивие антибиотиков. (печень, яйца, дрожжи). Вит В6- пиридоксин- бесцвет. Кристаллы, хорошо растворимые в H2O, участвует в обмене БЖУ, необходим для усвоения аминокислот, участв в образ.гемоглобина. (печень, дрожжи, рис, горох). Вит В9, В10, Вс (фолиевая кислота) - в чистом виде- кристаллы оранжево-желтые, плохо раствор в H2O. Необходим для роста и развития, регулир уровень гемоглобина, оказывает обезболивающ. действие. Недостаток при беременности. (капуста, петрушка, бобы,в листьях раст). Вит В12- цианкобаламин - красное кристаллич. В-во, без вкуса и запаха, на свету разлагается. Необходим для норм кроветворения, нормализует жиров обмен в печени, снижает уровень холестерина в крови, улучшает память, участвует в транспорте водорода и в синтезе метионина. (говяжья печень, сердце, молоко). Вит РР- никотиновая к-та, никотинамид - белые кристаллы без запаха, устойчив при кипячении, кисловатого вкуса. Влияет на обмен белков и холестерина, расширяет мелкие сосуды, поддержив работу сердца, желудка, кишечника, используется для синтеза НАД и НАДФ. (морская рыба, грибы, соя, пшенич.отруби) Витамин Р- рутин или биофлаваноиды- продукты растит. Происхожд, много схожего с вит.С. Укрепляет капилляры, увелич. Прочность стенки сосуда, помогает работе щитовидк. (апельсины, брусника, клюква, укроп, свекла). Вит Н- биотин- кристаллы,хорошо раствор в H2O, устойчив при нагревании. Снижает сахар в крови, облегчает мышеч. боли, приостанавливает поседение волос. (творог,горошек,печень)
|
|||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 104; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.120.133 (0.009 с.) |

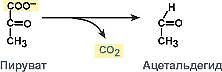 фермент – пируватдекарбоксилаза
фермент – пируватдекарбоксилаза фермент - фосфоглюкомутаза
фермент - фосфоглюкомутаза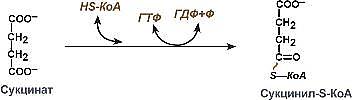 фермент - сукцинил-КоА-синтетаз
фермент - сукцинил-КоА-синтетаз


