Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Структура и функция аминокислот с полярным (заряженным положительно) радикалом. Роль радикалов гистидина в гемоглобине и ферментах. Роль радикалов лизина в структурах коллагена и эластина. Гистоны.Стр 1 из 39Следующая ⇒
L - глутаминовая к-та HOOC-CH2-CH2-CH-COOH NH2
L -аспарагиновая к-та HOOC-CH2-CH-COOH NH2 Глутаминовая кислота (2-аминопентандиовая кислота) — алифатическая аминокислота. В живых организмах глутаминовая кислота в виде аниона глутамата присутствуют в составе белков, ряда низкомолекулярных веществ и в свободном виде. Глутаминовая кислота играет важную роль в азотистом обмене. Глутаминовая кислота также является нейромедиаторной аминокислотой, одним из важных представителей класса «возбуждающихаминокислот» Связывание глутамата со специфическими рецепторами нейроновприводит к возбуждению последних.
Аспарагиновая кислота (аминоянтарная кислота, аспартат, аминобутандиовая кислота) — алифатическаяаминокислота, одна из 20 протеиногенных аминокислот организма. Встречается во всех организмах в свободном виде и в составе белков. Кроме того, выполняет роль нейромедиатора в центральной нервной системе.
Аминокислоты как амфотерные соединения образуют соли как с кислотами (по группе NH2), так и со щелочами (по группе СООН):
Роль белков в организме человека, классификация белков по сложности, форме и функции. Глобуллярные и фибриллярные белки, особенности аминокислотного состава и структурной организации. Белки— это основа строения и жизнедеятельности организмов, это органический строительный материал, который образует клеточные стенки, мышцы и волокна. . Они являются тем самым «транспортом», который принимает участие в обменных процессах организма, в его пищеварении, энергетическом обмене, ставит иммунитет на должный уровень, влияет на усвояемость углеводов, жиров, витаминов и микроэлементов. Классификация белков по сложности: Простые белки построены из остатков аминокислот и при гидролизе распадаются соответственно только на свободные аминокислоты. (Подгруппы:протамины, гистоны, альбумины, глобулины, проламины, глютелины и др). Сложные белки – это двухкомпонентные белки, которые состоят из какого-либо простого белка и небелкового компонента, называемого простетической группой. При гидролизе сложных белков, помимо свободных аминокислот, освобождается небелковая часть или продукты ее распада.
Классификация по функции: 1. Ферментативные(пепсин, амилаза) 2. Регуляторные белки (инсулин,соматотропный гормон)3. Рецепторные белки (гормоны, нейромедиаторы) 4. Транспортные белки(трансферрин,альбумин)5. Структурные белки(коллаген,кератин)6. Защитные белки(иммуноглобулины,тромбин) 7. Сократительные и двигательные(актин,миозин). Классификация по форме: 1) Фибриллярные белки имеют вытянутую, нитевидную структуру, соотношение продольной и поперечной осей составляет более 1:10.Состоят из пучков полипептидных цепей, спирально навитых друг на друга и связанных между собой поперечными ковалентными или водородными связями. (коллагены, эластин, кератин,миозин и фибрин 2) Глобулярные белки соотношение продольной и поперечной осей которых составляет 1:3 или 1:4, т.е. белковая молекула имеет форму эллипса. Они характеризуются компактной кладкой полипептидных цепей. (инсулин, альбумины и глобулины). Простые и сложные ферменты, зимогены, изоферменты. Замена эмриональных ферментов из ферментов взрослого человека после рождения. Строение и функции активных и аллостерических центров фермента. Факторы определяющие каталитическую активность ферментов. Ферменты являются белками, и поэтому подобно белкам делятся на простые и сложные. Простые ферменты состоят только из аминокислот. Сложные ферменты (холоферменты) имеют в своем составе белковую часть, состоящую из аминоксилот –апофермент, и небелковую часть-кофактор. Кофактор может называться коферментом или простетической группой. Пример: аминотрансферазы (содержат пиридоксальфосфат), пероксидаза (содержит гемм). Изоферменты – это молекулярные формы одного и того же фермента, возникшие в результате неольших генетических различий в первичной структуре фермента. Различные ферменты определяют скорость и направление реакции. Примером фермента, имеющего изоферменты,является амилаза — панкреатическая амилаза отличается по аминокислотной последовательности и свойствам от амилазы слюнных желёз, кишечника и других органов.
Проферменты, или проэнзимы, зимогены, — функционально неактивные предшественники ферментов, подвергающиеся тем или иным преобразованиям, в результате чего образуется каталитически активный продукт — фермент. К ним относятся пепсиноген, активной формой которого является пепсин, трипсиноген — трипсин, химотрипсиноген — химотрипсин, и др. Строение: В составе фермента выделяют области, с разными функциями. 1.Активный центр-комбинация аминокислотных остатков(16-20), обеспечивающая связывание с молекулом субстрата и обеспечивающая катализ. В активном центре выделяют два участка: якорный (связывающий)- отвечает за связывание и ориентацию субстрата в активном центре, каталитический - отвечает за осуществление реакции. У ферментов, имеющих в своем составе несколько мономеров, м.б. несколько активных центров. 2.Аллостерический центр- центр регуляции активности фермента, который пространственно отделен от активного центра и есть не у всех ферментов. Связывание с аллостерическим центром какой-либо молекулы вызывает изменение конфигурации белка-фермента, а значит и скорости ферментативной реакции. Факторы: Различные химические соединения, связываясь с ферментами, могут изменять скорость катализируемых ферментами реакций. На каталитическую активность ферментов влияют и многие другие факторы, которые могут изменять строение или химическую природу ферментов. К числу таких факторов относятся: 1. рН. 2.темпер.3. Силы, действующие в текучих средах (гидродинамические силы, гидростатическое давление и поверхностное натяжение) 4. Химические агенты (спирт, мочевина или пероксид водорода)5. Облучение (свет, звук, ионизирующая радиация) Иногда снижение каталитической активности, вызванное, например изменением рН, обратимо. В таких случаях возврат к первоначальным условиям сопровождается восстановлением активности фермента. Специфичность действия ферментов (абсолютная, относительная). Зависимость скорости ферментативных реакций от концентрации субстрата и фермента, температуры,РН. Ингибирование и активирование ферментов – биомедицинские ферменты. Специфичность - очень высокая избирательность ферментов по отношению к субстрату. Специфичность фермента объясняется совпадением пространственной конфигурации субстрата и субстратного центра. За специфичность фермента ответственен как активный центр фермента, так и вся его белковая молекула. Активный центр фермента определяет тип реакции, который может осуществить данный фермент. Различают три вида специфичности: абсолютную, относительную, стереохимическую. Абсолютная специфичность. Такой специфичностью обладают ферменты, которые действуют только на один субстрат. Например, сахараза гидролизует только сахарозу, лактаза - лактозу, мальтаза - мальтозу, уреаза - мочевину, аргиназа - аргинин и т.д.
Зависимость: От концентрации субстрата и фермента: -При увеличении кол-ва молекул фермента скорость реакции возрастает непрерывно и прямо пропорц-но кол-ву фермента. -При увеличении концентрации субстрата скорость реакции сначала возрастает соответственно подключению к реакции новых молекул ферм-та, затем наблюдается эффект насыщения, когда все молекулы фермента взаимодействуют с молекулами субстрата. При дальнейшей увеличении скорости субстрата м/у его молекулами возникает конкуренция за акт.центр. и скорость реакции снижается. Зависимость от РН: Описывается колоколообразной кривой, с макс. Скорости при оптимальном РН для этого фермента.(называется РН –оптимумом). Значения рН-оптимума для различных ферментов колеблются в широких пределах. Н-р: у пепсина 1,5-2; у трипсина 8-8,5 Зависимость от температуры: Описывается колоколообразной кривой, с оптимальным знач. температуры для данного фермента. Закон о повышении скор.реакции в 2-4 раза при повышении температуры на 10град справедлив для фермент. реакций, но только до 50-60град. При понижении ферментов активность ферментов снижается, но не исчезает совсем. Ингибирование На скорость химической реакции влияют различные вещества. Те из них, которые тормозят ферментативные процессы, называются ингибиторами. Те же, которые усиливают реакции - активаторами. КФ 1.2.3.4 Где КФ – классификация фермента, 1 – класс 2 - подкласс 3 – подподкласс (по характеру атакуемой связи или по природе акцептора) 4 - порядковый номер Оксидоредуктазы. К классу оксидоредуктаз относят ферменты, катализирующие с участием двух субстратов окислительно-восстановительные реакции, лежащие в основе биологического окисления.
Различают следующие основные оксидоредуктазы: -аэробные дегидрогеназы или оксидазы, катализирующие перенос протонов (электронов) непосредственно на кислород; -анаэробные дегидрогеназы, ускоряющие перенос протонов (электронов) на промежуточный субстрат, но не на кислород; -цитохромы, катализирующие перенос только электронов. К этому классу относят также гемсодержащие ферменты каталазу и пероксидазу, катализирующие реакции с участием перекиси водорода. Коферменты: НАД, НАДФ, ФАД, ФМН, убихинон, глутатион
Фермент - алкогольдегидрогеназа
Трансферазы. К классу трансфераз относят ферменты, катализирующие реакции межмолекулярного переноса различных атомов, групп атомов и радикалов (кроме водорода). Различают трансферазы, катализирующие перенос одноуглеродных остатков, ацильных, гликозильных, альдегидных или кетонных, нуклеотидных остатков, азотистых групп, остатков фосфорной и серной кислот и др. Например: метил- и формилтрансферазы, ацетилтрансферазы, амино-трансферазы, фосфотрансферазы и др. Коферменты: пиридоксальфосфат, коэнзим А, метилкобаламин, тетрагидрофолиевая ксилота
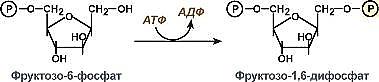
Фермент- фосфофруктокиназа Гидролазы. В класс гидролаз входит большая группа ферментов, катализирующих расщепление внутримолекулярных связей органических веществ при участии молекулы воды. К ним относятся: эстеразы – ферменты, катализирующие реакции гидролиза и синтеза сложных эфиров; гликозидазы, ускоряющие разрыв гликозидных связей; фосфатазы и пептидгидролазы, катализирующие гидролиз фосфоангидридных и пептидных связей; амидазы, ускоряющие разрыв амидных связей, отличных от пептидных, и др. Коферменты отсутствуют
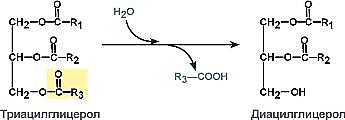
фермент – ТАГ-липаза Лиазы. К классу лиаз относят ферменты, катализирующие разрыв связей С—О, С—С, С—N и других, а также обратимые реакции отщепления различных групп от субстратов не гидролитическим путем. Эти реакциисопровождаются образованием двойной связи или присоединением групп к месту разрыва двойной связи. Ферментыобозначают термином «субстрат-лиазы». Например, фумарат-гидратаза (систематическое название «L-малат-гидролаза») катализирует обратимое отщепление молекулы воды от яблочной кислоты с образованием фумаровойкислоты. В эту же группу входят декарбоксилазы (карбокси-лиазы), амидин-лиазы и др. Коферменты: пиридоксальфосфат, тиаминдифосфат, магний, кобальт
Изомеразы. К классу изомераз относят ферменты, катализирующие взаимопревращения оптических и геометрических изомеров в пределах одной молекулы Если изомеризация включает внутримолекулярный перенос группы, фермент получает название «мутаза». К этому же классу относят рацемазы и эпимеразы, действующие на амино- и оксикислоты, углеводы и их производные; внутримолекулярные оксидоредуктазы, катализирующие взаимопревращения альдоз и кетоз; внутримолекулярные трансферазы, переносящие ацильные, фосфорильные и другие группы, и т.д.
Коферменты: пиридоксальфосфат, дезоксиаденозилкобаламин, глутатион, фосфаты моносахаридов
Лигазы (синтетазы). К классу лигаз относят ферменты, катализирующие синтез органических веществ из двух исходных молекул с использованием энергии распада АТФ (или другого нуклеозидтрифосфата). В качестве примера можно назвать L-глутамат: аммиак лигазу (рекомендуемое сокращенное название «глутаминсинтета-за»), при участии которой из глутаминовой кислоты и аммиака в присутствии АТФ синтезируется глутамин. Коферменты: нуклеотидный (УТФ), витамин Н, фолиевый
21. Структура и функции водорастворимых витаминов. Превращение в коферменты (синтез НАД из никотиновой кислоты)….. Большинство водораствор.витаминов не накапливаются в организме, поэтому должны поступать ежедневно. Вит С-Аскорбиновая к-та- белое крисстал. В-во кислого вкуса, без запаха, легко окисляется и растворяется в H2O. В кислой среде витамин С сохраняется лучше. Повышает устойчивость организма к инфекциям,укрепляет стенки сосудов, участвует в реакциях гидроксилирования, необходим для синтеза кортикостероидов и для образования нейромедиаторов. (черная смородина, шиповник, картофель, грецкий орех, цитрусовые). Вит.В1 - Тиамин- в чист.виде-бесцвет кристаллы с запахом дрожжей, хорошо растворимы в H2O.Отвечает за углевод. обмен, регулирует ф-и эндокрин,централ, периферич. систем. Необходим для передачи нерв. Импульса. (дрожжи, хлеб грубого помола, кукуруза, фасоль). Вит В2 - рибофлавин- в чистом виде оранжево-желтый порошок горького вкуса,трудно растворим в H2O, окисляет восстановленную форму НАД•Н, окисляет жирные к-ты. (сыр,молоч продукты) Вит В3- Пантотеновая кислота- в чист. Виде- жидкость желтого цвета,хорошо растворима в H2O. Отвечает за энергетич.обмен,ф-и нерв. Сист и перестатику кишечника, осабляет побочное дейстивие антибиотиков. (печень, яйца, дрожжи). Вит В6- пиридоксин- бесцвет. Кристаллы, хорошо растворимые в H2O, участвует в обмене БЖУ, необходим для усвоения аминокислот, участв в образ.гемоглобина. (печень, дрожжи, рис, горох). Вит В9, В10, Вс (фолиевая кислота) - в чистом виде- кристаллы оранжево-желтые, плохо раствор в H2O. Необходим для роста и развития, регулир уровень гемоглобина, оказывает обезболивающ. действие. Недостаток при беременности. (капуста, петрушка, бобы,в листьях раст). Вит В12- цианкобаламин - красное кристаллич. В-во, без вкуса и запаха, на свету разлагается. Необходим для норм кроветворения, нормализует жиров обмен в печени, снижает уровень холестерина в крови, улучшает память, участвует в транспорте водорода и в синтезе метионина. (говяжья печень, сердце, молоко). Вит РР- никотиновая к-та, никотинамид - белые кристаллы без запаха, устойчив при кипячении, кисловатого вкуса. Влияет на обмен белков и холестерина, расширяет мелкие сосуды, поддержив работу сердца, желудка, кишечника, используется для синтеза НАД и НАДФ. (морская рыба, грибы, соя, пшенич.отруби) Витамин Р- рутин или биофлаваноиды- продукты растит. Происхожд, много схожего с вит.С. Укрепляет капилляры, увелич. Прочность стенки сосуда, помогает работе щитовидк. (апельсины, брусника, клюква, укроп, свекла). Вит Н- биотин- кристаллы,хорошо раствор в H2O, устойчив при нагревании. Снижает сахар в крови, облегчает мышеч. боли, приостанавливает поседение волос. (творог,горошек,печень) Мезим 25. Метаболизм, анаболизм, катаболизм. Метаболические пути, их организация и регуляция. Центральные, циклические, амфиболические, анаплеротические, вторичные пути метаболизма. Метаболизм - совокупность реакций в организме, направленных на образование органических веществ - составных частей клеток и тканей и реакций, заключающихся в распаде сложных органических веществ. Анаболизм (в переводе с греческого - вверх) - процессы синтеза сложных молекул из более простых, сопровождающиеся потреблением энергии. Метаболический путь – последовательность химических превращений конкретного вещества в клетке: а) Циклический метаболический путь – замкнутая последовательность химических превращений, приводящая в итоге к регенерации исходного вещества. Примеры: цикл лимонной кислоты, орнитиновый цикл мочеобразования Кребса. б) Линейный метаболический путь – линейная последовательность химических реакций. Примеры: гликолиз, пентозофосфатный путь. в) В центральных метаболических путях исходные вещества могут быть активаторами ключевых ферментов метаболического пути. Как правило, при этом аллостерической активации подвергаются ферменты, катализирующие ключевые реакции заключительных этапов метаболического пут. Цикл Кребса является центральным метаболическим путем, т.к. 1) связывает в клетке процессы катаболизма и анаболизма (пример: образующийся оксалоацетат используется в процессах глюконеогенеза, синтеза заменымых АК, цитрат – в синтезе жирных кислот и т.д.) 2) объединяет белки, жиры, углеводы, в нем сходятся почти все метаболические пути 3) является общим путем окончательного окисления большей части органических молекул в форме ацетил-КоА, играющих роль клеточного «топлива» 4) является основным путем, обеспечивающим энергией большинство клеток. г) Связующий путь (цикл), объединяющий пути распада и синтеза веществ, называется амфиболическим. Примером амфиболического цикла может служить цикл Кребса (рис. 11). Амфиболические пути связаны, как правило, с окислением веществ до углекислого газа и воды.
д ) Анаплеротический (анаплероз-пополнение) путь - метаболический путь, конечный продукт которого идентичен одному из промежуточных продуктов какого-либо циклического пути.Работа цикла Кребса не прерывается за счёт анаплеротических реакций, которые пополняют цикл субстратами: Пируват + СО2 + АТФ = Оксалоацетат (субстрат Цикла Кребса) + АДФ + Фн. К вторичным метаболическим путям принадлежит, например, биосинтез коферментов и гормонов, потому что эти соединения вырабатываются и используются только в следовых количествах. 26. Клеточное дыхание: локализация, ферменты, и коферменты, порядок расположения, функция. Сопряжение дыхания и фосфорилирования (окислит.фосфорилирование). Хемиосмотическая гипотеза Митчелла. Ферменты и коферменты объединены в дыхательную цепь. Дыхательная цепь – это система ферментов и коферментов, которые принимают участие в транспорте электронов и протонов от окисляемого субстрата на кислород. Состав дыхательной цепи: а)ферменты: дегидрогеназы (НАД и ФМН – зависимые); цитохромы; б)коферменты: НАД, ФМН, КоQ, гем. Ферменты и коферменты объеденены в комплексы (I, III, IV), или (II, III, IV). I комплекс – НАД Н – коэнзимQ – редуктаза. Состоит из 26 белковых субъединиц; кофакторов – (НАД, ФМН, КоQ) и 20 атомов железа. II комплекс называется сукцинатдегидрогеназа (СДГ), содержит кофермент ФАД. III комплекс – КоQ Н2-цитохром-С-редуктаза. Состоит из 11 белковых субъединиц; кофакторов – (КоQ Н2, трех гемов). IV комплекс – цитохром-С-цитохромоксидаза или ЦХО. Состоит из трех белковых субъединиц, двух гемов (гем А и гем А3) и двух атомов Сu (СuА и СuВ). Порядок расположения дыхательных цепей зависит от величины их способности присоединять электроны. Клеточное дыхание представляют как конечный этап пути превращений моносахаров (в основном глюкозы) до указанных конечных продуктов, в который на разных стадиях включаются другие сахара и их производные, а также промежуточные продукты распада липидов (жирные кислоты), белков (аминокислоты) и нуклеиновых оснований. Итоговая реакция клеточного дыхания будет выглядеть следующим образом:С6H12O6+6O2=6CO2+6H2O+2780КдЖ/моль Использование клетками кислорода открывает возможности для более полного окисления субстратов. В аэробных условиях продукты бескислородного окисления становятся субстратами цикла трикарбоновых кислот, в ходе которого образуются восстановленные дыхательные переносчики НАДФН, НАДН и флавиновые коферменты. Способность НАД+ и НАДФ+ играть роль промежуточного переносчика водорода связана с наличием в их структуре амида никотиновой кислоты. При взаимодействии этих кофакторов с атомами водорода имеет место обратимое гидрирование (присоединение атомовводорода):
Окислительное фосфорилирование — один из важнейших компонентов клеточного дыхания, приводящего к получению энергии в виде АТФ. Субстратами окислительного фосфорилирования служат продукты расщепления белков, жиров и углеводов. Процесс окислительного фосфорилирования проходит на кристах митохондрий. Согласно хемиосмотической концепции, движение электронов по дыхательной цепиявляется источником энергии для транслокации протонов через митохондриальную мембрану. Возникающая при этом разность электрохимических потенциалов (ΔμH+) приводит в действие АТФ-синтазу, катализирующую реакциюАДФ + Рi = АТФ. Теоретически еще одну молекулу АТФ можно получить в трансгидрогеназной реакции (если процесс начинается с восстановленного НАДФ): НАДФН + НАД+ = НАДФ+ + НАДН + 30 кДж/моль. 27. Цикл лимонной кислоты (цикл Кребса, цикл три- карбоновых кислот) - представляет собой реакции, протекающие в митохондриях, в ходе которых осуществляются катаболизм ацетильных групп и высвобождение водородных эквивалентов. В состав СоА входит витамин — пантотеновая кислота. ЦТК включает в себя 8 стадий (10 реакций): 1) Цикл начинается с взаимодействия молекулы ацетил-СоА с щавелевоуксуснойкислотой (оксалоацетатом), в результате образуется лимонная кислота (цитрат). 2)цитрат превращается в изоцитрат через цис-аконитат. 3)изоцитрат дегидрируется с образование α- кетоглутарата и СО2 4) α- кетоглутарата окисляется до сукцинилСоА и СО2. 5) сукцинилСоА превращается в сукцинат. 6)сукцинат ддегидрируется с образованием фумарата. 7)фумарат дигидрируется с образованием малата. 8)малат дигидрируется с образованием оксалацетата. Значение: Главная функция цикла лимонной кислоты состоит в том, что он является общим конечным путем окисления углеводов, липидов и белков, поскольку в ходе метаболизма глюкоза, жирные кислоты и аминокислоты превращаются либо в ацетил-СоА, либо в промежуточные соединения рассматриваемого цикла. Цикл лимонной кислоты играет также главную роль в процессах глюконеогенеза, переаминирования, дезаминирования и липогенеза. О жизненно важной роли цикла лимонной кислоты свидетельствует и тот факт, что у человека почти неизвестны (или их вообще нет) генетически обусловленные изменения ферментов, катализирующих реакции цикла; вероятно, наличие таких нарушений несовместимо с нормальным развитием.
Схема в 35 вопросе
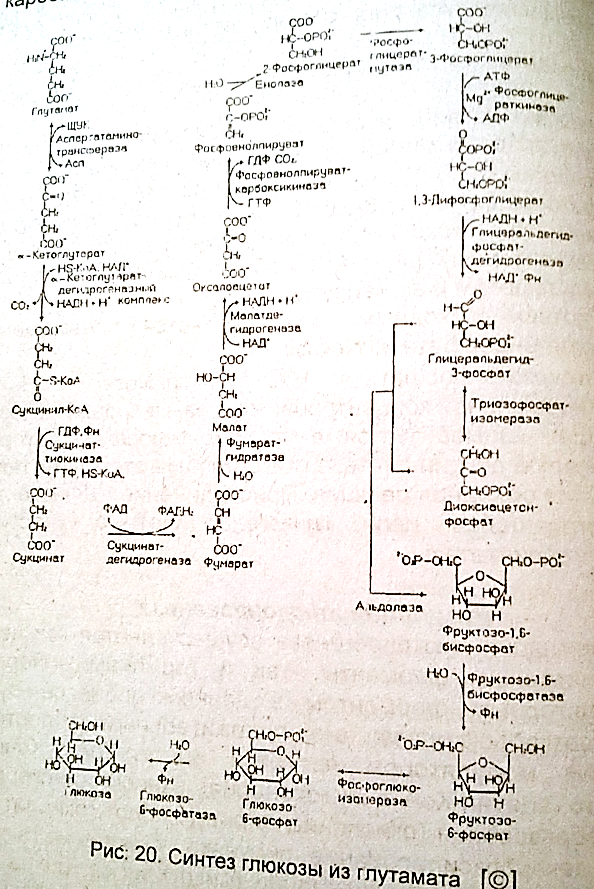
38.. Глюконеогенез из глутаминовой кислоты.
39. Пентозофосфатный цикл: локализация процесса, реакции, ферменты и коферменты, биоэнергетика, регуляция, значение для организма … представляет собой прямое окисление глюкозы и протекает в цитоплазме клеток. Наибольшая активность ферментов пентозофосфатного пути обнаружена в клетках печени, жировой ткани, коры надпочечников, молочной железы в период лактации, зрелых эритроцитах. Низкий уровень этого процесса выявлен в скелетных и сердечной мышцах, мозге, щитовидной железе, легких. Пентозофосфатный путь выполняет в организме две важнейшие метаболические функции: он является главным источником НАДФН для синтеза жирных кислот, холестерола, стероидных гормонов, микросомального окисления; в эритроцитах НАДФН используется для восстановления глутатиона – вещества, препятствующего пероксидному гемолизу; он является главным источником пентоз для синтеза нуклеотидов, нуклеиновых кислот, коферментов (АТФ, НАД, НАДФ, КоА-SН и др.).
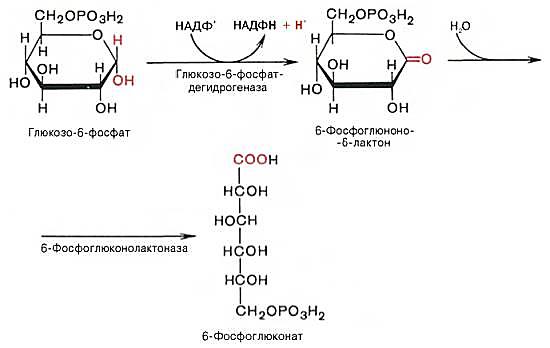
Первой реакцией пентозофосфатного пути является ферментное дегидрирование глюкозо-6-фосфата в глюконолактон-6-фосфат, протекающее с участием НАДФ+ в качестве кофермента. Далее 6-фосфоглюконолактон гидратируется и превращается в 6-фосфоглюконовую кислоту
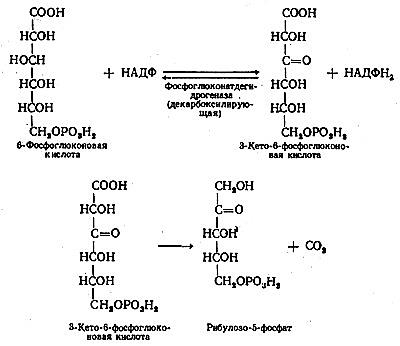
На следующей стадии 6-фосфоглюконат подвергается дегидрированию с участием НАДФ+-6-осфоглюконатдегидрогеназы и образованием 3-кето-6-фосфоглюконовой кислоты и НАДФН(Н+) Образовавшаяся 3-кето-6-фосфоглюконовая кислота декарбоксилируется с образованием D-рибулозо-5-фосфата и СО2. 6 молекул рибулозо-5-фосфата изомеризуется в 4 молекулы ксилулозо-5-фосфата и 2 молекулы рибозо-5-фосфата. В случае высокой потребности в рибозо-5-фосфата реакции пентозофосфатного пути заканчиваются образованием этих метаболитов, а при высокой потребности в НАДФН(Н+) – продолжается далее.
Рибулозо-5-фосфат при участии рибоизомеразы и ксилулозоэмпимеразы превращается в 2 молекулы рибозо-5-фосфата и 4 молекулы ксилулозо-5-фосфата
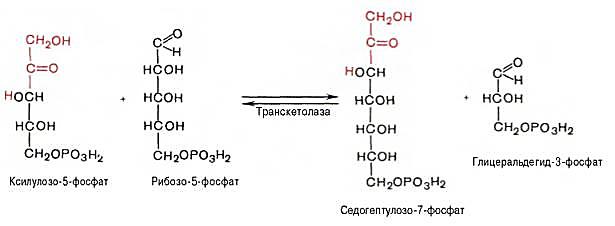
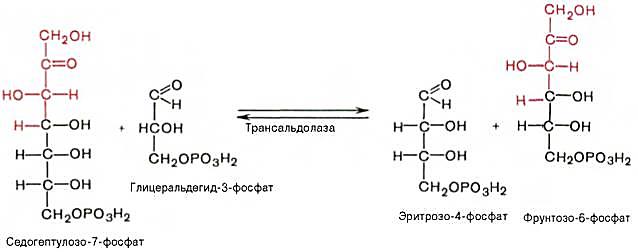
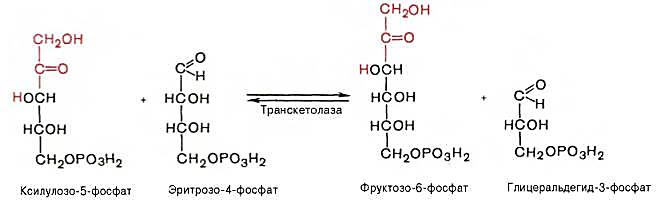
2 молекулы ксилулозо-5-фосфата взаимодействуют с 2 молекулами рибозо-5-фосфата в реакции, катализируемой транкетолазой. Коферментом транскетолазы является тиаминдифосфат. В результате реакций образуются 2 молекулы седогептулозо-7-фосфата, 2 молекулы 3-фосфоглицеральдегида и остается 2 молекулы ксилулозо-5-фосфата
На следующем этапе происходит взаимодействие 2 молекул 3-фосфоглицеральдегида с 2 молекулами седогептулозо-7-фосфатом, что сопровождается образованием 2 молекул эритрозо-4-фосфата и фрутозо6-фосфата.
Оставшиеся 2 молекулы ксилулозо-5-фосфата вступают в транскетолазную реакцию с 2 молекулами эритрозо-4-фосфата, в результате образуются 2 молекулы фруктозо-6-фостфата и 2 молекулы 3-фосфоглицеральдегида
2 молекулы 3-фосфоглицеральдегида с участием альдолазы конденсируется в фруктозо-1,6,-дифосфат. Образовавшиеся 5 молекул фруктозо-6 фосфата изомеризуются в 5 молекул глюкозо-6-фосфата. С глюкозо-6-фосфата начинаются реакции пентозофосфатного пути и поэтому его можно отнести к циклическим путям метаболизма. Из 6 молекул глюкозо-6-фосфата, поступивших в пентозофосфатный цикл, 5 молекул снова регенерируют в это соединение, кроме того, образуются 6 молекул СО2 и 12 НАДФН(Н+).
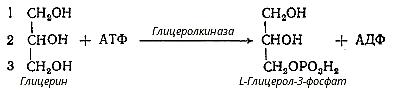
КЛАССИФИКАЦИЯ ЛИПИДОВ. А.Простые липиды: сложные эфиры жирных кислот с различными спиртами. 1. Глицериды представляют собой сложные эфиры трехатомного спирта глицерина и высших жирных кислот. 2. Воска: сложные эфиры высших жирных кислот и одноатомных или двухатомных спиртов. 2. Гликолипиды (гликосфинголипиды). 3. Стероиды. 4. Другие сложные липиды: сульфолипиды, аминолипиды. К этому классу можно отнести и липопротеины. ПИЩЕВАРЕНИЕ ЛИПИДОВ В ЖКТ. В процессах пищеварения все омыляемые липиды (жиры, фосфолипиды, гликолипиды, стериды) подвергаются гидролизу на составные части, стерины же химическим изменениям не подвергаются. В составе липидов пищи преобладают триглицериды. Фосфолипидов, стреинов и других липидов потребляется значительно меньше. У грудных детей и детей младшего возраста основной пищей служит молоко. Молоко содержит жиры, в состав которых входят в основном жирные кислоты с короткой и средней длино цепей.Жиры в составе молока находятся уже в эмульгированном, смешанном с водой виде, поэтому они сразу же доступны для гидролиза ферментами. На жиры молока в желудке детей действует липаза, которая синтезируется в железах языка (липаза языка). Кроме того, в желудке детей грудного и младшего возраста вырабатывается желудочная липаза, которая активна при нейтральном значении рН, характерном для желудочного сока детей, и не активна у взрослых. Эта липаза гидролизует жиры. Далее гидролиз жиров молока продолжается в кишечнике под действием панкреатической липазы. Жирные кислоты с короткой цепью, как водорастворимые, всасываются частично уже в желудке. Остальные жирные кислоты всасываются в тонком кишечнике. Для детей грудного возраста основным источником энергии являются жиры, в то время как у взрослых людей при нормальном питании основным источником энергии служит глюкоза. Желчные кислоты, важнейшая из которых холевая кислота, вырабатываются печенью.имеет важное значение дляпереваривания жиров, которые они эмульгируют. При этом играют роль способность желчных кислот образовывать с жирными кислотами молекулярные соединения. Генетически желчные кислоты связаны с холестерином. Вводя в организм меченый холестерин, констатируют образование меченых желчных кислот Желчные кислоты способствуют эмульгированию пищевых жиров, активируют липазу и, наконец, содействуют всасыванию высших жирных кислот. Поэтому понятно, что прекращение выделения желчи в двенадцатиперстную кишку или уменьшение ее секреции немедленно отражается напереваривании жиров. Расщепление стероидов происходит в кишечнике при участии фермента холинэстеразы, выделяющегося с соком поджелудочной железы. В результате гидролиза стероидов образуются жирные кислоты и холестерин. Фосфолипиды расщепляются полностью или частично под действием гидролитических ферментов - специфических фосфолипаз. Продуктом полного гидролиза фосфолипидов являются: глицерин, высшие жирные кислоты, фосфорная кислота и азотистые основания. Биологическая роль липидов. Липиды играют важнейшую роль в процессах жизнедеятельности. Будучи одним из основных компонентов биологических мембран, липиды влияют на их проницаемость, участвуют в передаче нервного импульса, создании межклеточных контактов. Жир служит в организме весьма эффективным источником энергии либо при непосредственном использовании, либо потенциально – в форме запасов жировой такни. Важная функция липидов – создание термоизоляционных покровов у животных и растений, защита органов и тканей от механических воздействий. Биосинтез триглицеридов Синтез триглицеридов происходит из глицерина и жирных кислот. Путь биосинтеза триглицеридов в тканях протекает через образование глицерол-3-фосфата как промежуточного соединения
В жировой ткани и мышцах очень низкая активность глицеролкиназы, образование глицерол-3-фосфата впонижено (например, при голодании), образуется лишь незначительное количество глицерол-3-фосфата и освободившиеся в ходе липолиза свободные жирные кислоты не могут быть использованы на ресинтез триглицеридов. В процессе гликолитического распада глюкозы образуется диоксиацетонфосфат, который способен превращаться в глицерол-3-фосфат:
В печени же наблюдаются оба пути образования глицерол-3-фосфата. Образовавшийся, тем или иным путем глицерол-3-фосфат ацилируется двумя молекулами КоА-производного жирной кислоты, образуется фосфатидная кислота:
Если идет синтез триглицеридов, то происходит дефосфорилирование фосфатидной кислоты с помощью специфической фосфатазы (фосфатидатфосфатазы) и образование 1,2-диглицерида:
Биосинтез триглицеридов завершается этерификацией образовавшегося 1,2-диглицерида третьей молекулой ацил-КоА:
|
|||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 231; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.131.178 (0.14 с.) |
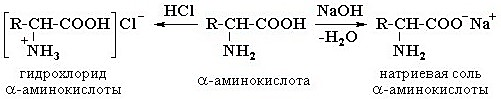

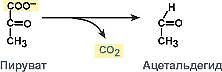 фермент – пируватдекарбоксилаза
фермент – пируватдекарбоксилаза фермент - фосфоглюкомутаза
фермент - фосфоглюкомутаза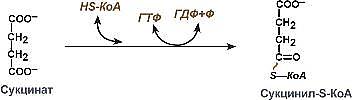 фермент - сукцинил-КоА-синтетаз
фермент - сукцинил-КоА-синтетаз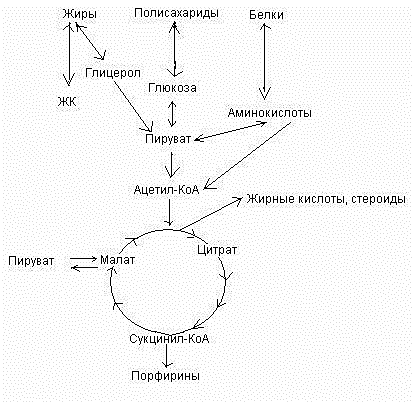
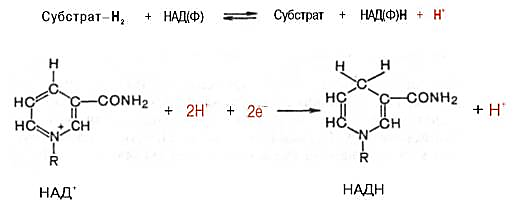
 Во флавиновых коферментах (ФАД или ФМН), активной частью молекул которых является изоаллоксазиновое кольцо, в результате восстановления чаще всего наблюдается присоединение 2 протонов и 2 электронов одновременно
Во флавиновых коферментах (ФАД или ФМН), активной частью молекул которых является изоаллоксазиновое кольцо, в результате восстановления чаще всего наблюдается присоединение 2 протонов и 2 электронов одновременно