Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Структура и функции сложных белков: гликопротеиды, протеогликаны, нуклеопротеиды, фосфопротеиды, липопротеиды, хромопротеиды, металлопротеиды.
Сложные белки содержат два компонента – простой белок и небелковое вещество. Последнее называют простетической группой. Гликопротеины – сложные белки, содержащие, помимо простого белка или пептида, группу гетероолигосахаридов. К типичным гликопротеинам относят большинство белковых гормонов, мембранные сложные белки, все антитела, белки плазмы крови, молока, и др. Функции: обеспечивают клеточную адгезию, молекулярное и клеточное узнавание, антигенную активность опухолевых клеток, оказывают защитное и гормональное, а также антивирусное действие. Химический состав гликопротеинов: к полипептиду присоединяются гетероолигосахаридные цепи, содержащие от 2 до 10, реже 15 мономерных остатков гексоз (галактоза и манноза, реже глюкоза), пентоз (ксилоза, арабиноза) и конечный углевод, чаще всего представленный N-ацетилга-лактозамином, L-фукозой или сиаловой кислотой. Протеогликаны Это ВМС(внуриматричная спираль), состоящие из белка и ГАГ(гликозаминогликаны). Они образуют основное вещество межклеточного матрикса. В матриксе представлены крупные и малые протеогликаны. Крупные: агрекан и версикан. Агрекан - основнойпротеогликан хрящевого матрикса. Функции:Является структурным компонентом межклеточ. матрикса, Необходим для взаимодействия с другим белком межклеточного матрикса,Обеспечивает упругость ткани. 2 типа нуклеопротеинов:– дезоксирибонуклеопротеины (ДНП) и рибонуклеопротеины (РНП). Они осуществляют такие важные процессы как: репликация, транскрипция и трансляция, транспорт нукл.кислот из ядра в клетку. Нуклеопротеиды образуются в результате нековалентных взаимодействий белков и нук. кислот. Фосфопротеиды, содержащие ковалентно связанные остатки фосфорной кислоты(простетическая группа). К фосфопротеидам относятся казеины молока, белки яйца и некоторые тканевые ферменты (фосфорилаза А, гексокиназа и др.), с помощью которых осуществляется перенос фосфатных групп. Большое количество фосфопротеинов содержится в клетках ЦНС. Следует отметить, что фосфопротеины содержат органически связанный, лабильный фосфат, абсолютно необходимый для выполнения клеткой ряда биологических функций. Кроме того, они являются ценным источником энергетического и пластического материала.
Липопротеины. Этот класс сложных белков состоит из белка и простетической группы, представленной каким-либо липидом. Они входят в состав клеточной мембраны и внутриклеточных биомембран ядра, митохондрий, а также присутствуют в свободном состоянии (главным образом в плазме крови). Различают ЛП низкой плотности (ЛПНП), очень низкой плотности (ЛПОНП), высокой плотности (ЛПВП), очень высокой плотности (ЛПОВП) и ЛП промежуточной плотности (ЛППП). Установлено, что липопротеины участвуют в структурной, комплексной организации миелиновых оболочек, нервной ткани, хлоропластов, фоторецепторной и электронно-транспортной систем, палочек и колбочек сетчатки и др.Большинство ЛП синтезируется в печени или в слизистой оболочке кишечника. Хромопротеины состоят из простого белка и связанного с ним окрашенного небелкового компонента. Различают гемопротеины (содержат в качестве простетической группы железо),ифлавопротеины (содержат производные изоаллоксазина). Хромопротеины участвуют в фотосинтез, дыхание клеток и целостного организма, транспорт кислорода и диоксида углерода, окислительно-восстановительные реакции, свето-и цветовосприятие и др. К группе гемопротеинов относятся гемоглобин и его производные.Гемоглобин в качестве белкового компонента содержит глобин, а небелкового – гем. Флавопротеины содержат прочно связанные с белком простетические группы, представленные изоаллоксазиновыми производными – окисленными флавинмононуклеотидом (ФМН) и флавинадениндинуклеотидом (ФАД). Флавопротеины входят в состав оксидоредуктаз – ферментов, катализирующих окислительно-восстановительные реакции в клетке. Типичными представителями флавопротеинов, являются ксантин-оксидаза, альдегидоксидаза, ацил-КоА-дегидрогеназа. К металлопротеинам относятся биополимеры, содержащие, помимо белка, ионы какого-либо одного металла или нескольких металлов. К таким белкам принадлежат, например, белки, содержащие негемовое железо, а также белки связанные с атомами металлов в составе сложных белков-ферментов. Типичными представителями первых являются железосодержащие белки ферритин(в селезенке, печени, костном мозге, выполняя роль депо железа в организме.), трансферрин(в сыворотке крови, служит физиологическим переносчиком железа в организме.) и гемосидерин(в ретикулоэндотелиоцитах печени и селезенки.).
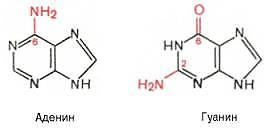
Ко второй группе металлопротеинов относится ряд ферментов: ферменты, содержащие связанные с молекулой белкаионы металлов, определяющих их функцию(металлоферменты). 14.Структура и функция азотистых оснований, нуклеозидов, нуклеотидов. Участие в регуляции метаболизма (вторичные месенджеры цГМФ, цАМФ) коферментнАЯ функция, обеспечение энергией (нуклеозид 3 фосфаты) образование активных форм соединений. Азотистые основания —это ароматические гетероциклические соединения, производные пиримидина или пурина. Азотистые основания выполняет в клетке метаболическую функцию, т.е. входят в состав нуклеозидов. Пуриновые азотистые основания: Пирамидиновые азотистые основания:
Нуклеозиды.Соединения азотистых оснований с рибозой или 2-дезоксирибозой носят название нуклеозиды. Нуклеозиды выполняют только метаболическую функцию, входят в состав нуклеотидов. Нуклеозиды делятся на: Пиримидиновые: А) рибонуклеозиды, например: уридин, цитидин, тимидин. В) дезоксирибонуклеозиды, например: дезокситимидин, дезоксицитидин, дезоксиурацидин. Пуриновые: А) рибонуклеозиды, например: аденазин, гуанозин. В) дезоксирибонуклеозиды, например: дезоксиаденазин, дезоксигуанозин. Нуклеотиды образуются из нуклеозидов за счет образования фосфоэфирной связи между фосфатным остатком и 5’ гидроксильной группы. К нуклеозиду может присоединится от 1 до 3 фосфатных остатков(нуклеозидмонофосфат,дифосфат,трифосфат). При расщеплении одной фосфатной группы выделяется 36,36 кДж энергии. Функции1. метаболическая – нуклеотиды входят в состав нуклеиновых кислот.2. энергетическая – в качестве источника энергии используются НТФ и в частности АТФ и ГТФ, т.к. они содержат макроэргические связи3. регуляторная цАМФ наделен рядом уникальных функций и высокой биологической активностью в регуляции процессов обмена, выполняя роль медиатора внеклеточных сигналов в клетках животных. Аналогичной функцией наделены цГМФ.(например: Когда предстоит большая физическая работа, организм мобилизует ресурсы, вырабатывая адреналин. Адреналин разносится по организму и взаимодействует с соответствующими рецепторами на мышечных клетках. Это приводит к серии процессов, происходящих на мембране клетки, которые заканчиваются активацией аденилатциклазы и синтезом одного из главных внутриклеточных гормонов (вторичных мессенджеров) - циклического аденозинмонофосфата (цАМФ). Циклический АМФ, в свою очередь, активирует цАМФ-зависимую протеинкиназу. Этот фермент фосфорилирует несколько ферментов в клетке, обеспечивая координацию разных процессов, связанных с метаболизмом гликогена.) кофермент А (КоА-производное вит.В3) Буква А означаетосновную функцию этого кофермента - перенос ацильных групп. Атомы водорода передаются на вторичные дегидрогеназы, флавопротеиды, коферментом которых служит ФАД(производное вит В2). Основная функция флавопротеидов в цепи тканевого дыхания — перенос водорода. НАД(производное витВ5)функции которого состоят в переносе водорода.
НАДФ кофермент многих оксидоредуктаз, выполняющий функцию переносчика электронов и протонов. ФАФС, активированная форма серной кислоты. Участник универсальной системы детоксикации. Активной формой метионина является S-аденозилметионин SAM.Отдает метильные группы при синтезе адреналина,кератина. Аминоациладенилат представляет собой активированную аминокислоту. Активированная аминокислота в виде аминоациладенилата вступает под влиянием специального фермента во взаимодействие с находящейся в цитоплазме транспортной РНК.дЛя каждой аминокислоты совят РНК. 15.Структура и функция тРНК, иРНК, рРНК. Транскрипция, процессинг и сплайсинг мРНК. Структура и функции тРНК,иРНК,рРНК Транспортная РНК, тРНК — рибонуклеиновая кислота, функцией которой является транспортировка аминокислот к месту синтеза белка. Имеет типичную длину от 73 до 93 нуклеотидов и размеры около 5 нм.тРНК также принимают непосредственное участие в наращивании полипептидной цепи, присоединяясь — будучи в комплексе с аминокислотой — к кодону мРНК и обеспечивая необходимую для образования новой пептидной связи конформацию комплекса. Матричная рибонуклеиновая кислота (иРНК) — РНК, содержа информ о первичной структуре (аминокислотной последовательности) белков.иРНК синтезна основе ДНК в ходе транскрипции, после чего, используется в ходе трансляции как матрица для синтеза белков. Тем самым иРНК играет важную роль в «проявлении» (экспрессии) генов. Рибосомные рибонуклеиновые кисло́ты (рРНК) — несколько молекул РНК, составляющих основу рибосомы. Основной функцией рРНК является осуществление процесса трансляции — считывания информации с мРНК при помощи адапторных молекул тРНК и катализ образов пептидных связей м/у присоед. к тРНК аминокислотами. Транскрипция – генетич информ, содерж в неклеотидной последоват молекул РНК, переводится в аминокислотную последовательность белка. Процессинг – созревание мРНК. 1)кэпирование – химич модификация 5-концевой последоват мРНК 2) Сплайсинг – удаление некодирующихс экзонов 3)полиаденилирование – химич модиикация 3-концевой последоват мРНК Транскрипция - первая стадия реализации генетической информации в клетке. В ходе процесса образуются молекулы мРНК, служащие матрицей для синтеза белков, а также транспортные, рибосомальные и другие виды молекул РНК, выполняющие структурные, адапторные и каталитические функции
Процессинг мРНК включает: вырезание неинформативных участков – интронов (рисунок 8.2, в); сращивание (сплайсинг) информативных участков – экзонов (рисунок 8.2, г); защиту концевых участков от действия нуклеаз (рисунок 8.2, д): присоединение 7-метилгуанилата («колпачок») к 5’-концу 5’,5’- фосфодиэфирной связью; присоединение полиаденилового нуклеотида к 3’-концу. Образующаяся мРНК поступает из ядра в цитоплазму клеток. 16. Структура и функция ДНК. Физико-химические свойства (вязкость, температура плавления, поглощение УФ, заряд, пространственная организация). Репликация ДНК, формирование нуклеосом и хроматина. ОТВЕТ: Структура и функция ДНК служит универсальным хранителем и источником наследственной информации, записанной в виде специальной последовательности нуклеотидов и определяющей свойства живого организма.молекулярная масса от 107 до 109, а число нуклеотидных остатков в молекуле достигает нескольких сотен тысяч и даже миллионов. В ДНК содержится аденин, гуанин, цитозин и тимин. Молекула ДНК состоит из двух полинуклеотидных цепей, закрученных вправо вокруг одной и той же оси образуя двойную спираль. В силу пространственного соответствия структур двух молекул соединяться водородными связями могут лишь аденин с тимином и наоборот, а также гуанин с цитозином и наоборот. Причем между аденином и тимином образуются две вородные связи, а между гуанином и цитозином – три. Растворы ДНК характер аномальной вязкостью объясняющ удлиненной формой мол, и в потоке обладают двойн, лучепреломлением. УФ излуч не поглощается основными цепочками ДНК, а только пуреиновыми и пиримидиновыми основаниями, благодаря заряду фосфатных гр ДНК имеет заряд «-». Репликация – осуществл по полуконсервативному механизму, процесс реплкации требует дезоксирибонуклеотид 3 фосфат, различных ферменов и аденозин 3 фосфорную к-ту. Задача репликации – снять суперсперелизацию ф-т хиликаза – разрыв связи. Нуклеосомы формир в результате взаимод 4х классов основных белков гистонов H2A, H2B, H3, H4, причем мол 2х последн гистонов могут формиров тетрамер, к к-му присоед 2 димера H2A, H2B. Структуру хроматина формир элементарн фибрилла диаметр 10нм. Для нее известн 4 уровня укладки в более сложные структуры. «регулярная спираль» и «бусы на нитке» Простые и сложные ферменты, зимогены, изоферменты. Замена эмриональных ферментов из ферментов взрослого человека после рождения. Строение и функции активных и аллостерических центров фермента. Факторы определяющие каталитическую активность ферментов. Ферменты являются белками, и поэтому подобно белкам делятся на простые и сложные. Простые ферменты состоят только из аминокислот. Сложные ферменты (холоферменты) имеют в своем составе белковую часть, состоящую из аминоксилот –апофермент, и небелковую часть-кофактор. Кофактор может называться коферментом или простетической группой. Пример: аминотрансферазы (содержат пиридоксальфосфат), пероксидаза (содержит гемм).
Изоферменты – это молекулярные формы одного и того же фермента, возникшие в результате неольших генетических различий в первичной структуре фермента. Различные ферменты определяют скорость и направление реакции. Примером фермента, имеющего изоферменты,является амилаза — панкреатическая амилаза отличается по аминокислотной последовательности и свойствам от амилазы слюнных желёз, кишечника и других органов. Проферменты, или проэнзимы, зимогены, — функционально неактивные предшественники ферментов, подвергающиеся тем или иным преобразованиям, в результате чего образуется каталитически активный продукт — фермент. К ним относятся пепсиноген, активной формой которого является пепсин, трипсиноген — трипсин, химотрипсиноген — химотрипсин, и др. Строение: В составе фермента выделяют области, с разными функциями. 1.Активный центр-комбинация аминокислотных остатков(16-20), обеспечивающая связывание с молекулом субстрата и обеспечивающая катализ. В активном центре выделяют два участка: якорный (связывающий)- отвечает за связывание и ориентацию субстрата в активном центре, каталитический - отвечает за осуществление реакции. У ферментов, имеющих в своем составе несколько мономеров, м.б. несколько активных центров. 2.Аллостерический центр- центр регуляции активности фермента, который пространственно отделен от активного центра и есть не у всех ферментов. Связывание с аллостерическим центром какой-либо молекулы вызывает изменение конфигурации белка-фермента, а значит и скорости ферментативной реакции. Факторы: Различные химические соединения, связываясь с ферментами, могут изменять скорость катализируемых ферментами реакций. На каталитическую активность ферментов влияют и многие другие факторы, которые могут изменять строение или химическую природу ферментов. К числу таких факторов относятся: 1. рН. 2.темпер.3. Силы, действующие в текучих средах (гидродинамические силы, гидростатическое давление и поверхностное натяжение) 4. Химические агенты (спирт, мочевина или пероксид водорода)5. Облучение (свет, звук, ионизирующая радиация) Иногда снижение каталитической активности, вызванное, например изменением рН, обратимо. В таких случаях возврат к первоначальным условиям сопровождается восстановлением активности фермента. Специфичность действия ферментов (абсолютная, относительная). Зависимость скорости ферментативных реакций от концентрации субстрата и фермента, температуры,РН. Ингибирование и активирование ферментов – биомедицинские ферменты. Специфичность - очень высокая избирательность ферментов по отношению к субстрату. Специфичность фермента объясняется совпадением пространственной конфигурации субстрата и субстратного центра. За специфичность фермента ответственен как активный центр фермента, так и вся его белковая молекула. Активный центр фермента определяет тип реакции, который может осуществить данный фермент. Различают три вида специфичности: абсолютную, относительную, стереохимическую. Абсолютная специфичность. Такой специфичностью обладают ферменты, которые действуют только на один субстрат. Например, сахараза гидролизует только сахарозу, лактаза - лактозу, мальтаза - мальтозу, уреаза - мочевину, аргиназа - аргинин и т.д. Зависимость: От концентрации субстрата и фермента: -При увеличении кол-ва молекул фермента скорость реакции возрастает непрерывно и прямо пропорц-но кол-ву фермента. -При увеличении концентрации субстрата скорость реакции сначала возрастает соответственно подключению к реакции новых молекул ферм-та, затем наблюдается эффект насыщения, когда все молекулы фермента взаимодействуют с молекулами субстрата. При дальнейшей увеличении скорости субстрата м/у его молекулами возникает конкуренция за акт.центр. и скорость реакции снижается. Зависимость от РН: Описывается колоколообразной кривой, с макс. Скорости при оптимальном РН для этого фермента.(называется РН –оптимумом). Значения рН-оптимума для различных ферментов колеблются в широких пределах. Н-р: у пепсина 1,5-2; у трипсина 8-8,5 Зависимость от температуры: Описывается колоколообразной кривой, с оптимальным знач. температуры для данного фермента. Закон о повышении скор.реакции в 2-4 раза при повышении температуры на 10град справедлив для фермент. реакций, но только до 50-60град. При понижении ферментов активность ферментов снижается, но не исчезает совсем. Ингибирование На скорость химической реакции влияют различные вещества. Те из них, которые тормозят ферментативные процессы, называются ингибиторами. Те же, которые усиливают реакции - активаторами.
|
|||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 298; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.202.54 (0.038 с.) |
 :
: