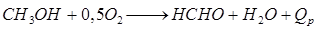Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Синтез на основе окиси углерода .
Органический синтез на основе окиси углерода широко применяется в промышленности. Из окиси углерода получают алифатические углеводороды, спирты, альдегиды, карбоновые кислоты и их производные. Метиловый спирт CH3OH – токсичная жидкость, плотностью 796 кг/м3, которая смешивается с водой в любых соотношениях температура кипения 64,7°С. Метиловый спирт в настоящее время в основном получают из оксида углерода (II) и водорода при температуре 230-420°С и давлении 20-32 МПа. Физико-химические основы процесса. Синтез метанола основан на обратимых реакциях, описываемых уравнениями:
Обе реакции экзотермичны и протекают с уменьшением объема. Из этого следует, что для достижения максимальных значений выхода метанола и степени превращения синтез-газа необходимо проведение процесса при низких температурах и высоких давлениях. Максимально достижимая степень превращения синтез-газа при этом ограничена условиями равновесия реакций получения метанола, которые изучены экспериментально и теоретически. Для расчета константы равновесия реакции
Константу равновесия реакции
При этом
Для ускорения целевой реакции – получения метанола на практике применяют твердые катализаторы: цинк-хромовые или медьсодержащие катализаторы. Катализаторы синтеза метанола весьма чувствительны к каталитическим ядам, поэтому первой стадией процесса является очистка газа от сернистых соединений. Сернистые соединения отравляют цинк-хромовые катализаторы обратимо, а медьсодержащие – необратимо. Для описания скорости синтеза метанола на цинк-хромовом катализаторе (процесс изучался во взвешенном слое и лимитирующей стадией принималась адсорбция водорода) может быть описана уравнением:
где k 1 и k 2 – константы скорости прямой и обратной реакции; р - парциальное давление. Для расчета скорости на медь-цинк-алюминиевом катализаторе применимо уравнение:
где k 1 – константы скорости прямой реакции; К – константа равновесия. Константа скорости k 1 в уравнении (5.21) может быть рассчитана по формуле:
Интервал оптимальных температур, соответствующих наибольшему выходу продукта, определяется активностью катализатора, объемной скоростью газовой смеси и давлением. Процессы низкого давления (5-10 МПа) на медьсодержащих катализаторах осуществляют при температурах 220-280°С. Для цинк-хромового катализатора характерны более высокие давления (20-30 МПа) и температуры (350-400°С). Влияние давления на синтез метанола иллюстрируется рис. 6.19. Максимальное давление, применяемое в промышленных синтезах, составляет 40 МПа; выше этого давления ускоряются побочные реакции и, кроме того, увеличение затрат на компрессию газа ухудшает экономические показатели процесса. В синтезах низкого давления повышение давления ограничено термической стабильностью медных катализаторов. С возрастанием объемной скорости газа выход метанола падает. Это справедливо для синтеза как при высоком, так и при низком давлении. Такая закономерность основана на том, что с увеличением объемной скорости уменьшается время контакта газа с катализатором и, следовательно, концентрация метанола в газе, выходящем из реактора.
На рис. 6.20 показана зависимость производительности катализатора при 30 МПа от объемной скорости. С увеличением объемной скорости подачи сырья содержание метанола в газе снижается, однако за счет большего объема газа, проходящего в единицу времени через тот же объем катализатора, производительность последнего увеличивается. На практике процесс синтеза осуществляют при объемных скоростях 20 000 – 40 000 ч-1. Степень превращения синтез-газа в метанол (а, следовательно, и его выход) за один проход через реактор ограничена положением равновесия реакции
Технологическое оформление процесса синтеза метанола. На рис. 6.21 показана схема синтеза метилового спирта из СО и H2. Газовая смесь в соотношении H2:СО = 4:1 (применяют и другие соотношения) сжимается в компрессоре до 25 МПа, смешивается в смесителе 2 с непрореагировавшим циркуляционным газом, нагреваемым компрессором 9, и поступает в фильтр 3, где очищается от масла; затем в теплообменнике 4 смесь нагревается до 200°С и направляется в колонну синтеза метанола 5. На выходе из нее смесь поступает в межтрубное пространство теплообменника 4, охлаждается, нагревая смесь, поступающую на синтез. Такая организация процесса позволяет вести процесс автотермично.
1 – компрессор; 2 – смеситель; 3 – фильтр; 4 – теплообменник; 5 – колонна синтеза; 6 – холодильник-конденсатор; 7 – сепаратор; 8 – сборник; 9 – циркуляционный компрессор. Из теплообменника 4 газовая смесь, содержащая пары метанола, поступает в водяной холодильник 6, а затем в сепаратор 7, где жидкий метанол отделяется от непрореагировавшего газа; последний направляется циркуляционным компрессором 9 в смеситель 2. Метиловый спирт – сырец из сепаратора сливается в сборник 8 и направляется на ректификацию для очистки от различных органических веществ. После ректификации спирта-сырца выход чистого метанола составляет 84-87%. Чистый метанол используется для получения формальдегида (около 50%), метилметакрилата, и в качестве растворителя и экстрагента. Формальдегид – альдегид муравьиной кислоты, бесцветный газ с резким раздражающим запахом, имеет температуру конденсации - 19°С при атмосферном давлении. Он хорошо растворим в воде, 33-40%-ный водный раствор формальдегида называется формалином. Водный раствор формальдегида при хранении может полимеризоваться, во избежание этого в его состав вводят в качестве стабилизатора 7-12%(масс.) метилового спирта. Формальдегид широко используется для получения фенол-, карбамидо- и меламино-формальдегидных смол, полиформальдегида, изопрена и уротропина. Наиболее распространенным способом получения формальдегида является окислительное дегидрирование метанола в течение 0,01-0,03 сек. в присутствии катализатора при 500-600°С.
Наряду с основной реакцией протекают побочные процессы окисления, дегидрирования и гидрирования до образования окиси и двуокиси углерода и других продуктов. В качестве катализатора применяется медь или серебро в виде сеток, либо осажденных на пористом носителе, например, на пемзе. Схема получения формальдегида изображена на рис. 6.22. Метанол, содержащий 10-12% воды, из сборника 1 непрерывно поступает в испаритель-подогреватель 2. Суда же воздуходувкой 10 подается очищенный в фильтре воздух, который барботирует через слой метанола и насыщается его парами. Для нормальной работы в испарительной системе поддерживается постоянные уровень жидкости и температура (48-50°С). Образовавшаяся паровоздушная смесь нагревается до 110°С в верхней части аппарата 2 и поступает в контактный аппарат 3 с катализатором 4. Проходя через катализатор, метиловый спирт окисляется, с образованием формальдегида 80-85% при степени конверсии метанола 85%.
Выходящие из контактного аппарата газы содержат 20-22% НСНО, 36-38% N2, CH3OH, H2, CO, CO2, CH4 и др. В холодильнике 5 и 8 они охлаждаются и поступают в поглотительную башню 6, орошаемую водой и снабженную трубчатым холодильником 7. Из поглотительной башни 6 выводится водный 33-40%-ный раствор формальдегида, содержащий 10-12% CH3OH; газы, состоящие в основном из азота и водорода, выбрасываются в атмосферу.
Рис. 6.22. Схема производства формальдегида: 1 – сборник; 2 – испаритель-подогреватель; 3 – контактный аппарат; 4 – катализатор; 5, 8 – холодильник; 6 – абсорбер; 7 – трубчатый холодильник; 9 – фильтр; 10 – воздуходувка.
Формальдегид получают так же частичным окислением метана. Этот процесс проводят в присутствии катализатора (смесь фосфата алюминия и окиси меди) при температуре 460°С. При окислении метана образуются помимо формальдегида и другие продукты реакции, например, HCOOH, CO2, CO, H2, поэтому из реакционной смеси формальдегид выделяют конденсацией или поглощением водой с последующим его выделением.
|
|||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 122; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.23.127.197 (0.008 с.) |

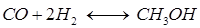 получено уравнение
получено уравнение
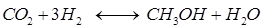 можно рассчитать, исходя из значений константы равновесия первой реакции, а также используя константу равновесия реакции, которая сопровождает образование метанола:
можно рассчитать, исходя из значений константы равновесия первой реакции, а также используя константу равновесия реакции, которая сопровождает образование метанола: .
. . Такой метод расчета констант равновесия в данном случае применим, так как второе уравнение можно получить, вычтя из первого уравнения третье уравнение. При этом, выбирая оптимальный температурный режим, следует учитывать образование побочных соединений: метана, высших спиртов, кислот, альдегидов, кетонов и эфиров:
. Такой метод расчета констант равновесия в данном случае применим, так как второе уравнение можно получить, вычтя из первого уравнения третье уравнение. При этом, выбирая оптимальный температурный режим, следует учитывать образование побочных соединений: метана, высших спиртов, кислот, альдегидов, кетонов и эфиров:
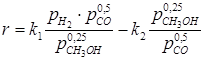 ,
,
 ,
,
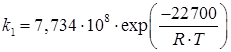 .
.
 Рис. 6.19. Зависимость выхода метанола от давления при 350°С и молярном соотношении H2:CO = 2:1
Рис. 6.19. Зависимость выхода метанола от давления при 350°С и молярном соотношении H2:CO = 2:1
 Рис. 6.20. Зависимость производительности катализатора при 30 МПа от объемной скорости
Рис. 6.20. Зависимость производительности катализатора при 30 МПа от объемной скорости
 и допустимым перепадом температуры по слою катализатора при адиабатическом режиме процесса. Степень превращения СО за проход составляет 15-50%, при этом в контактных газах содержатся только ~4% СН3ОН. С целью возможно более полной переработки синтез-газа его необходимо возвращать в рецикл после выделения метанола и воды. Однако при циркуляции синтез-газа накапливаются инертные примеси (СН4, N2, Ar) и их концентрацию регулируют частичной отдувкой газа.
и допустимым перепадом температуры по слою катализатора при адиабатическом режиме процесса. Степень превращения СО за проход составляет 15-50%, при этом в контактных газах содержатся только ~4% СН3ОН. С целью возможно более полной переработки синтез-газа его необходимо возвращать в рецикл после выделения метанола и воды. Однако при циркуляции синтез-газа накапливаются инертные примеси (СН4, N2, Ar) и их концентрацию регулируют частичной отдувкой газа. Рис. 6.21. Схема синтеза метилового спирта:
Рис. 6.21. Схема синтеза метилового спирта: