
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Математическое выражение первого закона термодинамики в условиях расширенной открытой термодинамической системы.
Т.к. термическая энергия расширенной открытой термодинамической системы определяется понятием энтальпии, уравнение энергетического баланса 2.12 можно переписать в виде: По существу, уравнение 2.12(а) уже является математическим выражением 1го закона термодинамики для открытой расширенной термодинамической системы. С учетом (2.11а) окончательно можно записать: q = (i2 - i1 ) + l ¢ = D i + l’ [Дж/кг], (2.13) Q = D I +L ¢ [Дж]. (2.13(а)) Теплота Q, сообщаемая извне открытой расширенной термодинамической системе, расходуется на изменение энтальпии системы I и совершение располагаемой работы L’. В дифференциальной форме для элементарного обратимого процесса уравнение 2.13, с учетом, что d l= -vdp, запишется в виде: Входящая в уравнение 2.14 удельная энтальпия, также как и удельная внутренняя энергия, является параметром состояния рабочего тела, а следовательно, может быть представлена как функция любых двух других параметров состояния: i=f1(p,v)= f2(v,T)=f3(p,T). Принимая за основу функцию i=f3(p,T) и учитывая что изменение энтальпии в элементарном обратимом процессе является полным дифференциалом можно записать: На основании опытов Томпсона установлено, что для идеального газа энтальпия является функцией только от температуры и независит от удельного объема и давления, т.е. (¶ i / ¶ v)T= 0 и (¶ i / ¶ p)T= 0 а значит, для идеального газа уравнение 2.15 примет вид: Для выяснения физического смысла производной (¶ i / ¶ T)p= 0 рассмотрим частный случай термодинамического процесса, протекающего в открытой термодинамической системе при p =const Þ dp =0. При данных условиях в системе не совершается располагаемой работы (d l’=0). Поэтому математическое выражение первого закона термодинамики для открытой системы принимает вид
Получили, что в соответствии с определением теплоемкости, рассматриваемая частная производная есть ничто иное как удельная массовая изобарная теплоемкость газа cp [Дж/кг×К].
Изменение удельной энтальпии идеального газа в элементарном термодинамическом процессе, протекающем в открытой т.д.с., определится как: Для любого конечного термодинамического процесса, при условии, что cp=const, конечное изменение удельной энтальпии рабочего тела определится интегрированием уравнения 2.16:
а в случае если cp= f(T) как: Дифференциальная форма уравнения 1ого закона термодинамики для идеального газа, находящегося в условия открытой расширенной термодинамической системы, примет вид: Полученные две формы математического выражения первого закона термодинамики для закрытой (2.5) и открытой (2.14) термодинамических систем являются равнозначными:
Не будет ошибкой, если для исследований процессов в потоке рабочего тела применить уравнение d q=du+pdv. В этом случае надо лишь иметь в виду, что наблюдатель, проводящий исследование, не стоит на месте, а перемещается вместе с потоком рабочего тела (положение “А”, рис. 2.9). Если же наблюдатель стоит неподвижно (положение “Б”, рис.2.9), то для исследований термодинамических процессов, протекающих в потоке газа необходимо пользоваться математическим выражением первого закона термодинамики для открытой системы d q=di-vdp.
|
|||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 99; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.190.159.10 (0.006 с.) |
 . (2.12(а))
. (2.12(а)) . (2.14)
. (2.14) . (2.15)
. (2.15)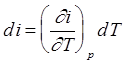 . (2.15(а))
. (2.15(а)) .
.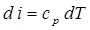 . (2.16)
. (2.16) , [Дж/кг],
, [Дж/кг], , [Дж/кг], где
, [Дж/кг], где 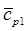 и
и  - средние удельные теплоемкости газа для интервалов температур от 0 °С до t1 и от 0 °С до t2. Если в термодинамическом процессе участвует произвольная масса газа, то изменение полной энтальпии рабочего тела определится как: D I= D i × G [Дж].
- средние удельные теплоемкости газа для интервалов температур от 0 °С до t1 и от 0 °С до t2. Если в термодинамическом процессе участвует произвольная масса газа, то изменение полной энтальпии рабочего тела определится как: D I= D i × G [Дж].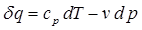 . (2.17)
. (2.17) .
.



