
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Закрытая система. Внутренняя энергия. Работа расширения обратимого процесса.
Закрытой называется термодинамическая система, через границы которой может передаваться работа и теплота, однако само рабочее тело системы не пересекает ее границ. Моделью закрытой т.д.с. является газ, заключенный в газонепроницаемую эластичную оболочку (рис. 2.1). Энергия закрытой системы обусловлена исключительно внутренним (тепловым) состоянием рабочего тела, и поэтому она отождествляется с понятием внутренняя энергия. Полная внутренняя энергия (U [ Дж]) любой системы тел представляет сумму трех видов энергии: U = термическая + химическая + ядерная. Химическая энергия обусловлена внутримолекулярным состоянием вещества и проявляется при различных химических реакциях (горение топлива, разбавление спирта водой) в виде теплового эффекта. Ядерная энергия обусловлена внутриядерным взаимодействием элементарных частиц. В дальнейшем, в курсе, будут рассматриваться термодинамические процессы не сопровождающиеся химическими реакциями и расщеплением атомов вещества. Поэтому величинами химической и ядерной энергии можно будет пренебречь, а понятие внутренняя энергия отождествить с понятием термическая энергия. В технической термодинамике под внутренней энергией понимают термическую энергию рабочего тела. Она представляет собой сумму внутренней кинетической энергии движения молекул Uк=f(T) и внутренней потенциальной энергии взаимодействия молекул Uп=f(p,T). В идеальном газе взаимодействия молекул отсутствуют, поэтому Uп=0 и внутренняя энергия U=Uк. Внутренняя энергия, отнесенная к единице массы рабочего тела называется удельной внутренней энергией (u [ кДж/кг]):
Удельная внутренняя энергия закрытой термодинамической системы является функцией состояния (зависит только от p, v, T) и поэтому однозначно определяется любыми двумя параметрами состояния: u= f1(T, v); u= f2(p, v); u= f3(p, T) ].
При проведения термодинамических исследований интерес представляет не абсолютное значение внутренней энергии рабочего тела, а ее изменение в ходе термодинамического процесса. Например, переход рабочего тела из состояния 1 в состояние 2 может проходить по процессам a, b или c (рис. 2.2), но при этом изменение внутренней энергии будет одним и тем же:
Работа в закрытой термодинамической системе может осуществляться только за счет изменения объема рабочего тела (расши-рение или сжатие), поэтому она носит название работа расширения.
Предположим, что 1 килограмм рабочего тела в условиях закрытой термодинамической системы находится под поршнем и характеризуется давлением рi (рис. 2.3). Если pi>pa на бесконечно малую величину, то газ начнет расширяться и, преодолевая силу внешнего давления pa , двигать поршень. При данных условиях процесс расширения будет протекать очень медленно, без трения и вихреобразования внутри газа, что позволяет считать его обратимым. Обратимость процесса обеспечивает выполнение в нем максимально возможной работы. При перемещении поршня на элементарный отрезок d n газ совершит элементарный процесс a-b и при этом его удельный объем изменится на величину (рис. 2.4):
Совершаемая при этом элементарная работа расширения определится как произведение силы (p × F) на перемещение (d n): На p-v диаграмме элементарная работа расширения изобразится фигурой a - b - dv (рис. 2.4). Знак работы расширения определяется знаком изменения удельного объема: dv > 0 (расширение) Þ d l > 0; dv < 0 (сжатие) Þ d l < 0. Удельная работа расширения в конечном процессе определится интегрированием: Если в термодинамическом процессе участвует G килограммов рабочего тела, то полная работа расширения определится как:
|
|||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 89; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.228.88 (0.004 с.) |

 [Дж/кг].
[Дж/кг].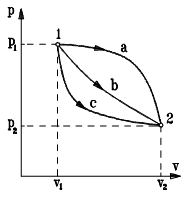
 .
.
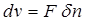 , где F - площадь поршня.
, где F - площадь поршня.
 , [Дж/кг]. (2.2)
, [Дж/кг]. (2.2) , [Дж/кг]. (2.3)
, [Дж/кг]. (2.3)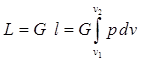 , [Дж].
, [Дж].


