Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гбоу дпо «пензенский институтСтр 1 из 9Следующая ⇒
ГБОУ ДПО «Пензенский институт усовершенствования врачей» Министерства здравоохранения и социального развития Российской Федерации Кафедра клинической лабораторной диагностики Кулюцина Е.Р., Левашова О.А., Рыжкина Л.Л.
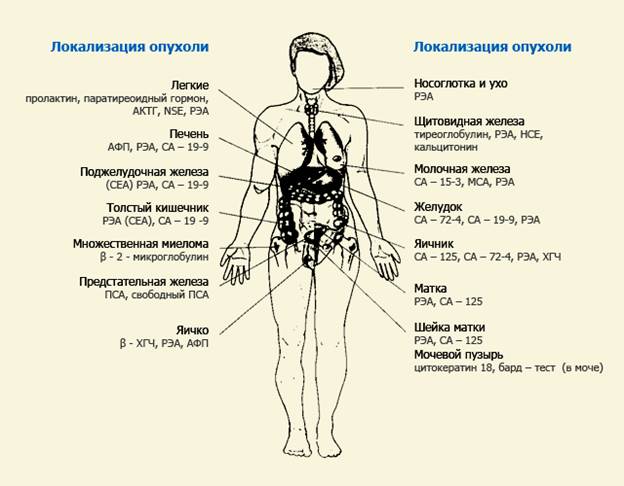
Онкомаркеры Учебное пособие
ПЕНЗА, 2011
УДК 616-006-07 ББК 55.6 К 90
Онкомаркеры. Учебное пособие. / Кулюцина Е.Р., Левашова О.А., Рыжкина Л.Л. – 2011. - 54 с.
В учебном пособии рассмотрены вопросы лабораторной диагностики онкологических заболеваний, понятия «опухолевых маркеров» (ОМ), даны основные характеристики ОМ и классификации, а также основные аспекты диагностики, прогноза, мониторинга и контроля эффективности терапии злокачественных новообразований. Рекомендации предназначены для врачей-онкологов, хирургов, врачей общей практики, врачей-лаборантов. Сведения об авторах: Кулюцина Елена Романовна – кандидат медицинских наук, заведующая кафедрой клинической лабораторной диагностики ГБОУ ДПО ПИУВ Минздравсоцразвития России; Левашова Ольга Анатольевна – кандидат биологических наук, старший научный сотрудник Центральной научно-исследовательской лаборатории диагностики ГБОУ ДПО ПИУВ Минздравсоцразвития России; Рыжкина Людмила Леонидовна – врач высшей квалификационной категории Централизованной цитологической лаборатории Государственного бюджетного учреждения здравоохранения «Областной онкологический диспансер», ассистент кафедры клинической лабораторной диагностики ГБОУ ДПО ПИУВ Минздравсоцразвития России.
Рецензенты: Чичеватов Д.А. – доктор медицинских наук, заведующий кафедрой онкологии Государственного бюджетного образовательного учреждения дополнительного профессионального образования «Пензенский институт усовершенствования врачей» Министерства по здравоохранению и социальному развитию. Зимин Ю.И. – врач-онколог высшей квалификационной категории отделения абдоминальной хирургии ГБУЗ «Областной онкологический диспансер», кандидат медицинских наук, ассистент кафедры онкологии Государственного бюджетного образовательного учреждения дополнительного профессионального образования «Пензенский институт усовершенствования врачей» Министерства по здравоохранению и социальному развитию.
Утверждено Ученым Советом диагностики ГБОУ ДПО ПИУВ Минздравсоцразвития России
Протокол № 9 от 22 ноября 2011 г.
СОДЕРЖАНИЕ ВВЕДЕНИЕ............................................................................................................................................................................................ 5 Общая характеристика ОМ.............................................................................................................................................................. 5 КЛАССИФИКАЦИЯ ОМ.................................................................................................................................................................... 6 ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВ ОПРЕДЕЛЕНИЯ ОМ...................................................................................................... 8 ХАРАКТЕРИСТИКА ОТДЕЛЬНЫХ ОПУХОЛЕВЫХ МАРКЕРОВ..................................................................................... 12 РАКОВО-ЭМБРИОНАЛЬНЫЙ АНТИГЕН (РЭА)................................................................................................................ 12 КАРБОГИДРАТНЫЙ АНТИГЕН СА-19-9 В СЫВОРОТКЕ.............................................................................................. 13 РАКОВЫЙ АНТИГЕН СА-15-3................................................................................................................................................. 15 МУЦИНОПОДОБНЫЙ АССОЦИИРОВАННЫЙ АНТИГЕН (МСА) В СЫВОРОТКЕ.............................................. 17 РАКОВЫЙ АНТИГЕН СА-125 В СЫВОРОТКЕ................................................................................................................... 17 КАРБОГИДРАТНЫЙ АНТИГЕН СА-72-4 В СЫВОРОТКЕ............................................................................................. 19 β-ХОРИОНИЧЕСКИЙ ГОНАДОТРОПИН (β -ХГЧ).............................................................................................................. 20 АНТИГЕН ПЛОСКОКЛЕТОЧНОЙ КАРЦИНОМЫ (SCC)................................................................................................. 22 ПРОСТАТИЧЕСКИЙ СПЕЦИФИЧЕСКИЙ АНТИГЕН (ПСА)........................................................................................... 23 СВОБОДНЫЙ ПРОСТАТИЧЕСКИЙ СПЕЦИФИЧЕСКИЙ АНТИГЕН (сПСА)............................................................ 25 НЕЙРОНСПЕЦИФИЧЕСКАЯ ЕНОЛАЗА (NSE) В СЫВОРОТКЕ.................................................................................... 26 ФРАГМЕНТ ЦИТОКЕРАТИНА-19 (CYFRA-21-1)............................................................................................................... 28 ОПУХОЛЕВЫЙ АНТИГЕН МОЧЕВОГО ПУЗЫРЯ (ТРА)................................................................................................. 29 АЛЬФА-ФЕТОПРОТЕИН (АФП) В СЫВОРОТКЕ............................................................................................................... 30 БЕЛОК S100.................................................................................................................................................................................... 32
ТИРЕОГЛОБУЛИН (ТГ).............................................................................................................................................................. 34 ФЕРРИТИН В СЫВОРОТКЕ...................................................................................................................................................... 34 ИСПОЛЬЗОВАНИЕ ОПУХОЛЕВЫХ МАРКЕРОВ ПРИ НЕКОТОРЫХ СОЛИДНЫХ ОПУХОЛЯХ.......................... 36 ЗАКЛЮЧЕНИЕ................................................................................................................................................................................... 42 Приложение 1. Показания к применению опухолевых маркеров........................................................................................ 44 Приложение 2. Ситуационные задачи........................................................................................................................................ 46 Приложение 3. ТЕСТОВЫЕ вопросы........................................................................................................................................... 48 16. УРОВЕНЬ ОПУХОЛЕВОГО АНТИГЕНА МОЧЕВОГО ПУЗЫРЯ (ТРА) ПОВЫШЕН ПРИ ВСЕХ ПЕРЕЧИСЛЕННЫХ ОПУХОЛЯХ, КРОМЕ................................................................................................................................................................... 52 ЛИТЕРАТУРА..................................................................................................................................................................................... 54 ВВЕДЕНИЕ Опухолевые маркеры (онкомаркеры, ОМ) являются неотъемлемой составляющей диагностического процесса в онкологии. На 5-ой Международной конференции по ОМ человека (Стокгольм, 1988г.) было использовано следующее определение: «Биохимические опухолевые маркеры – это вещества, образуемые опухолевыми клетками и секретируемые в биологические жидкости, в которых они могут быть количественно определены неинвазивными методами». К ОМ относится большая группа факторов, концентрация которых в сыворотке крови зависит от развития злокачественного процесса. Они представляют собой макромолекулы, в основном белки с углеводным или липидным компонентом. Они отличаются качественно (опухолеспецифичные) или количественно (ассоциированные с опухолью, но присутствующие также и нормальных клетках) от соединений, продуцируемых нормальными клетками. Их концентрацию можно определить (чаще методом иммуноферментного анализа), благодаря тому, что часть ОМ секретируется в кровь. Общая характеристика ОМ Основная цель использования опухолевых маркеров - оценка эффективности проводимого лечения, мониторинг и прогноз течения заболевания, раннее выявление рецидивов и метастазирования. Также имеются другие направления использования: ü в целях дифференциальной диагностики при неизвестной первичной локализации опухоли (например, НСЕ при раке лёгких, СА 15-3при раке молочной железы); ü для контроля за эффективностью радио- и химиотерапии опухолей: после операции или проводимой лучевой или химиотерапии скорость снижения уровня ОМ может служить первым знаком успешности проведённой операции и терапии и маркером прогноза; ü целесообразно использование нескольких различных опухолевых маркеров из-за гетерогенности опухолей. Необходимо учитывать, что не существует опухолевого маркера со 100% специфичностью по отношению к опухоли, а «нормальный» уровень опухолевого маркера не исключает наличия злокачественного процесса или рецидива. Для того чтобы используемый тест на ОМ мог обеспечить максимально высокую точность диагностики рака, он должен отвечать, по крайней мере, четырём требованиям:
1. Результат анализа должен интерпретироваться индивидуально, без соотнесения с некоей среднестатистической величиной. 2. Результат теста должен количественно отражать изменения в клиническом течении злокачественного процесса — снижаться при регрессии опухоли и повышаться при прогрессировании заболевания. 3. Результат теста должен выявлять субклиническое течение злокачественного процесса и, тем самым, подтверждать достижение полной ремиссии или диагностировать рецидив до его клинического проявления. 4. Тест должен быть настолько надёжным, чтобы на основе результата, указывающего на рецидив, клиницист мог предпринять необходимые действия даже при отсутствии цитологического подтверждения. КЛАССИФИКАЦИЯ ОМ Известно более 200 соединений, относящихся к опухолевым маркерам, и их количество постоянно растет. Существует несколько принципов классификации онкомаркеров. Наиболее часто их группируют по химической структуре или по биологической функции, которую они выполняют в организме. По химической структуре их можно разделить на: гликопротеины, полипептиды, углеводные детерминанты гликопротеинов, гликолипиды, белки, полиамины, иммуноглобулины и др. По биологической функции их делят на: онкофетальные антигены, энзимы, гормоны, рецепторы и соединения, роль которых до конца не выяснена. ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВ ОПРЕДЕЛЕНИЯ ОМ Для клинической диагностики по результатам определения опухолевых маркеров используются следующие статистические термины: Пограничное значение (Cutt off): - используется для первичной диагностики и представляет собой уровень маркера, ниже которого расположено большинство показателей, характерных для здоровых людей и пациентов с доброкачественными заболеваниями. Чувствительность (ЧВ): - процент правильных положительных диагнозов в исследуемой группе пациентов Специфичность (СП): - процент правильных отрицательных диагнозов в исследуемой группе пациентов Положительное прогностическое значение (ПЗ+): - вероятность (%) наличия данного заболевания при положительном анализе Отрицательное прогностическое значение (ПЗ -): - вероятность (%) отсутствия данного заболевания при отрицательном анализе. Правильная интерпретация результата анализа онкомаркеров возможна при соблюдении всех методических условий, а также на основании изучения динамики развития заболевания у каждого конкретного пациента.
Начальной стадией исследования является определение пограничного значения между доброкачественной и злокачественной опухолью, а так же между ремиссией и рецидивом. Оптимальным является проведение такого количества измерений, которое позволяет определить собственные значения уровней для каждого диагноза и отдельных клинических состояний. Использование онкомаркеров: 1. Скрининг. 2. Оценка эффективности терапии. 3. Прогноз. 4. Длительное наблюдение с целью раннего выявления рецидивов и генерализации заболевания. 1. Скрининг - критериями для скринингового теста являются эффективность раннего обнаружения заболевания и правильность теста. 2. Оценка эффективности терапии. Для ряда онкологических заболеваний существуют маркеры, пригодные для оценки эффективности проводимой терапии. 3. Прогноз. Чем выше предоперационное значение уровня маркера, тем выше стадия заболевания и хуже его прогноз. 4. Длительные наблюдения. При регулярном наблюдении за уровнями онкомаркеров можно обнаружить метастазы за 4-6 месяцев до их клинического проявления. ВОЗ рекомендует следующие интервалы взятия проб для анализа: один раз в три месяца в течение третьего года наблюдения. Следует отметить, что наиболее важным показателем является динамика изменений, а не абсолютные показатели концентрации. Назначение лабораторных исследований и интерпретация результатов по уровням онкомаркеров проводится с учетом следующих рекомендаций: 1. Выбор исследуемых маркеров. 2. Преаналитический этап. 3. Аналитический этап. 4. Постаналитический этап. Выбор исследуемых маркеров Неправильный выбор маркеров по отношению к данному заболеванию означает, что при данном диагнозе не происходит повышения уровня исследуемых маркеров. В начальной стадии заболевания, при небольшой массе опухоли нельзя ожидать значительной концентрации. Лечение (операция, химиотерапия), приводящие к полному удалению опухоли, обязательно должно сопровождаться снижением уровней онкомаркеров до нормы. Необходимо принимать во внимание факторы, которые могут оказать влияние на уровень исследуемого маркера (например, повышение ПСА при массаже предстательной железы). Преаналитический этап Требования к условиям и процедурам взятия образца биологического материала При плановом назначении иммунохимических (в том числе гормональных) исследований кровь для их выполнения следует брать натощак (после примерно 12 часов голодания и воздержания от приема алкоголя и курения) между 7 и 10 часами утра, при минимальной физической активности непосредственно перед взятием (в течение 20-30 мин.), в положении пациента лежа или сидя. В случае особых условий взятия крови для определения аналита, оговоренных в инструкции к тест-системе, такие условия должны быть отражены в инструкции по проведению преаналитического этапа для этого показателя.
Образец крови, как правило, берут из локтевой вены. Иглы для взятия крови должны иметь большой диаметр, чтобы не повреждались эритроциты. Наложение жгута не более 1 минуты, пальцы руки не сжимать и не разжимать, не похлопывать ладонью по месту взятия с целью увеличения притока крови к нему. Антикоагулянты для получения плазмы должны добавляться в соответствии с инструкцией для используемой тест-системы. Интервал времени от момента взятия пробы крови до ее центрифугирования не должен превышать 1 час. При необходимости более длительной транспортировки в лабораторию образцы свернувшейся (обычно свертывание происходит в течение 30 минут) крови, предназначенные для получения сыворотки, должны быть отцентрифугированы на месте. Кровь для получения сыворотки центрифугируют в течение 10-15 минут при 1000-1200 g при комнатной температуре, для получения плазмы – в соответствии с инструкцией. Допускается однократное замораживание. Для ряда исследований может быть использована (в соответствии с инструкцией к тест-системе) суточная либо порционная (утренняя) моча. При назначении теста с исследованием суточного количества мочи следует точно соблюдать 24-часовой период ее сбора, проба должна постоянно находится в холодильнике, либо к ней необходимо добавить соответствующий консервант или стабилизатор (в соответствии с инструкцией к тест-системе). Большинство маркеров не требует каких-либо специальных условий для забора образцов Для большинства опухолевых маркеров анализируемые образцы сыворотки крови можно хранить при +4˚С в течение 24 часов, или в течение длительного времени при -20˚С Аналитический этап Необходимо использовать стандартизированный метод для обеспечения воспроизводимости результатов. Анализируемые образцы сыворотки крови необходимо направлять в одну и ту же лабораторию, которая использует один и тот же метод исследования. В противном случае возможны проблемы при сопоставлении результатов, полученных их разных мест. Постаналитический этап Заболевания печени и почек, влияющие на метаболизм онкомаркеров могут изменять результаты анализа. При длительном наблюдении пациентов решающим является не абсолютный показатель уровня маркера, а динамика изменения его концентрации. Таким образом: 1. Опухолевые маркеры необходимо определять одним и тем же методом в одной и той же лаборатории. 2. На уровни опухолевых маркеров может оказать влияние ряд факторов (как на стадии подготовки к анализу, так и при его проведении). 3. Для правильной клинической оценки необходимо тесное сотрудничество лаборатории и клиницистов РАКОВО-ЭМБРИОНАЛЬНЫЙ АНТИГЕН (РЭА) РЭА - гликопротеин с высоким содержанием углеводов, вырабатываемый в тканях пищеварительного тракта эмбриона и плода. РЭА определяется в сыворотке крови плода, но не в крови беременных женщин. После рождения его синтез подавляется, и антиген практически не выявляется ни в крови, ни в других биологических жидкостях взрослых здоровых людей. При развитии опухолей различной локализации уровень РЭА повышается и достаточно точно отражает состояние злокачественного процесса. Повышение концентрации РЭА наблюдается не только при различных карциномах пищеварительного тракта, но и при раке легкого (РЛ), раке молочной железы (РМЖ), раке головы и шеи, злокачественных образованиях соединительнотканного происхождения. РЭА рекомендуется определять совместно с различными органоспецифическими опухолевыми маркерами. РЭА является белком острой фазы, поэтому его уровень может подниматься у больных с разнообразными аутоиммунными, острыми и хроническими воспалительными заболеваниями, при циррозе, хронических гепатитах, ХП, язвенной болезни, пневмонии, бронхитах, туберкулезе, эмфиземе легких, муковисцидозе и др. Однако скорость роста и максимально достигаемый уровень маркера значительно ниже, чем при злокачественных заболеваниях. Незначительное повышение РЭА наблюдается у курящих людей. Показания к исследованию РЭА в сыворотке крови: ü мониторинг течения и лечения рака прямой кишки (повышение концентрации до 20 нг/мл — диагностический признак злокачественных опухолей различной локализации); ü мониторинг опухолей желудочно-кишечного тракта, опухолей легких, опухолей молочной железы; ü ранняя диагностика рецидивов и метастазов рака; ü мониторинг в группах риска (цирроз, гепатит, панкреатит). Материал для исследования: сыворотка (плазма), плевральная жидкость, асцитическая жидкость, суставной экссудат, кистозная жидкость (молочная железа, яичник). Значения нормы: 0-5 нг/мл; Пограничные значения: 5-8 нг/м; Патологические значения: более 8 нг/мл. РАКОВЫЙ АНТИГЕН СА-15-3 СА-15-3 — антиген мембраны клеток метастазирующей карциномы молочной железы. У здоровых лиц может определяться на эпителии секретирующих клеток и в секретах. СА-15-3 обладает достаточно высокой специфичностью по отношению к карциноме молочной железы в сравнении с ее доброкачественными заболеваниями. Повышенные уровни у больных со злокачественными опухолевыми заболеваниями: ü рак молочных желез; ü бронхогенная карцинома (самостоятельного значения не имеет); ü рак желудка (самостоятельного значения не имеет); ü рак печени (самостоятельного значения не имеет); ü рак поджелудочной железы (самостоятельного значения не имеет); ü рак яичников (самостоятельного значения не имеет); ü рак эндометрия (самостоятельного значения не имеет); ü рак матки (самостоятельного значения не имеет). Повышенные уровни при заболеваниях доброкачественной этиологии: ü доброкачественные заболевания молочных желез; ü доброкачественные заболевания желудочно-кишечного тракта, цирроз печени; ü хроническая почечная недостаточность (прежде всего при лечении гемодиализом); ü СПИД; ü хронический бронхит, пневмония и бронхопневмония; ü туберкулез; ü острый и хронический гепатит; ü ревматические заболевания; ü физиологически при беременности. Показания к исследованию: наблюдение больных с раком молочной железы (в комбинации с РЭА и пролиферативными опухолевыми маркерами)
Материал для исследования: сыворотка (плазма), плевральная жидкость, асцитическая жидкость, спинномозговая жидкость, кистозная жидкость (молочная железа, яичник). Значения нормы: 0-22 МЕ/мл МУЦИНОПОДОБНЫЙ АССОЦИИРОВАННЫЙ АНТИГЕН (МСА) В СЫВОРОТКЕ МСА — опухолеассоциированный антиген, присутствующий в клетках молочной железы. Муциноподобный карцинома-ассоциированный антиген представляет собой гликопротеин с молекулярной массой 350 000— 500 000 Да. Повышенный уровень МСА наблюдается в сыворотке крови больных раком молочной железы. Часто это повышение коррелирует со стадией заболевания. Рост содержания МСА регистрируется у беременных (начиная с 4-го месяца), в 20% случаев доброкачественных заболеваний печени, при мастопатиях. Сочетанное использование МСА и СА 15—3 или СА 549 не рекомендуется, так как при этом диагностическая чувствительность не повышается. В целях повышения чувствительности, желательна комбинация данного маркера с РЭА. Показания к исследованию: ü мониторинг больных раком молочной железы; ü диагностика отдаленных метастазов рака молочной железы. Значения нормы: 0-30 МЕ/мл; при беременности сроком 1—2 нед. - до 100 МЕ/мл; Значения нормы: 0-5 МЕ/л; АНТИГЕН ПЛОСКОКЛЕТОЧНОЙ КАРЦИНОМЫ (SCC) SCCA (SCC, ТА-4) - это опухолеассоциированный антиген плоскоклеточных карцином различных локализаций: шейки матки, головы и шеи, пищевода, легких, вульвы. Впервые был выделен из тканей плоскоклеточной карциномы шейки матки в 1977 г. Группа SCCA принадлежит к семейству ингибиторов сериновых протеиназ, и состоит более чем из 10 белков, различающихся по изоэлектрическим точкам, от 5,9 до 6,6. Обычно их разделяют на 2 группы - кислые SCCA, с pI < 6,25, и нейтральные SCCA, с pI от 6,25 и выше. Слюнные железы продуцируют SCCA. Некоторые особенности аминокислотной последовательности в структуре активного центра, подобные имеющимся у а2-антиплазмина (ингибитора плазмина и химотрипсина), позволяют предполагать у SCCA множественные физиологические функции: участие в регуляции дифференцировки нормального плоскоклеточного эпителия, стимуляция роста опухолевых клеток путем ингибирования процесса апоптоза. При проведении анализа на определение SCCA следует помнить, что загрязнение проб слюной или элементами кожи может вести к ложноположительным результатам. Повышенный уровень SCCA обнаруживается при: ü доброкачественных заболеваниях кожи; ü при беременности сроком более 16 нед.; ü у больных с бронхиальной астмой; ü при почечной или печеночной недостаточности. Повышенный уровень SCC обнаруживают у больных: ü плоскоклеточной карциномой шейки матки (до 85%); ü при карциноме носоглотки и уха (до 60%). Повышенный уровень SCC обнаруживают и в 31% случаев плоскоклеточной карциномы легких, и в 17% случаев немелкоклеточного рака. Показания к назначению: мониторинг течения и терапии плоскоклеточной карциномы шейки матки, носоглотки, уха, легких и пищевода. ПРОСТАТИЧЕСКИЙ СПЕЦИФИЧЕСКИЙ АНТИГЕН (ПСА) ПСА - гликопротеин, секретируемый клетками эпителия канальцев предстательной железы. Он относится к семейству калликреиновых сериновых протеаз и является химотрипсинподобной гликопротеазой. Синтез белка контролируется действием андрогенов через рецепторы эпителиальных клеток протоков предстательной железы простаты. Считают, что андрогены непосредственно регулируют транскрипцию гена ПСА. Синтезируемый ПСА поступает непосредственно в кровяное русло, где находится в свободном и связанном состояниях. Исследования ПСА применяют для диагностики и мониторинга лечения РП. Следует помнить, что содержание ПСА в норме увеличивается с возрастом. Подъем уровня ПСА наблюдается после таких процедур, как пальцевое ректальное исследование, цистоскопия, колоноскопия, тепловые процедуры, трансуретральная биопсия, лазерная терапия и др. Забор крови на исследование ПСА в этих случаях следует проводить не ранее, чем через 5-6 дней; и не ранее, чем через несколько недель после излечения простатита или инфекции мочеполовых путей. Повышенные уровни у больных со злокачественными опухолевыми заболеваниями: ü рак простаты; ü рак легких (самостоятельного значения не имеет); ü рак прямой и сигмовидной кишки (самостоятельного значения не имеет); ü гепатоцеллюлярная карцинома (самостоятельного значения не имеет); ü рак почек (самостоятельного значения не имеет). Повышенные уровни у больных с заболеваниями доброкачественной этиологии: ü простатит; ü доброкачественная гиперплазия простаты; ü инфаркт простаты; ü механическое раздражение простаты (исследование per. rectum, цистоскопия). Показания к исследованию: ü диагностика рака простаты; ü оценка эффективности консервативной терапии и контроль за ходом болезни при раке простаты; ü контроль при радикальной простатэктомии; ü дифференциальный диагноз между гипертрофией простаты и раком; ü наблюдение за ходом болезни при гипертрофии простаты с целью быстрого выявления процесса малигнизации; ü скрининг рака простаты (дискутируется и проверяется в ряде исследований); ü прогностический фактор риска развития рака молочной железы при исследовании в сыворотке у женщин (опыт). Материал для исследования: сыворотка (плазма), кистозная жидкость (молочная железа), экскрет молочных желез. Правила взятия образца: Образцы сыворотки должны быть получены до биопсии, простатэктомии или массажа железы, поскольку манипуляции на железе могут приводить к повышению уровня ПСА, которое может сохраняться до 3 недель. Определять постхирургический уровень PSA рекомендуется не ранее, чем через 6 недель. Значения нормы: 0-4 нг/мл; Пограничные значения: 4-10 нг/м;л СВОБОДНЫЙ ПРОСТАТИЧЕСКИЙ СПЕЦИФИЧЕСКИЙ АНТИГЕН (сПСА) Клиническая ценность определения ПСА в крови значительно возрастает при определении различных его форм, соотношение которых соответствует виду патологического процесса, протекающего в предстательной железе. В сыворотке крови ПСА содержится в двух формах: свободной и связанной с различными антипротеазами. Большая часть ПСА находится в комплексе с альфа-1-антихимотрипсином. Незначительная часть ПСА связана с альфа-2-макроглобулином и не определяется обычными ИФА методами. Уровень свободного ПСА меняется в зависимости, как от индивидуальных особенностей организма, так и от вида заболевания предстательной железы. При раке железы в клетках опухоли не только повышается продукция ПСА, но и значительно возрастает синтез альфа-1-антихимотрипсина, в результате чего увеличивается количество связанной и снижается содержание свободной фракции ПСА при увеличении общей концентрации этого антигена. В результате содержание свободной фракции ПСА в сыворотке крови при раке предстательной железы значительно ниже, чем в норме и при доброкачественном процессе. На этом основана дифференциальная диагностика рака и гиперплазии этого органа. Определение свободной фракции ПСА показано при увеличении общего ПСА. При значениях этого соотношения ниже 15 % требуется проведение УЗИ и биопсии. Если этот показатель выше 15 %, необходимы наблюдение и повторное обследование через 6 мес. Если уровни ПСА находятся между 4-10 нг/мл, желательным является определить и сПСА. Это дает возможность рассчитать соотношение концентраций сПСА/ПСА х 100(в процентах), которое имеет следующее диагностическое значение: Злокачественная опухоль: 0-15 %; Пограничные значения: 15-20 %; Доброкачественное заболевание: 20 % и выше.
Значения нормы: 0-10 г/л; Граница нормы — 2,3 нг/мл. ОПУХОЛЕВЫЙ АНТИГЕН МОЧЕВОГО ПУЗЫРЯ (ТРА) Тканевой полипептидный антиген - это пролиферативный антиген кератиновой природы с молекулярной массой 22000 Да. Обнаруживается в большинстве эпителиальных клеток, сыворотке крови, клеточных мембранах опухолевой ткани. Рак мочевого пузыря занимает четвертое место по распространенности форм рака у мужчин и девятое — у женщин. Каждый пятый пациент в настоящее время умирает от этого заболевания в течение 5 лет. Определение ВТА в моче является скрининговым методом для диагностики рака мочевого пузыря, а также для динамического наблюдения за пациентами после оперативного лечения. Антиген выявляется у 70—80 % больных при раке мочевого пузыря в стадии Т1-Т2-ТЗ. При эффективном оперативном лечении ВТА в моче исчезает, его появление свидетельствует о рецидиве заболевания. Следует иметь в виду, что исследование на выявление опухолевого антигена мочевого пузыря может быть ложноположительным при гломерулонефрите, инфекциях и травмах мочевыводящих путей. Повышенный уровень наблюдается при: ü карциномах мочевого пузыря; ü карциномах молочной железы; ü карциномах бронхов; ü карциномах колоректального отдела кишечника; ü карциномах шейки матки. Подъем концентрации ТРА (до 131 Ед/мл) может наблюдаться и при: ü некоторых неопухолевых заболеваниях легких; ü печени; ü урогенитального тракта. Значения нормы: 0-5 МЕ/мл. У беременных с 8 нед его содержание повышается и составляет во II — III триместре 28—120 МЕ/мл; у новорожден ных в первые сутки жизни — до 100 МЕ/мл. Пограничные значения: 5-10 МЕ/мл БЕЛОК S100 Белок S100 - специфический белком астроцитарной глии, способный связывать кальций. Впервые идентифицирован в 1965 г. B.W. Moore и получил свое название благодаря растворимости в 100 % сульфате аммония. Он состоит из двух субъединиц - α и β. S100 (ββ) присутствует в высоких концентрациях в глиальных и шванновских клетках (леммоцитах), S100 (αβ) - в глиальных клетках, S100 (αα) - в поперечнополосатых мышцах, печени и почках. Белок метаболизируется почками, его время биологической полужизни составляет 2 часа. Повышение белка S100 в сыворотке крови и СМЖ при нарушениях мозгового кровообращения обусловлено активацией микроглии. Секреция S100 повышена у пациентов, страдающих от злокачественной меланомы (особенно, в стадиях II, III и IV), уровень S100 коррелирует с прогрессией опухоли, стадией заболевания и может использоваться в целях прогноза, выявления рецидивов и метастазов. Превышение пороговой величины теста при мониторировании лечения пациентов с меланомой можно ожидать, в среднем, у пациентов без проявлений заболевания – в 5,5%; с региональными метастазами – в 12,5%; метастазами в коже дистантных лимфоузлах – в 47,6%; дистантными/висцеральными метастазами – в 42,9% (по результатам последующего наблюдения). Показания к исследованию: ü В комплексе диагностики при повреждении мозга (травмы, инсульт); ü Мониторинг течения и контроль терапии злокачественной меланомы; ü Выявление рецидивов и метастазов меланомы. Повышенные уровни у больных со злокачественными опухолевыми заболеваниями: ü Глиома; ü Шваннома; ü Высокодифференцированная нейробластома; ü Злокачественная меланома. Повышенные уровни при заболеваниях доброкачественной этиологии: ü Неврологические расстройства; ü Метаболические повреждения мозга; ü Травматические повреждения мозга; ü Инсульт. Возможно повышение при интенсивных физических нагрузках. ТИРЕОГЛОБУЛИН (ТГ) Тиреоглобулин - предшественник гормонов щитовидной железы ТЗ и Т4, используется в качестве маркера новообразований в щитовидной железе, а у больных с удаленной щитовидной железой или подвергнувшихся лечению радиоактивным йодом, — для оценки эффективности проведенного лечения. Рецидивный рост доброкачественных и злокачественных опухолей щитовидной железы сопровождается повышением уровня тиреоглобулина у большинства больных Уровень ТГ повышен у больных с подострым тиреоидитом, а также у больных при рецидивах хронических неспецифических тиреоидитов ФЕРРИТИН В СЫВОРОТКЕ Ферритин — растворимый в воде комплекс гидроокиси железа с белком апоферритином. Он находится в клетках печени, селезенки, костного мозга и ретикулоцитах. В небольших количествах ферритин присутствует в сыворотке крови, где он выполняет функцию транспорта железа от ретикулоэндотелиальных к паренхиматозным клеткам печени. Ферритин является основным белком человека, депонирующим железо. Ферритин и гемосидерин содержат 15—20 % общего количества железа в организме. Хотя в сыворотке крови ферритин присутствует в небольших количествах, его концентрация в сыворотке отражает запасы железа в организме. Низкие значения ферритина — это первый показатель уменьшения запасов железа в организме. Определение ферритина в клинической практике позволяет улучшить диагностику нарушений метаболизма железа. Определение ферритина в сыворотке крови используется для диагностики и мониторинга дефицита или избытка железа, дифференциальной диагностики анемий, слежения за развитием опухолей. Определение ферритина может давать ложноположительные или ложноотрицательные результаты при воспалениях, опухолях, патологии печени, когда его содержание может быть увеличено. В ряде случаев у пациентов, находящихся на гемодиализе, отмечают парадоксально повышенный уровень ферритина при аккумуляции железа в клетках РЭС, при этом в костном мозге может быть одновременно дефицит железа. Поэтому при оценке обмена железа следует проводить комплексные исследования Повышение содержания ферритина в сыворотке крови может быть выявлено при следующих заболеваниях: ü при избыточном содержании железа (например, при гемохроматозе, при некоторых заболеваниях печени); ü при воспалительных процессах (легочные инфекции, остеомиелит артрит, системная красная волчанка, ожоги); ü при некоторых острых и хронических заболеваниях с поражением печеночных клеток (алкогольное поражение печени, гепатит); ü при раке молочной железы, остром миелобластном и лимфобластном лейкозе, лимфогранулематозе. Снижение содержания ферритина выявляется при: ü железодефицитной анемии; ü гемолитической анемии с внутрисосудистым гемолизом. Использование определения ферритина в диагностике и мониторировании онкологических заболеваний основано на том, что в отдельных органах и тканях с новообразованиями (острый миелобластный и лимфобластный лейкоз, лимфогранулематоз, опухоли печени) нарушается депонирование железа, что приводит к увеличению ферритина в сыворотке, а также усиленному выходу его из клеток при их гибели. Показания к назначению - комплексная диагностика и мониторинг: ü гепатоцеллюлярного рака; ü карциномы поджелудочной железы; ü молочной железы; ü легких; ü щитовидной железы; ü яичек; ü нейробластомы. Колоректальная карцинома Эта патология составляет около 90% от общего числа раковых заболеваний желудочно-кишечного тракта. Полипоз толстого кишечника и язвенный колит рассматриваются как предраковые состояния. Антигеном выбора при колоректальных опухолях является РЭА. Его содержание коррелирует со стадией опухоли, а предоперационный уровень РЭА коррелирует с продолжительностью безрецидивного постоперационного периода и степенью выживаемости. Падение уровня РЭА после терапевтических мероприятий свидетельствует об уменьшении объема опухоли. После успешной радикальной операции уровень маркера возвращается к нормальному за 6—8 нед. Отсутствие снижения концентрации свидетельствует о неполном уд
|
|||||||||
|
Последнее изменение этой страницы: 2021-05-11; просмотров: 50; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.103.8 (0.159 с.) |