Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вычисление объёма выделившегося газа по известной массе одного из исходных продуктов.⇐ ПредыдущаяСтр 17 из 17
Задача. Какой объём водорода выделится при действии избытка соляной кислоты на 6г цинка? 6г Х Zn + 2HCl = ZnCl2 + H2↑ 1 моль 1 моль 65г 22,4л 1) Mr (Zn)= 65 1 моль цинка весит 65г. 2) 6г------------Х 65г--------22,4л Х = (22,4л · 6г) / 65г = 2,1 л. Ответ: выделится 2,1 л водорода.
Основные источники: Габриелян О. С., Остроумов И. Г. Химия для профессий и специальностей технического профиля: учебник для студ. учреждений сред.проф. образования. — М., 2016. Габриелян О. С., Остроумов И. Г., Остроумова Е. Е. и др. Химия для профессий и специальностей естественнонаучного профиля: учебник для студ. учреждений сред.проф. образования. — М., 2014.. Ерохин Ю. М., Ковалева И. Б. Химия для профессий и специальностей технического и естественнонаучного профилей: учебник для студ. учреждений сред.проф. образования. М., 2014.Журналы: «Химия и жизнь» «Химия в школе» «Наука и жизнь»
Дополнительная литература: Габриелян О. С. и др. Химия для профессий и специальностей технического профиля (электронное приложение). Интернет-ресурсы
Всероссийская олимпиада для школьников "Покори Воробьевы горы". [ Электронный ресурс ] URL https://pvg.mk.ru(Дата обращения 17.05.2018) Химия. Образовательный сайт для школьников. Экспериментальный учебник по химии для 8 и 11 классов средней школы. Общая и неорганическая химия. [ Электронный ресурс ] URL http://hemi.wallst.ru (Дата обращения 17.05.2018) Электронный учебник, информация о ЕГЭ,тесты по химии,примеры решения задач, история химии, занимательные опыты, биографии химиков, номенклатура, кинетика реакций, портреты химиков, химия в быту,витамины, химические таблицы, классификация реакции. [ Электронный ресурс ] URL http://allhimikov.ru (Дата обращения 17.05.2018) Информация о химических факультетах, вузах, ассоциациях. Электронная библиотека. Базы данных по химии. Сведения о конференциях, семинарах, конкурсах, олимпиадах. [ Электронный ресурс ] URL http://www.chem.msu.su (Дата обращения 17.05.2018) Интернет-издание для учителей «Естественные науки». [ Электронный ресурс ] URL http://enauki.prosv.ru (Дата обращения 17.05.2018) Методическая газета «Первое сентября». [ Электронный ресурс ] URL https://1сентября.рф (Дата обращения 17.05.2018)
Журнал «Химия в школе», aрхив аннотация статей журнала с 2010 года. Сведения о подписке. Редакционная коллегия. [ Электронный ресурс ] URL http://www.hvsh.ru (Дата обращения 17.05.2018) журнал «Химия и жизнь [ Электронный ресурс ] URL http://www.hij.ru (Дата обращения 17.05.2018) Электронный журнал «Химики и химия». [ Электронный ресурс ] URL http://chemistry-chemists.com (Дата обращения 17.05.2018)
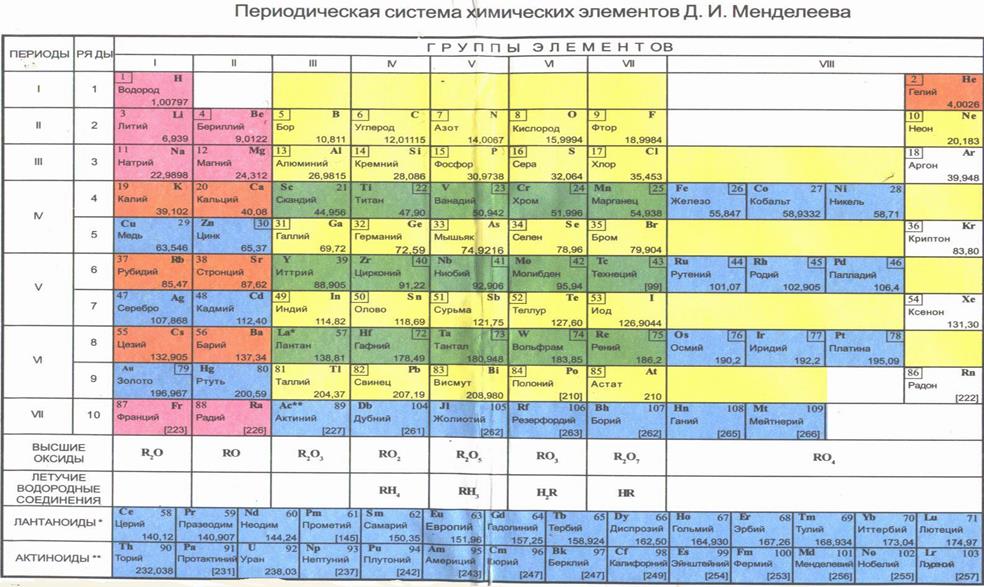
Приложение 1
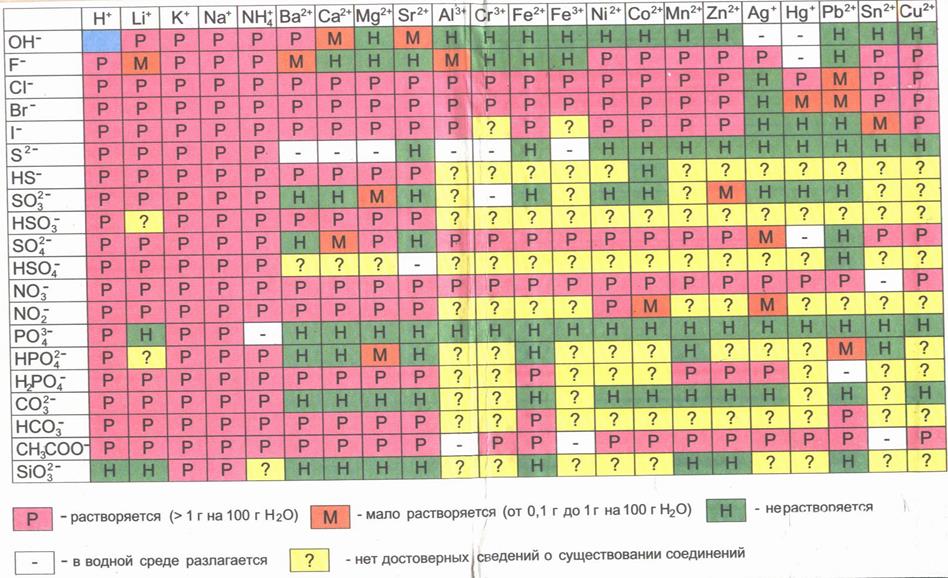
Приложение 2
Приложение 3
Приложение 4
Приложение 5
Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, (H), Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-12; просмотров: 66; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.118.99 (0.005 с.) |