Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Общая характеристика биологического тест-объекта
Daphnia magna Систематическое положение: Тип Членистоногие (Artropoda) 2 Подтип Жабродышащие (Branchiota) 3 Класс Ганадообразные (Crustacea) 4 Отряд Ветвистоусые (Cladocera) 5 Семейство Дафневые (Daphnidae) 6 Род Дафния (Daphnia) 7 Вид Daphnia magna St Дафнии - мелкие рачки (рис.1.1.) (размеры тела взрослых особей от 0,6 до 6 мм). Они населяют все типы стоячих континентальных водоемов, встречаются также во многих реках с медленным течением. В лужах, прудах и озерах часто имеют высокую численность и биомассу. Дафнии- типичные планктонные рачки, большую часть времени проводящие в толще воды. Большую часть времени проводят в толще воды, передвигаясь резкими скачками за счет взмахов вторых антенн, которые покрыты специальными оперенными щетинками (отсюда их обычное название - «водяные блохи», часто относимое ко всем ветвистоусым).
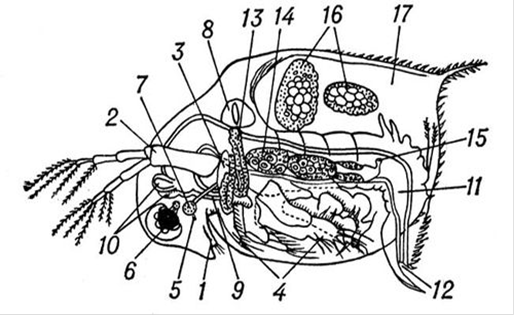
Рис. 1.1 - Дафния (взрослая самка): 1 - первая пара усиков; 2 - вторая пара усиков; 3 - верхние челюсти (мандибулы, или жвалы); 4 - грудные ножки; 5 - глазок (простой); 6 - глаз (сложный); 7 - надглоточный ганглий; 8 - сердце; 9 - пищевод; 10 - пищеварительная железа; 11 - кишечник; 12 - заднепроходное отверстие; 13 - орган выделения; 14 - яичник; 15 - отверстие яйцевода; 16 - зародыши; 17 - пространство между сплошной поверхностью брюшка и раковиной [27].
Многие дафнии способны также медленно ползать по дну или стенкам сосудов за счет токов воды, создаваемых грудными ножками (антенны при этом способе передвижения неподвижны). Основной пищей для дафний служат бактерии и одноклеточные водоросли [28]. Тело овальной формы, сжато с боков, заключено в прозрачный хитиновый панцирь. Со спинной стороны вытянут в длинный щит. Створки на брюшной стороне соединены, образуют цепь. Тело нечетко сегментировано на головной, грудной и брюшной отделы. На голове щит с раструмом, на нем - две антенны с осязательными щетинками, сильнее они развиты у самцов. В основании головы расположены две задние сильно развитые антенны, служащие для скачкообразного движения в толще воды [29]. Назначение ротовых конечностей кладоцер - фильтраторов направлять в кишечный канал, образующийся в пищевом желобке комок. С помощью конечностей также удаляется пища, направляющаяся по желобку в то время, когда пищеварительный тракт заполнен и происходит пищеварение. Пищеварительная система представлена кишечником, который подразделяется на три примерно равных по длине отдела - пищевод (передняя кишка), среднюю и заднюю кишку. Кровеносная система развита слабо. Имеется мешковидное сердце, замкнутое сзади и снабженное выходным отверствием спереди и парой остий по обеим сторонам. Сердце сокращается до 200-290 ударов в минуту. Полостная жидкость (кровь) бесцветна или слабо окрашена и включает мелкие амебовидные клетки. Кровеносные сосуды не развиты. Из сердца кровь поступает в пространство между органами [30].
В грудном (торакальном) отделе расположено 5 пар грудных ножек. Они сильно расчленены, снабжены многочисленными щетинками, которые образуют сито. Функции ножек - это фильтрация воды для питания и дыхания, (частота движения ножек - 150-170 ударов в минуту) зависит от качества воды, температуры, состояния рачков. Половая система самки- яичники, самца - семенники, они расположены по обеим сторонам кишечника. Яичники в виде парных трубок тянутся по сторонам кишечника, открываясь короткими яйцеводами в выводковую камеру. Оплодотворение осуществляется обычно в момент прикрепления самца к заднему краю раковины самки [31]. Эмбрион в выводковой камере развивается от 1 -до 4 суток. Молодь выходит во время линьки (сбрасывание панциря), вслед за этим в выводковую камеру поступают яйца следующего помета. У Daphnia magna в летнее время при достаточном количестве пищи в начале и конце жизни молодь нового помета отрождается каждые 2 дня, в середине жизни ежедневно [32]. Благодаря прозрачному панцирю хорошо просматриваются окраска тела, внутренние органы: кишечник, жировые капли, выводковая камера с эмбрионами и т.д., что позволяет полнее оценить состояние дафний. Короткий биологический цикл развития позволяет проследить рост и развитие дафний на всех жизненных стадиях. В течение жизни дафний выделяют ряд стадий, сопровождающихся линьками, при линьке расходится цервикальный шов - линия между головным щитом и карапаксом, и животное вылезает из экзувия. Вместе с карапаксом сбрасываются покровы тела и конечностей. Линька периодически повторяется в течение всей жизни особи. Обычно линька происходит в толще воды, эфиппиальные самки некоторых видов линяют, приклеившись снизу к поверхностной пленке воды. Несколько линек происходят во время эмбрионального развития, в выводковой камере. При хорошем питании размеры дафний после каждой линьки удваиваются. Молодь 0,7-0,9 мм в длину, половозрелые самки - 2,2-2,4 мм, самцы - 2-2,1 мм. Максимальная длина тела самки 6,0 мм при влажной биомассе 7-10 мг [33].
В жабрах (овальные выросты ножек) происходит газообмен. Значительную часть кислорода дафнии получают через тонкие покровы тела и конечностей, а дыхательные придатки, как и затылочный орган <http://ru.wikipedia.org/w/index.php?title=%D0%97%D0%B0%D1%82%D1%8B%D0%BB%D0%BE%D1%87%D0%BD%D1%8B%D0%B9_%D0%BE%D1%80%D0%B3%D0%B0%D0%BD&action=edit&redlink=1> новорожденных, играют важную роль в осморегуляции <http://ru.wikipedia.org/wiki/%D0%9E%D1%81%D0%BC%D0%BE%D1%80%D0%B5%D0%B3%D1%83%D0%BB%D1%8F%D1%86%D0%B8%D1%8F>. Дафния устойчива к изменению кислородного режима (до 2 мгО2/л), что связано со способностью синтезировать гемоглобин, так что их гемолимфа <http://ru.wikipedia.org/wiki/%D0%93%D0%B5%D0%BC%D0%BE%D0%BB%D0%B8%D0%BC%D1%84%D0%B0> и всё тело окрашивается в красный цвет [33]. Дафнии размножаются партеногенетически. В благоприятных условиях (например, летом в непересыхающих лужах и мелких водоёмах) в популяциях дафний присутствуют только партеногенетические самки. Из их неоплодотворенных диплоидных яиц развиваются следующие поколения самок. Развитие эмбрионов при партеногенезе протекает в выводковой камере под раковинкой и сопровождается несколькими линьками. Затем молодые рачки выходят из выводковой камеры (развитие прямое). Осенью или перед высыханием водоема из таких же неоплодотворенных яиц развиваются самцы (как правило, все особи одного помета имеют одинаковый пол). Таким образом, определение пола <http://ru.wikipedia.org/wiki/%D0%9E%D0%BF%D1%80%D0%B5%D0%B4%D0%B5%D0%BB%D0%B5%D0%BD%D0%B8%D0%B5_%D0%BF%D0%BE%D0%BB%D0%B0> у дафний чисто средовое. Переход к двуполому размножению у видов из крупных водоемов обычно требует воздействия двух стимулов - понижения температуры и уменьшения длины светового дня. Показано, что покоящиеся яйца дафний могут длительное время выживать и развиваться в растворах ядовитых солей (например, хлорида ртути HgCl2) при концентрации ядов, в тысячи раз превышающей ПДК <http://ru.wikipedia.org/wiki/%D0%9F%D0%94%D0%9A>, после разрыва оболочки яйца, вылупившиеся эмбрионы в таких растворах сразу же погибают [34]. Подавляющее большинство планктонных ракообразных в пресных водах относится к «мирным» формам, питающимся водорослями, бактериями и детритом. Основной способ, с помощью которого нехищные планктонные ракообразные улавливают свои объекты - это фильтрация. Пропуская через свой организм большие объёмы воды, они способны накапливать значительные количества токсических веществ, способствуя тем самым естественному самоочищению воды. Туловищные конечности у Cladocera утратили функцию органов движения, а приобрели функцию собирания мелких пищевых частиц. Все действия аппарата осуществляются многочисленными различными по строению щетинками. Одни из щетинок конечностей выполняют функцию фильтрации, другие очистительную, третьи - подхватывают пищу и направляют ее в пищевой желобок. Многочисленные мельчайшие щетинки, покрывающие стенки пищевого желобка, обеспечивают дальнейшее продвижение пищевых частиц [35]. Специфическое для водных животных фильтрационное питание характеризуют скоростью фильтрации воды и скоростью питания (рацион). Скорость фильтрации условно определяют как объем воды, который приданной концентрации пищи содержит число частиц, равное потребленному. Максимальная скорость фильтрации наблюдается при низкой концентрации взвеси в среде. Начиная с известной концентрации пищи, скорость фильтрации минимальна и не зависит от количества взвеси в воде.
Кормом для дафний служат: нансестон - одноклеточные водоросли, частицы детрита, мелкие простейшие и ультрасестон - бактерии, очень мелкий детрит и растворенное органическое вещество. Разные компоненты, составляющие пищу Cladocera, имеют не одинаковую пищевую ценность: наибольшей обладают из микроорганизмов - водоросли Chlorella и Scenedesmus [36, 37]. Применение Daphnia magna в биотестировании Биотесты, в которых в качестве тест-организмов используют различные виды рачков дафний, основаны на оценке изменений определенного набора форм поведения - кувыркание, скучивание, равномерное распределение в заданном объеме; физиологического состояния - изменение дыхания, сердцебиения, окраски тела, абортизации яиц и зародышей и т. п.; двигательной активности - изменения частоты движения эпиподитов, либо выживаемости и плодовитости при помещении в тестируемую воду. Дафний рекомендуется применять для контроля сточных вод в установленном режиме и выявления потенциально опасных источников загрязнения водных объектов токсическими веществами [38]. Популярность Daphnia magna как тест - объекта связана главным образом с тем, что она без особых трудностей выращивается в лабораторных условиях, довольно устойчива в искусственных условиях (при культивировании), дает целый комплекс тест -реакций и имеет короткий жизненный цикл, позволяющий прослеживать последствия токсического воздействия (в малых концентрациях) на протяжении ряда поколений [39]. Биотесты на Daphnia magna стандартизированы в ряде стран (CША, Франция, Германия, Венгрия). Данный тест-объект является базовым объектом биотестирования для экотоксикологов.Они быстро адаптируются к лабораторным условиям и чувствительны к токсичным веществам [40]. Для работы с дафниями принимают 24-часовой острый и 21-дневный хронический тесты, учитывают смертность и рассчитывают концентрацию вещества, вызывающую 50%-ную гибель особей (LC50). В более продолжительных экспериментах определяют снижение воспроизводства организмов. В последние годы на беспозвоночных исследуют физиологические, морфологические и генетические последствия хронического воздействия токсиканта [40].
Daphnia magna используется как тест-объект в водно-токсикологических исследованиях уже свыше 65 лет. Основу для такого широкого ее применения заложил еще Э. Науманн в классической работе «Daphnia magna Straus als Versuchtiere». Во второй половине ХХ века, в связи с возникшей повсеместно необходимостью оценки токсичности сточных вод, мониторинга природных вод, выяснения токсичности химических продуктов, широко используемых в народном хозяйстве и представляющих реальную или потенциальную угрозу для гидробионтов, и решения ряда других водоохранных задач, биотестирование на дафниях стало широко использоваться в исследовательской деятельности и в оперативном контроле загрязнения вод в США, Франции, Германии и других европейских странах, а также и в России, где развитие этой методики связано в первую очередь с работами Н.С.Строганова и Л.А. Лесникова [41]. D. magna - организм средней чувствительности к токсикантам, на много уступающий в этом отношении некоторым другим видам ветвистоусых ракообразных, инфузориям, коловраткам и другим беспозвоночным животным; это типичный обитатель малых водоемов (пруды, лужи) с высоким уровнем органического загрязнения, хорошо адаптированный к органическому загрязнению, а следовательно, и к органическим токсикантам. Дафнии, как и другие тест-объекты, при решении прикладных задач водной токсикологии нужны главным образом как «датчики» сигнальной информации о токсичности среды и заменители сложных химических анализов, позволяющие оперативно констатировать сам факт токсичности (ядовитости, вредности) водной среды (да или нет). Такая задача решается достаточно убедительно и без аппаратурного оснащения - притом быстро и дешево[42]. В странах ЕЭС принят стандарт на биотестирование сточных вод и определение токсичности отдельных веществ с помощью - D. magna. По существу этот метод сводится к установлению доз тестируемого вещества для данного вида дафний. Методы с использованием дафний позволяют сравнивать токсичность вод, содержащих разнообразные загрязнители, однако, в связи с разведением в разных лабораториях неодинаковых клонов дафний они дают значительный разброс результатов, достигающий 35% и более. Таким образом, несмотря на ряд достоинств, биотесты с дафниями не могут претендовать на универсальность и унифицированность. Желательно их использование в комплексе с другими биологическими и гидрохимическими методами. В международном стандарте на биотест с дафниями особо оговаривается применимость его результатов только в отношении D. Magna [43]. Выращивание культуры Daphnia magna Культуру дафний выращивают в помещении, не содержащем токсических паров или газов. Оптимальная температура для культивирования дафний и биотестирования составляет 20±2°С, освещенность 400-600 лк при продолжительности светового дня 12-14 ч. Не допускают освещения дафний прямыми солнечными лучами [44].
Стеклянную посуду для содержания дафний моют питьевой водой. Для культивирования дафний используют отстоянную водопроводную воду. Вода для культивирования должна удовлетворять следующим требованиям: рН 7,0-8,2; жесткость общая 3-4 мг -экв/л, концентрация растворенного кислорода не менее 6,0 мг/л, солевой состав до 6 % [45]. В качестве корма используют протококковые зеленые водоросли Scenedesmus quadricauda 1 - 2 раза в неделю дафний кормят хлебопекарными дрожжами. Для приготовления дрожжевого корма 1 г свежих или 0,3 г воздушно-сухих дрожжей заливают 100 мл дистиллированной воды. После набухания дрожжи тщательно перемешивают. Образовавшуюся суспензию отстаивают в течение 30 мин. Недостающую жидкость добавляют в сосуды с дафниями в количестве 3 мл на 1 л воды [46]. Маточные культуры дафний содержат в цельностеклянных аквариумах с плотностью посадки 20-30 дафний на 1 л среды. Воду аквариумов обновляют на половину один раз в 7-10 дней. Для экспериментов выращивают синхронизированную культуру рачков от одной особи. Дафнии при этом генетически однородные, одновозрастные и развиваются одновременно, что позволяет максимально исключить возможность разброса результатов. С этой целью половозрелых дафний рассаживают по одной в стаканчики с 100 мл воды. У наиболее плодовитой самки отбирают молодь одного помета (30-40 особей) и помещают в 2-литровый аквариум. Одно пометную молодь второго поколения в возрасте 1 - 3 суток используют в опыте [47,48]. Выращивание культуры Scenedesmus quadricauda Для биотестирования используют лабораторную культуру одноклеточных зеленых протококковых водорослей Scenedesmus quadricauda (Т urp) Breb. Лабораторную культуру водорослей выращивают на среде Прата в конических плоскодонных колбах объемов 250-300 см3 в люминостате с интенсивностью освещения не менее 2000-3000 лк при температуре (20±2)°С [49]. При культивировании водорослей используют химически чистую стеклянную посуду. Для этого посуду промывают смесью бихромата калия и серной кислоты (хромовой смесью), затем тщательно водопроводной водой и 3-4 раза дистиллированной водой. Посуду, используемую для культивирования, за исключением мерной, стерилизуют в сушильном шкафу при 160°С в течение 1,5 ч. Не разрешается пользоваться для мытья посуды синтетическими поверхностно-активными веществами и органическими растворителями. Можно пользоваться питьевой содой [50]. Для приготовления питательной среды Прата (Таблица 1.8) сначала готовят исходные растворы солей на дистиллированной воде: калия азотнокислого - 100,0 г/дм3; магния сернокислого - 10,0 г/дм3; калия фосфорнокислого двузамещенного - 10,0 г/дм3. Навеску железа хлорного 0,5 г растворяют в 0,5 дм3 дистиллированной воды. Полученные исходные растворы солей хранят в холодильнике. В случае помутнения растворов их заменяют на свежие [51].
Таблица 1.8 Состав питательной среды Прата [52]
Чтобы получить питательную среду Прата для культивирования водорослей, соответствующие объемы исходных растворов (кроме железа хлорного) добавляют по 1 мл в 1 дм3 дистиллированной воды в последовательности их расположения в таблице. Стерилизуют полученный раствор кипячением на водяной бане 15 мин, охлаждают и добавляют туда 1 мл хлорное железо из исходного раствора [53]. При культивировании периодически обновляют культуру водорослей, пересевая ее на свежую питательную среду не реже одного раза в 10 дней. Для этого в стерильную колбу объемом 250-300 см3 со свежей средой Прата объемом 150 см3 над пламенем спиртовки наливают 15-20 см3 верхнего слоя исходной культуры (содержимое исходной культуры при этом не перемешивают). Начальная плотность клеток в новой колбе составляет примерно 100-150 тыс. кл/см3, что дает светло-зеленую окраску. В случае ослабления интенсивного роста клеток в культуре, к питательной среде добавляют витамин В12. После посева колбу закрывают стерильной ватно-марлевой пробкой и бумажным колпачком, перемешивают и помещают в люминостат. В процессе культивирования культуру водорослей периодически перемешивают, встряхивая 1 -2 раза в сутки [54] Вывод
На сегодняшний день одним из приоритетных направлений государственной политики является решение проблемы захламления земель отходами производства и потребления, их переработки и утилизации. Природоохранное законодательство РФ строго регламентирует сферу обращения с отходами. Для исполнения требований природоохранного законодательства предприятию производителю отхода необходимо, прежде всего, установить класс опасности образующихся в процессе его деятельности отходов производства и потребления. Это необходимо для правильного выбора условий хранения, транспортировки, метода утилизации или вторичного использования образующихся отходов в данном производстве. Одним из способов определения класса опасности отходов является биотестирование. Данный метод дает возможность на количественном основании за счет получения конкретных цифровых данных охарактеризовать уровень токсичности отхода для организмов. Наиболее часто используемым тест-объектом в биотестировании является D. Magna.
II. ПАТЕНТНЫЙ ПОИСК
Был проведен патентный поиск по методике использования Daphnia magna и Scenedesmus quadricada в качестве тест-объектов при биотестировании для установления класса опасности твердых бытовых отходов (табл. 2.1). Глубина поискабыла принята 5 лет, исходя из потребностей выявления новейших достижений в данной области. Начало поиска 20 марта 2011г.
Таблица 2.1 Поиск проводился по следующим материалам
) Патент. 236901 Российская Федерация, МПК А01H 13/00. Способ дифференциации мезотрофного и эвтрофного состояния пресных непроточных водоемов и водных вытяжек отходов. [Текст] / Яценко - Степанова Т.Н., Немцева Н.В., Игнатенко М.Е., Бухарин О.В.; Заявитель и патентообладатель Государственное учреждение Институт клеточного и внутриклеточного симбиоза УрО РАН./ - № 2008100322/13; заявл. 09.01.2008г.; опубл.12.04.2009г// www.fips.ru <http://www.fips.ru>. [54]. Изобретение относится к биотехнологии, в частности к экологии, и может быть использовано в природоохранной деятельности для контроля качества вод пресных непроточных водоемов и водных вытяжек из отходов. Способ осуществляется путем регистрации трех биотических и трех абиотических показателей, расчета показателя трофности и определения экологического состояния водоема по величине показателя трофности, в качестве биотических показателей регистрируют количество водорослей вида Crucigenia tetrapedia (Kirchn.) W. Et G.S. West, Scenedesmus quadricauda (Turp.) Breb. var. quadricauda, Trachelomonas volvocinopsis Sw ir., вкачестве абиотических показателей регистрируют среднедекадную температуру воздуха, количество осадков за декаду и прозрачность воды в водоеме, показатель трофности рассчитывают по определенной формуле. При значении показателя трофности, меньшем либо равном 3,6, водоем считают мезотрофным, а при значении показателя трофности более 3,6 - эвтрофным. Применение данного способа позволяет быстро получать объективную и достоверную информацию об экологическом состоянии непроточного пресного водоема на основе ограниченного числа анализов, что значительно уменьшает затраты труда, времени и средств при проведении исследований. 2) Патент. 2008100322 Российская Федерация, МПК A01H 13/00 (2006.01). Способ определения экологического состояния пресных непроточных водоёмов и водных вытяжек из отходов. [Текст] / Яценко - Степанова Т.Н., Немцева Н.В.,Игнатенко М.Е., Бухарин О.В.;Заявитель и патентообладатель Государственное учреждение Институт клеточного и внутриклеточного симбиоза УрО РАН./ - № 2008100322/13, заявл.09.01.2008г.;опубл.10.06.2008г.// www.fips.ru <http://www.fips.ru>. [55]. Способ определения экологического состояния пресных непроточных водоемов по их трофности, предусматривающий регистрацию трех биотических и трех абиотических показателей, расчет показателя трофности и определения экологического состояния водоема по величине показателя трофности, в качестве биотических показателей регистрируют количество водорослей вида Crucigenia tetrapedia (Kirchn.) W. Et G.S. West, Scenedesmus quadricauda (Turp.) Breb. var. quadricauda, Trachelomonas volvocinopsis Swir. 3) Патент.2377560 Российская Федерация, МПК G01N 33/18. Способ биотестирования токсичности воды на низших ракообразных животных. [Текст] / Григорьев Ю.С., Шашкова Т.Л.; Заявитель патентообладатель Федеральное государственное образовательное учреждение высшего профессионального образования Сибирский федеральный университет./ - № 2008128155/13, заявл. 09.07.2008г.; опубл. 08.02.2009г.// www.fips.ru <http://www.fips.ru>. [56]. Изобретение относится к токсикологии и касается определения чувствительности дафний к токсическому действию водорастворимых химических веществ. Способ осуществляют: фиксируют время гибели дафний под действием химического вещества в минутах при изменяющихся по логарифмической шкале с интервалом 0,1 концентрациях (С) в моль/л исследуемого вещества. Способ позволяет оценивать динамику развития токсического эффекта и сравнивать токсическое действие водорастворимых химических веществ в одинаковых концентрациях. ) Патент.2256910 Российская Федерация, МПК G 01 N 33/00, 33/18. Способ определения чувствительности гидробионтов D apnia magna str к токсическому действию водорастворимых химических веществ. [Текст] / Петров В.В., Подосиновиков Н.П., Долго - Сабуров В.Б.; Заявитель и патентообладатель Государственное учреждение Институт токсикологии Министерств здравоохранения РФ. /- № 2003118544/144, заявл.19.06.2003г.; опубл. 10.03.2004г.// www.fips.ru <http://www.fips.ru>. [57]. Изобретение относится к биотехнологии. Способ относится к способам биотестирования токсичности природных, сточных вод и водных растворов с использованием таких тест -организмов, как низшие ракообразные животные (дафнии, цериодафнии, моины и др.). Оно может быть использовано в экологическом мониторинге загрязнения окружающей среды путем оперативного контроля токсичности природных и сточных вод, а также водных растворов. Способ включает определение показателя смертности рачков в пробах тестируемой воды в отсутствие добавленного корма, находящихся в емкостях, установленных в климатостате с длительностью эксперимента 48 часов, при этом емкости с водой и тест -организмами при проведении биотестирования устанавливают в наклонном положении в кассету, которую вращают со скоростью 5-10 оборотов в минуту. Изобретение позволяет повысить чувствительность и снизить трудоемкость процесса биотестирования воды на низших ракообразных животных. 5) Патент. 2283489 Российская Федерация, МПКG01N33/18. Способ экологической оценки хронической токсичности воды и водных вытяжек отходов. [Текст]/ Ратушняк А.А., Ильясова М.А.; Заявитель и патентообладатель Институт экологии природных систем Академии наук Республики Татарстан./- №2004124342/13, заявл. 09.08.2004г.; опубл. 26.05.2005г.// www.fips.ru <http://www.fips.ru>. [58]. Изобретение относится к биотехнологии, а именно к области охраны окружающей среды. Изобретение осуществляют следующим образом: в течение весеннее - летнего и осенне-зимнего сезонов неоднократно проводят длительное биотестирование на Daphnia magna Straus природной воды, с внесенным поллютантом. При этом вывод о наличии хронического токсического действия делают на основании достоверности различий между показателями выживаемости и репродукции Daphnia magna Straus на природной воде без поллютанта и с поллютантом. Изобретение направлено на повышение точности экотоксилогической оценки потенциальной опасности поллютантов, попадающих в водные объемы для водных организмов, наиболее чувствительных к их действию. 6) Патент. 2007713 Российская Федерация, МПК G01N33/18 . Способ определения токсичности водной среды. [Текст]/ Эрнестова Л.С.; Заявитель и патентообладатель Научно-производственное объединение «Тайфун»./- № 4952638/04, заявл. 28.06.2001г.; опубл.13.04.2002г.// www.fips.ru <http://www.fips.ru>. [59]. Использование: в физико-химическом анализе, в частности в способе определения токсичности водной среды, водной вытяжки отхода. Сущность изобретения: способ предусматривает введение в анализируемую воду тестирующей смеси, состоящей из лейкоформы красителя трифенилметанового ряда и гликолевого реактива при соотношении, равном (0,5 - 1): (0,0005 - 0,0015). Вода считается токсичной при величине адсорбции выше 0,3 мкг экв/л. Изобретение относится к методам исследования водных объектов с использованием составов для физико-химического анализа и может быть использовано в промышленности, сельском хозяйстве при режимном и санитарном контроле качества воды.
Вывод
Лучшим отечественным аналогом методики биотестирования с использования Daphnia magna и Scenedesmus quadricada является методика в заявке 2377560 [56] Российской Федерации. Данная методика проста в аппаратурном оформлении и позволяет оценивать динамику развития токсического эффекта и сравнивать токсическое действие компонентов водной вытяжки в одинаковых концентрациях. Что позволяет получить наиболее точную информацию для определения класса опасности отхода.
III. АНАЛИТИЧЕСКАЯ ЧАСТЬ
|
|||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-20; просмотров: 140; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.216.236.108 (0.044 с.) |