Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение содержания хлоридов в плазме крови колориметрическим методом
Принцип метода Хлорид-ионы освобождают из хлораниловокислой ртути (II) хлораниловую кислоту, содержание которой определяется фотометрически, количество хлораниловой кислоты пропорционально концентрации хлорид-ионов в пробе. Проведение анализа
Расчёт Количество хлорид-ионов в плазме крови рассчитывают по формуле Содержание хлоридов [ммоль/л] = где: ЕОП и ЕСТ ‑ оптическая плотность опытной и стандартной проб, Нормальные величины Плазма крови 94‑110 ммоль/л Рассчитывают процентное соотношение концентрации хлорид ионов (К) в ротовой жидкости и концентрации хлорид-ионов в плазме крови. К (%) = (СРЖ / СПЛ) · 100 %, где: СРЖ ‑ концентрации хлоридов в ротовой жидкости (моль/л), Практическое значение Ионы Сl– являются основными внеклеточными анионами, присутствуют во всех жидкостях организма. Гиперхлоремия наблюдается при обезвоживании, вызванном недостаточным поступлением жидкости, при повышенном поступлении хлорида натрия, декомпенсации сердца, метаболическом ацидозе и респираторном алкалозе, снижении экскреции хлорид-ионов с мочой при нефритах, отравлении салицилатами, приёме глюкокортикоидов. Гипохлоремия встречается чаще и возникает при недостаточном поступлении хлоридов и избыточной потере через желудочно-кишечный тракт при заболеваниях, сопровождающихся неукротимой рвотой и поносом, при стенозе привратника, длительном потоотделении, почечном и сахарном диабете, сморщенной почке, в результате перераспределения и задержки хлоридов в повреждённых тканях при хронических воспалительных процессах, абсцессах, некрозах. Оформление работы Указывают принцип метода, регистрируют данные, делают расчёты, сравнивают полученные результаты с нормальными значениями показателя хлоридов в ротовой жидкости и плазме крови, делают выводы о наличии/отсутствии отклонений.
Задание Провести сравнительную оценку полученных на лабораторных работах показателей содержания хлоридов, фосфатов, ионов кальция в крови с аналогичными показателями в слюне с целью охарактеризовать влияние минерального обмена организма на минеральный обмен в слюне. Предположить и обосновать пути и возможности гормональной регуляции минерального обмена слюны. Лабораторная работа 5. В ротовой жидкости содержатся роданиды (тиоцианаты), которые являются продуктом сульфирования цианидов (солей синильной кислоты) тиосульфатом натрия с помощью фермента роданазы: КСN + Na2S2O3 Роданиды активируют пероксидазы слюны, участвующие в метаболизме пероксидов, и тем самым оказывать защитное действие. В гранулоцитах, поступающих в полость рта с жидкостью десневой борозды, локализован фермент лактопероксидаза, который окисляет имеющийся в слюне роданид с помощью перекиси водорода в бактерицидный гипотиоционат: SCN– + H2O2 Содержание роданидов в слюне зависит от контакта человека с табачным дымом. В слюне курильщиков их концентрация значительно больше по сравнению с таковой у некурящих. Высокие концентрации роданидов в ротовой жидкости вызывают токсические эффекты в пародонте. Принцип метода Роданиды в слюне обнаруживают по появлению красного окрашивания при добавлении к слюне хлорного железа. Реакция обусловлена образованием роданистой соли трехвалентного железа в результате взаимодействия ионов Fe3+ и SCN– и образованием различных комплексов, имеющих состав от Fe(H2O)5(NCS)2+ до Fe(NCS)63–. Некоторые органические соединения (например, соли лимонной и уксусной кислот) препятствуют образованию окраски. Необходимые реактивы 1) 0,01 % раствор хлорного железа, 2) 2 % раствор соляной кислоты. Материал для исследования Слюна некурящего человека и курильщика. Проведение анализа Готовят две пробы: опытную (слюна курильщика) и контрольную (слюна некурящего человека). В каждую пробирку к 10 каплям слюны добавляют по 2 капли 2 % раствора соляной кислоты и по 2 капли раствора хлорного железа (FeCl3). В результате появления роданида железа развивается красное окрашивание разной интенсивности в зависимости от концентрации ионов роданида.
Нормальные величины Ротовая жидкость 0,5‑1,2 ммоль/л (визуально окраска не дифференцируется). Практическое значение Основным путём поступления лейкоцитов в полость рта является десневая бороздка и её жидкость. В местах повреждения слизистой оболочки полости рта происходит дополнительная эмиграция гранулоцитов из крови, которые принимают участие в защитных реакциях. Один из механизмов защиты основан на способности гранулоцитов к продукции гипотиоцианата. Гипотиоционат чрезвычайно бактерициден и совместно с пероксидом водорода и другими активными формами кислорода действует на микрофлору в полости рта (в том числе кариесогенную). Однако высокие концентрации роданидов оказывают токсическое влияние на пародонт, способствуя развитию воспалительных процессов. Содержание роданидов (тиоцианатов) достаточно велико в слюне курильщиков (в 2‑10 раз выше, чем у некурящих людей), что связано с поступлением в их организм синильной кислоты, содержащейся в табачном дыме. Чем выше концентрация тиоцианатов в слюне, тем более заметной становится окраска. Оформление работы Указывают принцип метода, фиксируют результаты, сравнивают полученные у разных людей данные с нормальными величинами, делают вывод о наличии/отсутствии патологических отклонений и значении показателя. Лабораторная работа 6. a-Амилаза (диастаза, 1,4–a–D–глюкангидролаза, КФ 3.2.1.1) катализирует гидролиз a–1,4–гликозидных связей крахмала до декстринов и мальтозы: Крахмал + Н2О a‑Амилаза тканеспецифична, её продуцируют слюнные железы и поджелудочная железа. Главная роль a‑амилазы в организме ‑ пищеварительная, поэтому фермент секретируется экзокринно, поступая, соответственно, в ротовую полость и просвет 12-пёрстной кишки. До 70 % фермента в полость рта секретируют околоушные железы. В результате естественного старения и отмирания клеток слюнных и поджелужочной желёз молекулы фермента попадают в кровь, поэтому в плазме крови всегда в небольшом количестве содержится a‑амилаза двух изоферментных типов: слюнной S‑тип (около 70 %) и панкреатический P‑тип (около 30 %). Фермент имеет относительно низкую молекулярную массу (около 48000 D), в связи с чем фильтруется в почечных клубочках и присутствует в моче. Соотношение изоферментов в моче иное, чем в крови: Р‑тип – 70 %, S‑тип – до 30 %. Хлориды и иодиды повышают активность фермента. При нарушении целостности железистых клеток, вырабатывающих a‑амилазу, процессам цитолиза сопутствует повышение концентрации и активности фермента в плазме крови и моче, что используют с целью диагностики заболеваний слюнных и поджелудочной желёз. В моче этот фермент традиционно называют «диастаза». Энзиматический кинетический метод, Принцип метода
a‑Амилаза катализирует реакцию гидролитического преобразования специфического углеводного субстрата, протекающую с отщеплением от олигосахарида 2‑хлор‑4‑нитрофенола: 2‑Cl‑4‑нитрофенил‑олигоCAX + Н2О → 2‑Cl‑4‑нитрофенол + олигоCAX Скорость образования 2‑хлор‑4‑нитрофенола пропорциональна активности фермента и определяется фотометрически. Необходимые реактивы Стандартный набор: 1) буферный раствор (0,05 М MFS‑буфер (pH 6,0) и 5 ммоль/л раствор хлористого кальция), 2) лиофилизированный субстрат. Для приготовления рабочего реагента, содержащего субстрат в концентрации 2,5 ммоль/л, содержимое флакона с субстратом растворяют в буфере при аккуратном перемешивании и оставляют на 3‑5 минут для стабилизации. Материал для исследования 1) Ротовая жидкость (разведение 10‑50 раз), 2) сыворотка крови, 3) моча. Проведение анализа В кювете фотометра с длиной оптического пути 1 см смешивают рабочий реагент и исследуемую жидкость в соотношении 50:1 (рекомендуется использовать 3,5 мл рабочего реагента и 70 мкл сыворотки крови или разведённой слюны) и через 10 секунд измеряют оптическую плотность раствора (Е0) при длине волны 405 нм против воздуха. Измерение повторяют точно (по секундомеру) через 1 мин (Е1), 2 мин (Е2), 3 мин (Е3), не вынимая кювету из прибора. Расчёт Считают среднее значение изменения оптической плотности в минуту ΔЕ/мин. ΔЕ/мин = [(Е1 ‑ Е0) + (Е2 ‑ Е1) + (Е3 ‑ Е2)]: 3 Расчёт активности a‑амилазы производят по одной из формул (в зависимости от того, в каких единицах необходимо представить активность фермента): Активность a‑амилазы [Ед/л] = ΔЕ/мин · 3806 Активность a‑амилазы [нмоль/(с · л)] = ΔЕ/мин · 63446 Нормальные величины Значения активности a‑амилазы в сыворотке зависят от температуры анализа: при 25 °С ‑ до 120 Ед/л или до 2000 нмоль/(с · л) при 30 °С ‑ до 160 Ед/л или до 2670 нмоль/(с · л) при 37 °С ‑ до 220 Ед/л или до 3670 нмоль/(с · л) Колориметрический метод определения активности амилазы Принцип метода a‑Амилаза катализирует гидролиз нерастворимого цветного крахмального субстрата с образованием синего, растворимого в воде красителя. Количество освобождённого красителя пропорционально каталитической активности энзима. Необходимые реактивы 1) Фосфатный буфер pH=7,0, 2) крахмальный субстрат, 3) 9 ммоль/л раствор NaCl, 4) осаждающий раствор (1,85 ммоль/л раствор MgSO4 и 2 ммоль/л раствор сульфосалициловой кислоты).
Материал для исследования Свежая моча, сыворотка крови. Проведение анализа Готовят две опытных пробы (для свежей мочи и сыворотки крови), добавляя реагенты согласно приведенной ниже таблице, и далее обе обрабатывают одновременно.
В обе пробирки добавляют по 2,0 мл осаждающего раствора, тщательно перемешивают, через 15 мин уравновешивают и центрифугируют 5 мин при 3000 об/мин (или фильтруют через слой ваты). Измеряют оптическую плотность опытных проб против воды при длине волны 590 нм (зелёный светофильтр) в кювете с длиной оптического пути 10 мм. Нормальные величины Сыворотка крови 140‑350 Е/л, Моча 1000‑2000 Е/л. Расчёт Активность α–амилазы в сыворотке и моче находят по приведённой ниже калибровочной таблице, исходя из полученной оптической плотности. Найденную по таблице каталитическую активность a‑амилазы мочи необходимо умножить на 2. Если проба имеет высокую активность фермента, её разбавляют физиологическим раствором, снова проводят процедуру определения, полученный результат умножают на разведение.
Определение активности амилазы мочи (метод Бюхнера) Принцип метода Основан на определении времени, необходимого для полного расщепления 2 мг крахмала амилазой исследуемой порции мочи. Необходимые реактивы 1) Раствор Люголя (0,1 % раствор йода в 0,2 % растворе KJ), 2) 0,1 % раствор крахмала, 3) физиологический раствор (0,85 % раствор NaCl). Проведение анализа Отмеривают в пробирку 2,0 мл раствора крахмала, 1,0 мл физиологического раствора и помещают на 2 минуты в водяную баню при 37 °С. После прогревания в пробирку добавляют 0,5 мл мочи, перемешивают и отмечают время начала реакции. На предметные стёкла в 5‑6 местах наносят по капле раствора йода. Через каждые 3 минуты берут из пробирки исследуемую смесь и смешивают с очередной каплей йода. Инкубацию продолжают до тех пор, пока вместо сине‑фиолетового окрашивания не появится жёлтое, в этот момент гидролиз 2 мг крахмала можно считать законченным. Расчёт Активность α–амилазы рассчитывают по формуле:
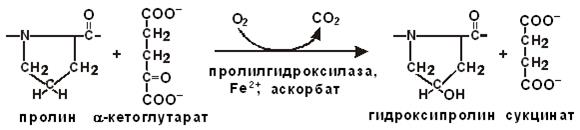
Активность амилазы [усл.ед.] = где: 15 – время, необходимое для расщепления 2 мг крахмала (мин), Нормальные величины Моча 1–2 усл. ед. (метод Бюхнера) Практическое значение работы Повышение активности фермента α‑амилазы происходит, главным образом, при воспалении и дегенеративных изменениях поджелудочной и слюнных желёз (например, при паротите ‑ воспалении колоушной железы). Особенно повышение выражено при остром некрозе поджелудочной железы, остром панкреатите, когда активность фермента в крови и моче возрастает в 10‑30 раз. В детском возрасте повышение наблюдается при эпидемическом паротите, что указывает на поражение вирусом паротита не только слюнных желёз, но и поджелудочной железы, иногда поражает поджелудочную железу вирус гриппа. Возрастание активности α‑амилазы выявляется при диабетическом кетоацидозе, беременности, почечной недостаточности, кишечной непроходимости, заболеваниях желчных путей, некоторых опухолях легких и яичников. Оформление работы Указывают принцип метода, регистрируют результаты, делают расчёты, сравнивают полученные данные с нормальными величинами, формулируют выводы о наличии/отсутствии патологических отклонений с учетом клинического значения определяемого показателя. Лабораторная работа 7. Буферная ёмкость слюны – способность нейтрализовать кислоты и щёлочи – обычно расценивается как защитный механизм полости рта, функционирующий по принципу саморегуляции. Буферная ёмкость поддерживается бикарбонатной, белковой и фосфатной буферными системами слюны. Бикарбонаты обеспечивают 50‑80 % буферных свойств слюны, их концентрация возрастает прямо пропорционально увеличению скорости ее секреции. Белковая система считается второй по значению, фосфатная – третьей. Кроме буферных систем слюна содержит ряд веществ (мочевина, ксиолин), гидролиз которых ферментами микрофлоры сопровождается выработкой аммония (NH4OH), оказывающего местное защелачивающее действие. Буферная ёмкость слюны значительно варьирует и зависит от характера питания, времени суток, состояния желудочно‑кишечного тракта. С увеличением скорости слюноотделения рН слюны возрастает, поэтому днём значения рН выше, чем ночью. Буферная способность слюны является главным механизмом снижения кислотной нагрузки на поверхность зуба и очень важна в механизмах защиты от кариеса. Принцип метода Сила буферных систем определяется их буферной ёмкостью, т.е. количеством молей кислоты или основания, которое необходимо добавить к буферному раствору, чтобы сместить его активную реакцию на единицу. Для слюны наиболее важно определение буферной ёмкости в отношении кислых продуктов, для чего добавляют фиксированный объём раствора соляной кислоты. Необходимые реактивы 1) 0,005 N раствор HCl, 2) 0,5 % раствор индикатора метилоранж. Материал для исследования Свежая слюна: нестимулированная и стимулированная. Проведение анализа Оценивают слюноотделение (количество выделяемой слюны в единицу времени) путём сиалометрии. Объём слюны измеряют специальным сиалометром или мерными цилиндрами на 10 мл, откалиброванными с точностью 0,1 мл. При сборе слюны в цилиндры удобно использовать воронки. Слюну собирают натощак или через 1,5‑2,0 ч после еды. Сбор слюны проводят в течение 2 мин: а) в состоянии покоя ‑ нестимулированная слюна, б) при стимулировании ‑ стимулированная слюна (на занятии сбор производят у разных студентов, в качестве стимулирующего агента используют парафин, лимон или лимонную кислоту). Для получения достоверных результатов процедуру повторяют трижды и вычисляют среднее значение. Проведение сиалометрии совмещают с анализом буферной ёмкости: к 01, мл слюны постепенно добавляют 3,0 мл 0,005 N раствора HCl и более. Расчёт На основе полученных данных вычисляют скорость слюноотделения в мл/мин. Рассчитывают буферную ёмкость 1 мл слюны. Нормальные величины Средняя скорость выделения слюны: состояние покоя 0,3‑0,4 мл/мин (границы колебаний широкие, перекрытие может быть 20‑30‑кратным); стимуляция возрастание скорости (стимуляция парафином увеличивает показатель до 1‑2 мл/мин). Буферная ёмкость слюны: норма ‑ 5‑7, пограничный уровень ‑ 4‑4,5, Практическое значение работы Особенное значение буферная ёмкость смешанной слюны приобретает при определении риска возникновения кариеса. Оформление работы Указывают принцип метода, фиксируют результаты, сравнивают полученные у разных людей данные с нормальными величинами, делают вывод о наличии/отсутствии патологических отклонений, отмечают клиническое значение показателей. Лабораторная работа 8. Аскорбат (витамин С) является водорастворимым витамином, не синтезируется в организме, излишки его выводятся с мочой. При недостатке в пище аскорбата развивается цинга, когда дефект соединительной ткани приводит к ломкости сосудов, кровоточивости дёсен, поражению кожи и деструкции в тканях пародонта (особенно в периодонтальной связке), что сопровождается расшатыванием и выпадением зубов. Витамин С при синтезе коллагена обеспечивает гидроксилирование аминокислотных остатков пролина под действием пролилгидроксилазы. В условиях дефицита аскорбата вновь синтезированный коллаген получается недогидроксилированным и не способен к образованию полноценных волокон. Витамин С и ионы Fe2+ являются кофакторами пролилгидроксилазы; выступая донором Н+, аскорбат поддерживает восстановленное состояние Fe2+ в активном центре фермента, предохраняя его от инактивации.
Наряду с синтезом коллагена витамин С стимулирует синтез гиалуроновой кислоты и хондроитинсульфата, необходимых для формирования матрикса соединительной ткани. Участие витамина С в окислительно-восстановительных реакциях используется в антиоксидантной защите. Аскорбат активно тратится при развитии воспалительных и инфекционных заболеваний (в том числе тканей полости рта) для защиты от токсинов и последствий активации перекисного окисления липидов и белков. Принцип метода Аскорбиновая кислота, содержащаяся в биологических пробах, восстанавливает 2,6‑дихлорфенолиндофенол (ДХФИФ). Концентрацию витамина С определяют по количеству затраченного на титрование красителя. Как только весь витамин в пробе окислится, титруемый раствор приобретает розовую окраску за счёт наличия в кислой среде недиссоциированных молекул ДХФИФ. Необходимые реактивы 1) 0,1 % раствор ДХФИФ (краска Тильманса), 2) 2 % раствор HСl. Материал для исследования Свежая моча. Проведение анализа В колбу отмеривают 5 мл мочи и 5 мл дистил. воды, перемешивают, добавляют 2,5 мл 2 % раствора HCl. Титруют краской Тильманса до розоватого цвета, сохраняющегося 30 сек. Регистрируют объём краски, пошедший на титрование. Расчёт Содержание аскорбиновой кислоты (мг) в суточном объёме мочи рассчитывают по формуле:
где: 0,088 ‑ количество витамина С, соответствующее 1 мл 0,088 моль/л раствора ДХФИФ (мг); А – количество краски Тильманса, затраченной на титрование (мл); Б – среднесуточный объём мочи (мужчины 1500 мл, женщины 1200 мл); В – объём мочи, взятый для титрования (мл). Нормальные величины Моча 20‑30 мг/сут или 113,55‑170,33 мкмоль/сут. Практическое значение Метод используют в клинике для диагностики недостаточности витамина С. Определение содержания витамина С в моче даёт представление об его запасах в организме, так как концентрация аскорбата в крови соответствует его количеству, выделяемому с мочой. Однако при гиповитаминозе содержание аскорбата в моче не всегда понижено, часто оно бывает в норме на фоне недостатка витамина в тканях и органах, что усугубляет гиповитаминоз. Уровень аскорбата снижается при острых и хронических инфекционных заболеваниях, а также при цинге, что сопровождается поражением периодонта, кровоточивостью дёсен. У здоровых людей введение per os 100 мг витамина С быстро приводит к повышению его концентрации в крови и моче. При гиповитаминозе С ткани, испытывающие недостаток в витамине, задерживают принятый аскорбат, и его концентрация в моче не повышается. Определение содержания витамина С Материал для исследования Картофель, плоды шиповника, лук, свежая и квашеная капуста, морковь. Проведение анализа
Аскорбат, мг | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| В 100 г продукта | Для суточной потребности | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Картофель | 5 | 20 | вата | 10 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Капуста свежая | 5 | 20 | вата | 10 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Капуста квашеная | 10 | 20 | вата | 10 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Морковь | 5 | 15 | вата | 1мл и 5 мл Н2О | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Лук репчатый | 5 | 20 | вата | 10 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Плоды шиповника | 1 | 20 | бумага | 1мл и 5 мл Н2О | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
При выполнении работы используют данные таблицы и заполняют пустые графы. Выбирают объект исследования для экстрагирования витамина С. Взвешивают навеску, измельчают в ступке ножницами, скальпелем, затем растирают с 5 мл 2 % раствора НCl, постепенно вливая воду, оставляют на 5 мин. Вытяжку фильтруют (тип фильтра определяют по таблице) в мерный цилиндр вместимостью 25 мл. Записывают общее количество полученного экстракта (V1). Отмеривают часть экстракта мерной пробиркой (объем V2 в таблице), переносят в колбу для титрования. Титруют краской Тильманса до розового цвета, сохраняющегося 30 с. Записывают объем краски, пошедший на титрование.
Расчёт
Рассчитывают содержание аскорбата (мг) в 100 г продукта (или на 100 мл)
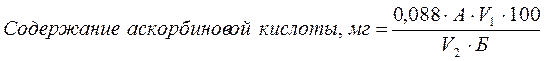
где: 0,088 ‑ количество витамина С, соответствующее 1 мл 0,088 моль/л раствора ДХФИФ (мг); А ‑ количество краски Тильманса, затраченной на титрование (мл); Б ‑ количество продукта, взятого для анализа; V1 ‑ общее количество экстракта (мл); V2 ‑ объем экстракта, взятый для титрования (мл); 100 ‑ коэффициент пересчета на 100 г (или 100 мл) продукта.
Учитывая концентрацию аскорбиновой кислоты, найденную в каждом растительном объекте, рассчитывают количество продукта, необходимое для удовлетворения суточной потребности в витамине С, результаты заносят в таблицу.
Нормальные величины
Суточная потребность 100–200 мг, при силовых нагрузках ‑ 250 мг.
В 100 г сырого картофеля 1–5 мг.
Оформление работы
Указывают принцип метода, регистрируют результаты анализа, делают расчёты, сравнивают с нормальными величинами, в выводах указывают обеспеченность организма аскорбиновой кислотой и лучшие пищевые источники.
Вопросы для самоконтроля
1) Состав и физико-химические свойства слюны, суточное количество. Виды слюнных желез и их участие в секреции слюны. Основные функции слюны.
2) Смешанная слюна или ротовая жидкость, отличие состава от слюны из протоков слюнных желез. Стимулированная и нестимулированная слюна.
3) Химический состав слюны. Минеральные и органические компоненты. Структурно-функциональная организация слюны, мицеллы и влияющие факторы, роль муцинов в устойчивости мицелл.
4) Роль минеральных элементов (макро- и микроэлементов) слюны в минерализации эмали зуба. Участие в минерализации зубной бляшки и камня.
5) Белки и ферменты слюны. Группы специфических белков, иммуноглобулины (sIgA и др.), лизоцим, их роль. Остаточный азот слюны, происхождение и значение основных компонентов. Роль в защелачивании, образовании камня.
6) Показатели кислотно-основного состояния полости рта, механизмы регуляции. Буферные системы слюны, буферная емкость. Причины нарушений КОС и системы компенсации. Значение сдвига рН в кислую сторону в деминерализации эмали и развитии кариеса.
7) Углеводы пищи и ферменты переваривания в полости рта, конечные продукты. Метаболический взрыв микрофлоры, химизм и последствия. Особенности биохимии кариесогенной и пародонтопатогенной микрофлоры.
8) Десневая жидкость, химический состав, биологическая роль, изменения при образовании карманов. Нейтрофилы десневой жидкости, значение.
9) Анаэробные процессы и гипоксия тканей пародонта, микрофлора полости рта и продукты гликолиза. Активация перекисного окисления липидов и синдром пероксидации в пародонте, последствия. Антиоксидантная защита, роль витаминов и ферментов, механизмы действия.
Тестовые задания
Выбрать один правильный ответ.
1. Специфическими белками слюны являются
1) лактоферрины
2) лептины
3) иммуноглобулины А
4) цистатины
5) α‑дефензины
2. Антимикробные свойства гистатинов слюны опосредованы наличием на N-конце молекул аминокислот
1) АСП, ГЛУ, СЕР
2) ГИС, ЛИЗ, АРГ
3) АСН, ГЛН, АЛА
4) СЕР, ТРЕ, ПРО-ОН
5) ГЛИ, ПРО, ТИР
3. Инкреторный фактор слюнных желёз паротин-S не может
1) снижать концентрацию кальция в крови
2) активировать гемопоэз, лейкоцитоз, стимулировать макрофаги
3) способствовать росту и обызвествлению зубов (особенно дентина, цемента, периодонтальной связки), костной и хрящевой ткани
4) снижать уровень глюкозы в крови (инсулиноподобное действие)
5) вызывать гиперплазию и гипертрофию самих слюнных желёз
4. Микрофлора полости рта утилизирует лактат путём включения в состав
1) левана
2) декстрана
3) мальтодекстрина
4) амилопектина
5) муреина
5. Секреторный компонент sIgА ротовой жидкости является белком
1) железистых клеток
2) клеток протоков
3) плазмы крови
4) плазматических клеток
5) десневой жидкости
6. Основными мицеллами слюны являются
1) {m[Ca3(PO4)2] n(H2PO4)– (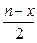 )Ca2+}х– ∙
)Ca2+}х– ∙ 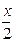 Ca2+
Ca2+
2) {m[Ca3(PO4)2] nCa2+ (n – х)(HPO4)2–}2х+ ∙ х(HPO4)2–
3) {m[(Ca3(РО4)2)] n(HPO4)2– (n-x)Са2+}2x– ∙ хСа2+
4) {m[Ca3(PO4)2] n(PO4)3– 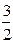 (n–х)Ca2+}3х– ∙
(n–х)Ca2+}3х– ∙ 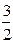 хCa2+
хCa2+
7. Ключевыми ионами слюны при расчёте произведения растворимости являются
1) Са2+ и HPO42–
2) Са2+ и H2PO4–
3) Na+, Cl– и Са2+
4) Na+, К+ и Са2+
5) HPO42– и H2PO4–
8. Резкое снижение насыщения слюны компонентами ГАП с переходом к деминерализующему состоянию происходит при критическом значении рН в диапазоне
1) 6,0‑5,8
2) 5,5‑4,5
3) 5,9‑5,5
4) 6,2‑6,0
5) 6,4‑5,8
9. Содержание белков в жидкости десневой борозды составляет
1) 60‑70 г/л
2) 50‑65 г/л
3) 65‑80 г/л
4) 50‑60 г/л
5) 70‑75 г/л
10. К ферментам десневой жидкости нельзя отнести
1) гиалуронидазу
2) кислую фосфатазу
3) лактатдегидрогеназу
4) щелочную фосфатазу
5) уреазу
Ситуационные задачи
1. У пациента обильное отложение зубного налета, множественный кариес, плохо отделяется слюна повышенной вязкости. При анализе в слюне обнаружено высокое содержание лактата. Указать, для какой патологии характерны данные признаки и какие причины лежат в основе плохого отделения слюны. Пояснить, каким образом зубной налет удерживается на поверхности зуба, почему повышение содержания лактата в слюне способствует развитию кариеса, при какой аутоиммунной болезни не только плохо отделяется слюна, но и снижена секреция слезной жидкости.
2. В слюне пациента определяется высокая активность АсАТ, АлАТ, кислых протеиназ и щелочной фосфатазы, рН слюны=8,2. Указать, для какого заболевания характерны данные изменения, и какие факторы, присутствующие в полости рта, предотвращают возникновение данного заболевания. Пояснить, почему в норме в слюне низкая активность протеиназ, и какие ингибиторы протеиназ присутствуют в смешанной слюне. Указать, какие продукты трансаминазных реакций образуют центры кристаллизации на поверхности эмали и показать, как это происходит.
3. Кальций-связывающий белок слюны протромбин, поддерживающий её свертывающую активность, содержит модифицированные аминокислотные остатки. Назвать, какие аминокислоты в его составе подвергаются посттрансляционной модификации, привести реакцию, указать фермент и кофермент. Пояснить, каково функциональное назначение модификации, как ионы кальция связываются модифицированными аминокислотами. Назвать другие белки организма, для которых характерна такая модификация вышеназванных аминокислот, указать локализацию и функцию этих белков.
ТЕМА
"Кровь, моча и почки. Жидкости полости рта и пародонт"
(контрольное занятие по разделам 11 и 12)
Вопросы для самоподготовки
Кровь, моча и почки
1. Понятие общего белка крови, компоненты, входящие в его состав. Физиологические функции белков крови, нормальные показатели концентрации. Причины изменения концентрации общего белка в крови.
2. Белковые фракции сыворотки крови. Характеристика альбуминов, биологическая роль, причины гипо‑, гипер‑ и анальбуминемий. Глобулины и их фракции, основные представители фракций (см. Приложение), биологическая роль.
3. Нормальные показатели белковых фракций, диспротеинемии и парапротеинемии. Причины изменения концентрации белковых фракций в крови. Нормальная протеинограма. изменение соотношения белковых фракций при остром и хроническом воспалении, заболеваниях печени, почек, опухолях.
4. Характеристика небелковых азотсодержащих компонентов крови (фракции остаточного азота). Роль и метаболизм мочевины, креатина/креатинина, мочевой кислоты. Клинико-диагностическое значение определения этих веществ в крови, их нормальные показатели. Причины и последствия гипераммониемий и азотемий. Понятие клиренса.
5. Характеристика ферментов крови (плазмоспецифичные, индикаторные, экскреторные), примеры. Использование ферментов крови для диагностики заболеваний.
6. Особенности метаболизма и функций эритроцита. Роль гликолиза и пентозофосфатного пути.
7. Метаболизм железа. Пищевые источники, нормы потребления, транспорт, депонирование и мобилизация, роль трансферрина и ферритина. Клинические и лабораторные признаки недостаточности железа.
8. Строение молекулы гемоглобина. Строение гема. Нормальные и патологические формы гемоглобина. Механизм регуляции сродства гемоглобина к кислороду (роль 2,3‑дифосфоглицерата, эффект Бора и кооперативный эффект).
9. Реакции синтеза гема и гемоглобина. Регуляция процессов синтеза. Характеристика нарушений обмена гемоглобина (порфирии, талассемии, гемоглобинозы).
10. Реакции распада гема, образования билирубина и билирубинглюкуронида, локализация. Основные этапы превращения желчных пигментов в организме. Пути выведения билирубина и желчных пигментов.
11. Нарушения обмена желчных пигментов. Лабораторные критерии различных видов желтухи (надпеченочной, печеночной, подпеченочной).
12. Дыхательная функция крови. Механизмы транспорта кислорода и углекислого газа. Способы регуляции.
13. Характеристика показателей кислотно-основного состояния (КОС). Химические и физиологические механизмы регуляции кислотно-основного состояния в организме. Взаимосвязь транспорта кислорода и углекислого газа с механизмами поддержания кислотно‑основного состояния.
14. Роль почек в регуляции кислотно‑основного состояния: реабсорбция бикарбонатов, ацидогенез, аммониогенез.
15. Нарушения кислотно‑основного состояния, его причины, изменение показателей кислотно‑основного состояния. Способы компенсации при различных нарушениях КОС.
16. Характеристика биохимических процессов в нефроне. Противоточно-умножительный механизм образования мочи. Особенности реабсорбции электролитов и воды в различных отделах нефрона. Роль гормонов в процессах реабсорбции.
17. Вазопрессин (антидиуретический гормон) и минералокортикоиды: химическая природа, место синтеза, регуляция синтеза и секреции, органы-мишени, локализация рецепторов и механизм действия, влияние на обмен веществ и воды. Роль ренин‑ангиотензиновой системы. Состояния, обусловленные нарушением действия гормонов. Биохимические механизмы развития почечной гипертензии.
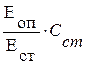 ,
,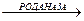 Na2SO3 + KSCN
Na2SO3 + KSCN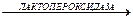 OSCN– + H2O
OSCN– + H2O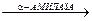 мальтоза + декстрины
мальтоза + декстрины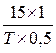 ,
,